硫酸庆大霉素片的质量评价
2019-03-29姚永青梅芊王立萍郜继东李少杰刘英
姚永青 梅芊 王立萍 郜继东 李少杰 刘英
(河南省食品药品检验所,郑州 450018)
庆大霉素为美国Schering公司Weinstein等于1963年发现[1],1966年其硫酸盐应用于临床,1965年我国中科院福建微生物研究所分离得到产生菌,1969年经研制成功后并投入生产[2]。硫酸庆大霉素是一种杀菌力较强的广谱抗生素,抗菌谱广、抗菌作用强,其抗菌作用机理为与细菌核糖体30S亚单位结合,抑制细菌蛋白质的合成,妨碍初始复合物的合成,从而导致细菌死亡[3],常见毒副作用为耳、肾毒性。庆大霉素为发酵产生的多组分氨基糖苷类抗生素,临床上使用的庆大霉素主要由C1、C1a、C2和C2a4个活性成分组成,另外还有多种微量次要组分,各组分的毒性与抗菌能力有一定的差异,因此复合物中各组分比例与有关物质含量的变化关系着产品的疗效与毒副作用,并且影响到产品的质量[4]。
硫酸庆大霉素口服基本不吸收,在肠道中能达高浓度,临床适用于肠道感染与结肠手术前准备[5]。检索河南省食品药品评价中心数据库,近5年不良反应主要有恶心、呕吐与食欲异常等,无严重不良反应。
中国药典2015年版(ChP2015)[6]收载原料、注射剂、片剂与颗粒剂,美国药典(USP40)[7]与英国药典2017(BP2017)[8]收载原料、注射剂与滴眼剂等,欧洲药典(EP9.0)[9]收载原料,日本药典(JP17)[10]收载原料与滴眼剂,国外药典均未收载片剂。
硫酸庆大霉素片被列入2017年度国家药品质量评价抽验计划,有20mg(2万单位)与40mg(4万单位)2个规格,本次抽验涉及40mg(4万单位)1个规格。本研究在完成法定标准检验的基础上,围绕药品的有效性、安全性与标准的可控性,从稳定性、有关物质、庆大霉素C组分与溶出行为等方面进行探索性研究,依据法定检验与探索性研究实验结果,对国内市场上硫酸庆大霉素片的产品质量进行分析,并为进一步完善质量标准提供参考。
1 仪器与试药
1.1 仪器与试剂
Waters2695高效液相色谱仪(Alltech 2000ES蒸发光散射检测器,Empower色谱工作站),RCZ-8M溶出试验仪(天津市天大科技有限公司),Lambda 35紫外可见分光光度计(美国PE公司),ZB-1D智能崩解仪器(重庆雅马拓科技有限公司),BD240孵卵箱(德国BINDER公司),ZY-300IV多功能微生物自动测量仪(北京先驱威锋技术开发公司),YB-2型澄明度检测仪(天大天发科技有限公司),XPE205电子天平(梅特勒-托利多仪器(上海)有限公司)。
三氟乙酸为色谱纯(Dikma公司),甲醇为色谱纯(Merck公司),氮气为高纯氮;其余试剂均为分析纯,水为MillQ去离子水。
1.2 样品
庆大霉素标准品(批号:130326-201015,含量C114.7%,C1a15.3%,C2a8.5%,C218.5%;630u/mg),小诺霉素标准品(批号:130342-201404,含量51.8%),西索米星对照品(批号:130635-201301,含量56.0%),均由中国食品药品检定研究院提供。
156批次硫酸庆大霉素片均为2017年国家药品计划抽验样品,包括糖衣片117批次(来自8家生产企业)、薄膜衣片27批次(来自1家生产企业)、素片12批次(来自2家生产企业)。影响因素试验样品:硫酸庆大霉素片(批号:2170528,规格40mg,糖衣片,A企业),硫酸庆大霉素片(批号:1705171,规格40mg,薄膜衣片,I企业)
2 试验方法
2.1 法定标准检验
法定标准为ChP2010年版二部[11]、ChP2015年版二部[6]与国家药品监督管理局药品补充申请批件(批件号:2002HFB0226)。ChP2010年版二部与ChP2015年版二部质量标准项目设置与限度均相同,注册标准为薄膜衣片,其项目设置与限度与ChP2015年版二部相同。
2.2 探索性研究
参照ChP2015年版二部硫酸庆大霉素质量标准[6]建立片剂有关物质与庆大霉素C组分测定方法,并对156批次样品进行考察;参照ChP2015年版二部硫酸庆大霉素缓释片[6]质量标准建立片剂溶出度测定方法,并对不同企业与不同批次的样品进行溶出度考察。
2.2.1 有关物质
色谱柱:GRACE Apollo C18(4.6mm×250mm,5μm);流动相:0.2mol/L三氟乙酸溶液-甲醇(96:4),110℃,载气(氮气)流量2.8L/min,柱温35℃,供试品溶液浓度1.0mg/mL,进样量50μL。拟定标准限度为:含西索米星不得过标示量的2.0%,小诺霉素不得过标示量的3.0%。除硫酸峰、亚硫酸峰和糊精峰等辅料峰外,其他杂质峰按西索米星双对数线性回归方程计算,其他单个杂质不得过标示量的2.0%,其他杂质总量不得过标示量的4.5%。
2.2.2 庆大霉素C组分
色谱柱:GRACE Apollo C18(4.6mm×250mm,5μm);流动相:0.2mol/L三氟乙酸溶液-甲醇(96:4,V/V),流速0.6mL/min,蒸发光散射检测器漂移管温度110℃,载气(氮气)流量2.8L/min,柱温35℃,供试品溶液浓度1.0mg/mL,进样量25μL。拟定标准限度为:C1应为标示量的15.3%~28.0%,C1a应为标示量的19.6%~48.0%,C2a+C2应为标示量的28.5%~63.8%,4个组分总含量不得低于标示量的90%。
2.2.3 稳定性
制剂生产工艺的影响:采用新建方法对调研所得原料与其对应制剂的有关物质与组分进行测定。
影响因素试验[12]:取影响因素试验样品分别置于60℃恒温培养箱中(高温试验);置于底部放置KNO3饱和溶液的干燥器中,放入25℃恒温培养箱(高湿试验);置于光照度4500Lx下(强光照射试验)。各放置条件的样品均于5d与10d取样。
2.2.4 溶出行为
溶出曲线溶出条件:浆法,50r/min,溶出介质为pH1.2盐酸溶液、pH4.0醋酸盐缓冲液、pH6.8磷酸盐缓冲液与水共4种,溶出介质体积900mL,薄膜衣片与素片分别于15与30min取样,糖衣片分别于10、20、30、45、60与75min取样。
测定方法:取续滤液与0.04mg/mL对照溶液各3mL于具塞试管中,加异丙醇2.2mL,邻苯二醛试液0.8mL,密塞,摇匀,置于60℃水浴中加热15min,冷却至室温,照紫外-可见分光光度法,在300~400nm的波长范围内扫描一阶导数光谱图,在350~360nm的波长最大峰谷处分别测定吸光度。
3 试验结果
3.1 法定标准检验结果
按法定标准检验,156批次片剂均符合规定,合格率100%。结果见表1。
3.1.1 崩解时限
由表1可知,117批次糖衣片的完全崩解时间为9~36min,27批次薄膜衣片的完全崩解时间为9~19min,12批次素片的完全崩解时间为5~6min,均在规定时间内完全崩解。但不同企业糖衣片崩解时间差异较大,崩解较快的A企业为9~14min;崩解较慢的H企业为23~36min,分析与企业的制剂生产工艺有关。
3.1.2 含量测定
法定标准为抗生素微生物检定法,156批次样品含量为91.8%~107.8%,均符合规定。其中A企业与C企业含量结果RSD值均较大,分析与批间原料差异以及制剂生产工艺有关。
3.1.3 小结
庆大霉素为发酵产生的氨基糖苷类抗生素,除C1、C1a、C2和C2a4种主要组分外,还有多种微量组分,各组分的毒性与抗菌能力有一定的差异。现行标准设置较简单,仅采用效价法检测制剂的含量,而效价法是对制剂综合活性的检测,未对主要组分与有关物质进行控制,存在药物使用的有效性与安全性风险,现行质量标准存在不能有效控制药品质量的风险。

表1 硫酸庆大霉素片法定标准检验结果Tab.1 Legal standard test results of gentamicin sulfate tablets
3.2 探索性研究结果
根据现行标准检验结果与对该制剂的综合分析,从稳定性、有关物质、庆大霉素C组分与溶出行为4方面进行探索性研究。
3.2.1 片剂稳定性
采用新建方法对从企业调研所得原料与其对应制剂的有关物质进行检测考察制剂生产工艺的影响。结果显示原料与其对应制剂的有关物质含量基本一致,表明硫酸庆大霉素性质稳定,制剂生产过程中不再产生新的杂质,杂质含量也不再增加。表明制剂生产工艺对有关物质无影响。结果见表2。
影响因素试验对影响因素实验样品的性状、崩解时限、庆大霉素C组分、有关物质与含量进行考察。结果见表3。
由表3可知,高温试验5d与10d,糖衣片与薄膜衣片除去包衣后颜色均加深,有关物质、庆大霉素C组分、崩解时限与含量均基本无变化;高湿试验与强光照射试验后,糖衣片与薄膜衣片的各考察项均基本无变化。分析糖衣片与薄膜衣片高温试验后除去包衣颜色加深的原因是片剂中的辅料如淀粉和蔗糖等高温后颜色加深导致,但有关物质、庆大霉素C组分与含量均基本无变化,表明其主要活性成分与有关物质均未发生变化,高温对药品质量无影响。因此硫酸庆大霉素片对高温、高湿度与强光照射稳定。
3.2.2 有关物质
采用新建方法对156批次样品进行检测,结果148批次样品符合原料有关物质标准的规定,8批次样品不符合规定。有关物质典型色谱图见图1,各企业样品有关物质含量分布见图2。
由图1可知,不符合原料有关物质标准规定的样品的有关物质色谱峰个数明显多于符合标准规定样品,同时前者的有关物质含量明显高于后者。由图2可知,两企业共8批次样品不符合原料有关物质标准规定,结果见表4。其余148批次样品均符合原料有关物质标准规定。
文献报道庆大霉素对光、空气、热、稀酸与稀碱稳定,在pH2~9的条件下加热0.5h不影响其活性,120℃高压灭菌1h其活性仅损失10%[13]。我科室承担2012年国家药品计划抽验品种硫酸庆大霉素注射液,其终端灭菌工艺为121℃,15min,经探索性研究,注射液生产过程中未产生新的杂质,杂质含量也未增加[14]。本次硫酸庆大霉素片影响因素试验表明硫酸庆大霉素性质稳定。综合以上原因,分析该8批次样品不符合原料有关物质标准规定原因为企业采用不合格原料进行生产导致样品有关物质不符合规定。而现行质量标准未控制有关物质,仅控制效价含量,因此未能对药物进行有效控制,存在药物安全性风险,建议增加有关物质检查项。
3.2.3 庆大霉素C组分
采用新建方法对156批次样品进行检测,结果148批次样品符合拟定标准规定,4批次样品在拟定标准限度边缘,4批次样品不符合拟定标准规定。典型色谱图见图3。
庆大霉素C组分结果在拟定标准限度边缘的4批次样品与不符合拟定标准的4批次样品的有关物质项不符合原料有关物质标准规定,因此进一步证明了上述8批次样品不符合规定,分析原因为企业采用不合格的原料进行生产导致。结果见表4。
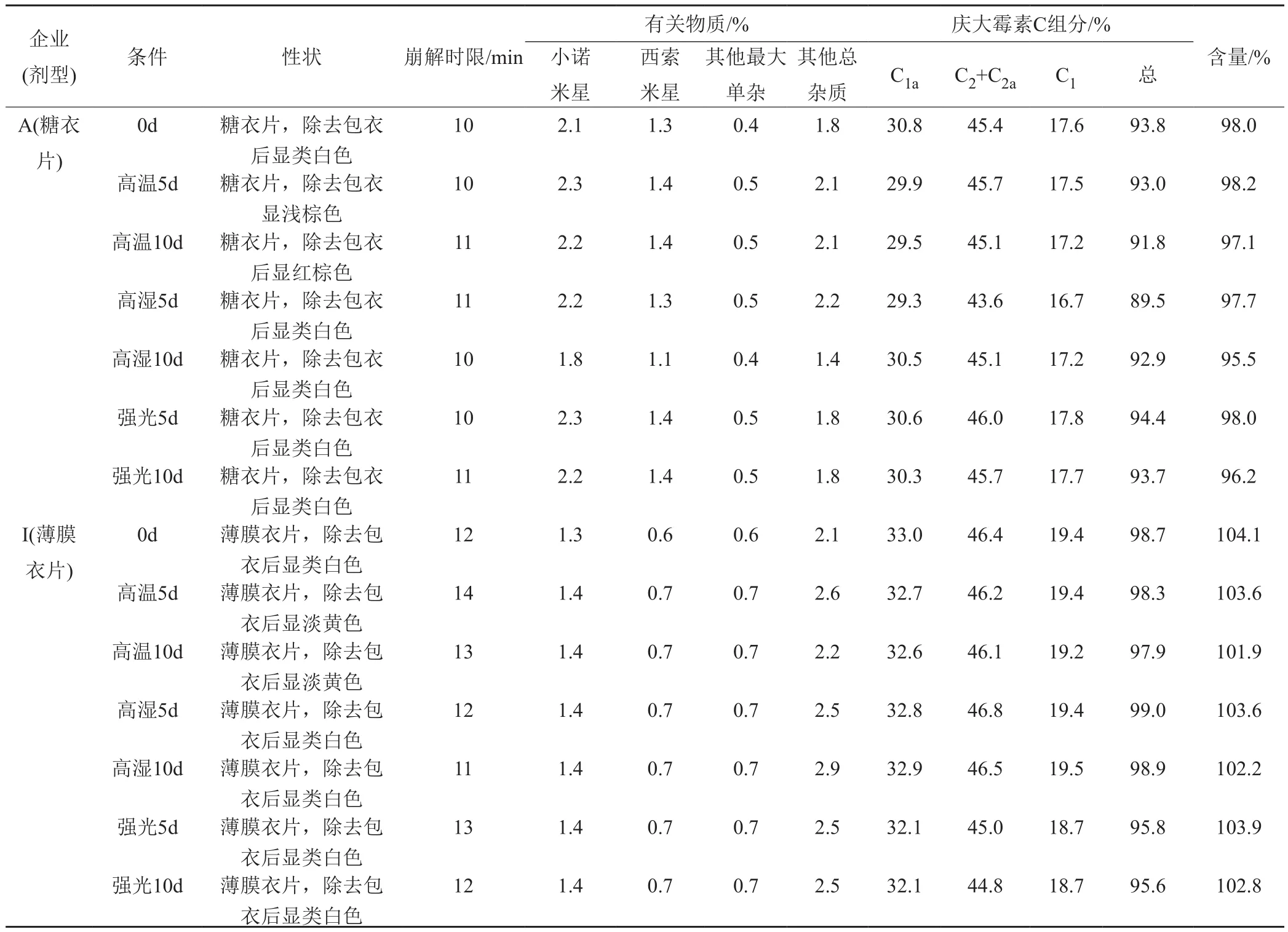
表3 影响因素样品试验结果Tab.3 Test results of in fl uence factor samples

图1 硫酸庆大霉素片有关物质HPLC色谱图Fig.1 The chromatograms of related substances of gentamicin sulfate tablets
现有质量标准仅对效价含量进行控制,未控制庆大霉素C组分与有关物质。由表4可知,该8批次样品效价法含量符合规定,按现有标准检测产品合格,但根据探索性研究结果,该8批次样品有关物质不符合原料有关物质规定,因此现有质量标准不能有效控制产品的质量,存在药物有效性与安全性的风险。建议增加有关物质与庆大霉素C组分检查。
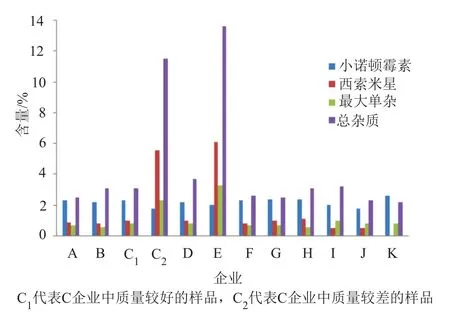
图2 硫酸庆大霉素片有关物质含量分布图Fig.2 Distribution of relative substances of gentamicin sulfate
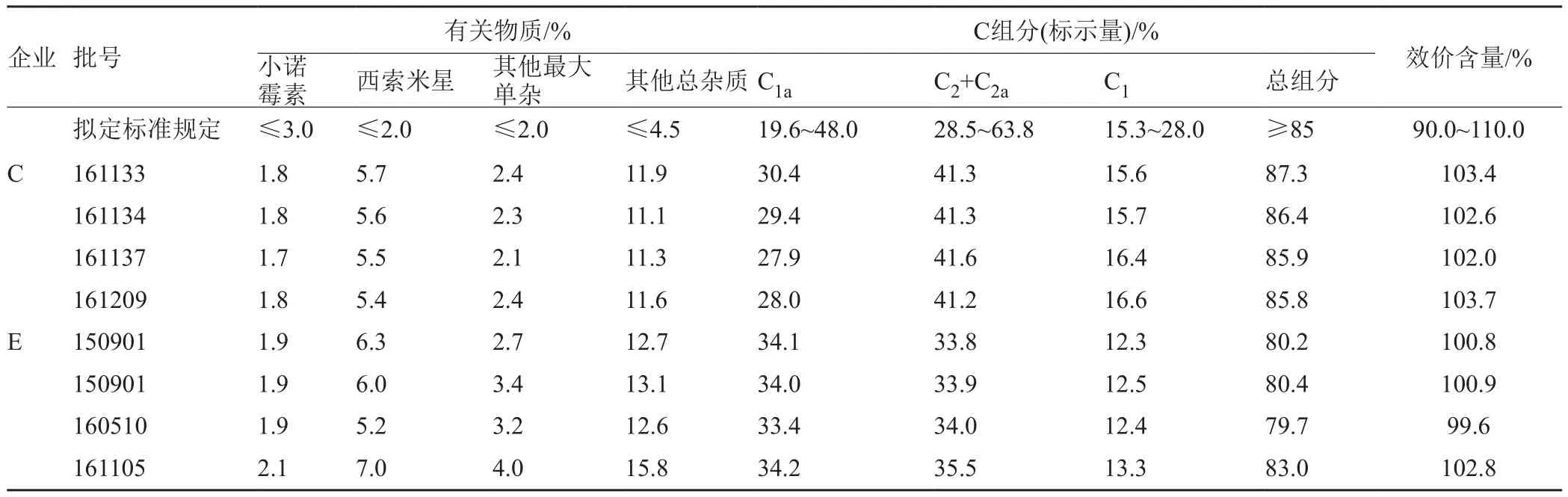
表4 不符合原料有关物质标准规定样品结果Tab.4 The results of the samples do not conform to the formulated standard
3.2.4 溶出行为
硫酸庆大霉素片易溶于水,口服基本不吸收,属于BCSⅢ类(高溶解性低渗透性药物),在肠道中能达高浓度,用于治疗肠道感染与结肠手术前准备,因此药物的溶出是保证药物有效性的关键因素。本次国家药品计划抽验156批次样品,包括素片12批(2企业),薄膜衣片27批次(1企业),糖衣片117批次(8企业)。本次试验选择素片、薄膜衣片各1批次、糖衣片4批次(4企业)分别进行在pH1.2盐酸溶液、pH4.0醋酸盐缓冲液、pH6.8磷酸盐缓冲液、水4种介质中溶出行为的研究。
结果薄膜衣片(批号:1508281,I企业)、素片(批号:160601,J企业)在pH1.2溶出介质中,15min时的平均溶出度分别为94%和99%,均大于85%,参考文献[15]要求,可知薄膜衣片与素片的溶出行为良好,不再进行另外3种溶出介质中的研究。4个企业糖衣片在4种溶出介质中的溶出曲线见图4,糖衣片在4种溶出介质中的批内溶出度RSD图见图4。
由图4~5可知,A企业的糖衣片(批号:150723)在pH1.2溶出介质中溶出较快,在水中溶出较慢;批内溶出度的RSD值在pH1.2溶出介质中较小,在其余介质中均较大,在水中最大。C企业的糖衣片(批号150402)在pH1.2溶出介质中溶出较快,在其他3种溶出介质中溶出行为基本一致;在4种介质中样品溶出度的RSD值均较大。E企业的糖衣片(批号:150901)在pH1.2溶出介质中溶出较快,在其他3种溶出介质中溶出稍慢;样品溶出度的RSD值在pH1.2溶出介质中较小,在其他3种溶出介质中均较大。H企业的糖衣片(批号:20141005)在4种溶出介质中溶出均较慢;样品溶出度的RSD值在pH1.2溶出介质中较小,在其余介质中均较大。
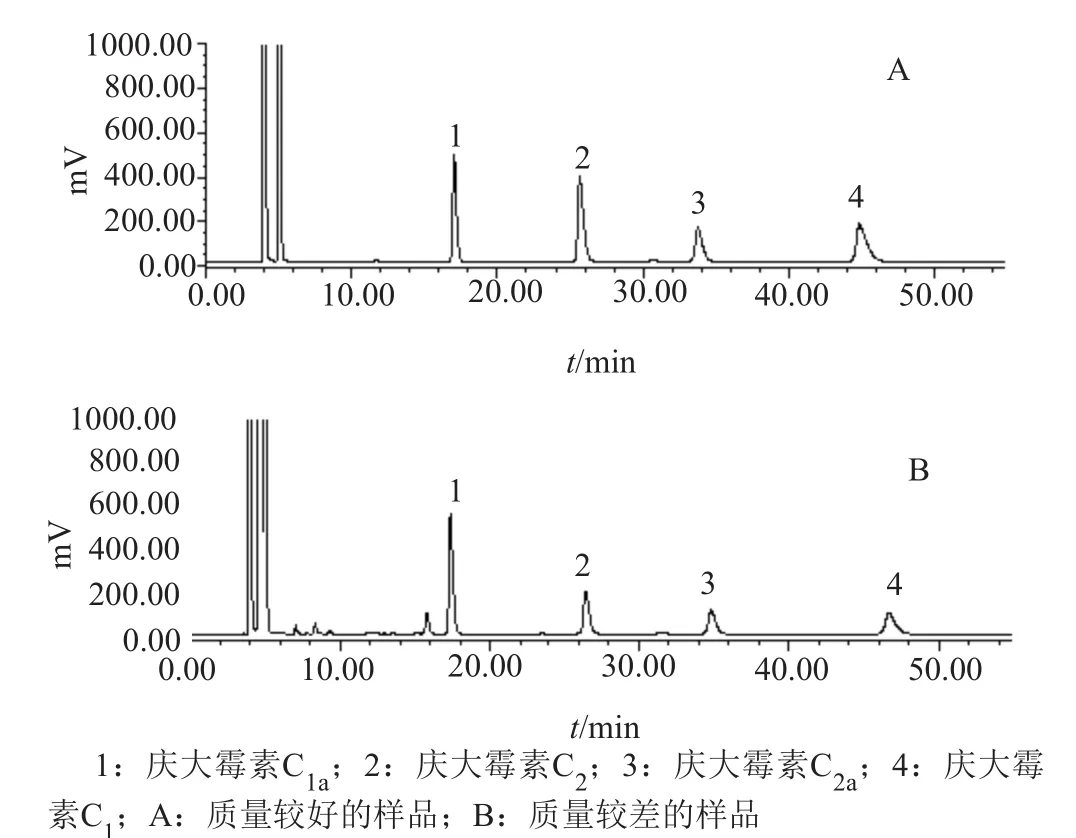
图3 庆大霉素C组分典型色谱图Fig.3 The chromatograms of gentamicin C component
4个企业糖衣片在pH1.2溶出介质中的溶出度大于80%的时间与崩解时限比较见表5。
采用SPSS软件,对表5中溶出量超过80%所需时间和完全崩解时间进行双变量相关分析,结果两者相关系数为0.989,显著性水平为0.011,小于0.05,表明两者呈正相关。因此法定标准崩解时限检查法能一定程度上反映样品的溶出行为,可以不控制其溶出度。
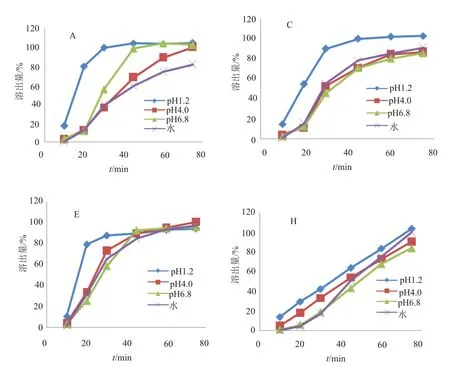
图4 不同企业糖衣片在4种溶出介质中的溶出曲线Fig.4 Dissolution curves of sugar coated tablets from different enterprises in four dissolving media

图5 不同企业糖衣片在4种溶出介质中的批内溶出度RSDFig.5 RSD of the dissolution of the batch of sugar coated tablets from different enterprises in four media
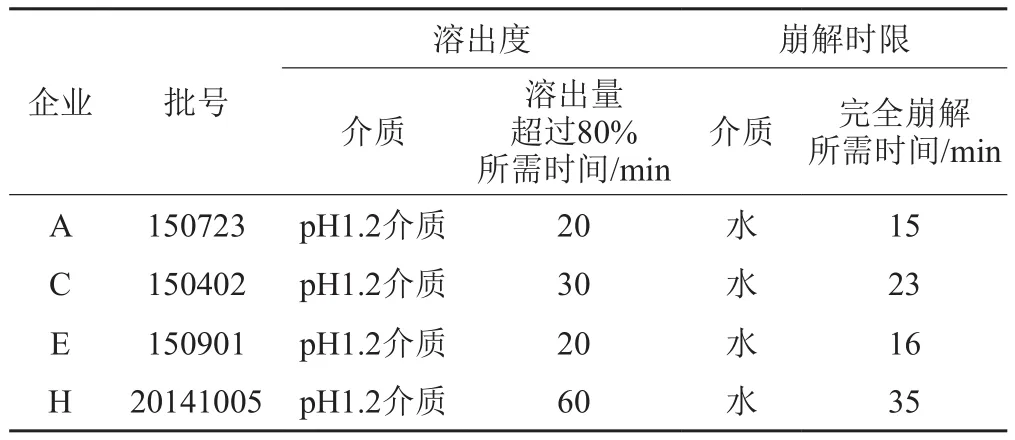
表5 糖衣片的溶出度与崩解时限Tab.5 Dissolution and disintegration time of sugar coated tablets
在禁食状态下,胃内滞留(排空)T50%时间为15~20min,对于某些高溶解性低渗透性药物,以0.1mol/L 盐酸溶液为介质,在适当的溶出度试验条件下,15min的溶出度大于85%时,可认为药物制剂的生物利用度不受溶出行为的限制,即制剂的行为与溶液相似[15],因此素片和薄膜衣片的溶出行为良好,对应的崩解时间分别为5与9min,表明素片和薄膜衣片剂型较合理,符合该药品需要快速起效的要求。糖衣片中A与E企业的样品在pH1.2溶出介质中的溶出行为均较好,在另外3种溶出介质中的溶出行为相对较差,对应的崩解时间分别为15与16min;C企业的样品在pH1.2溶出介质中的溶出行为一般,在另外3种溶出介质中的溶出行为相对较差,其崩解时间为21min;H企业的样品在4种溶出介质中均缓慢溶出,不能满足该药品需要快速溶出的要求,其崩解时间为35min;因此提示H企业应考察并优化片剂的处方与生产工艺,提高药物的崩解速率,以确保药物的有效性。4家糖衣片企业的样品批内溶出度RSD值均较大,表明批内片剂质量差异均较大,提示各生产企业应规范生产工艺,保证产品质量的稳定性。
4 讨论
4.1 片剂质量
按法定标准对本次国家药品计划抽验片剂检验,合格率100%,结合探索性研究结果,发现2家企业共8批次样品的有关物质不符合原料有关物质标准规定,该8批次样品中4批次的庆大霉素C组分不符合拟定标准规定,4批次在拟定标准规定低限,由于硫酸庆大霉素稳定,生产工艺对产品质量无影响,分析有关物质与庆大霉素C组分不符合规定原因是企业采用不符合规定的原料进行生产。因为硫酸庆大霉素片主要用于治疗肠道疾病,要求片剂能快速释放起效,素片与薄膜衣片溶出行为良好,不同企业的糖衣片溶出行为不同,H企业糖衣片的溶出行为较差。综上,硫酸庆大霉素片的质量一般。
4.2 质量标准可控性
硫酸庆大霉素片为临床常用药,生产量较大,临床应用较广泛。按法定标准检验,156批次样品均符合规定,但通过探索性研究试验,8批次样品有关物质不符合原料有关物质标准规定,4批次样品庆大霉素C组分不符合拟定标准规定,存在药物安全性与有效性的隐患,现行标准仅通过效价法控制含量,效价法测定的是药物中主要活性成分与其他微量组分等的综合活性效价,效价法含量符合规定并不表明药物的主要活性成分与其他微量组分符合规定。因此法定标准未能有效控制产品的质量,建议增加庆大霉素C组分与有关物质项,以保证药物的安全有效。
4.3 剂型合理性
硫酸庆大霉素为水溶性药物,但口服基本不吸收,在肠道能达高浓度,主要用于治疗肠道疾病,要求片剂能快速释放起效。因此,薄膜衣片与素片为较理想的剂型,能够快速释放达到治疗效果,糖衣片在各溶出介质中溶出相对缓慢,且批内RSD相对较大,建议糖衣片企业优化处方与生产工艺,保证药物的有效性。
