国产注射用硫酸头孢匹罗质量评价
2019-03-29李伟曹晓云郭福庆杨倩刘海玲
李伟 曹晓云 郭福庆 杨倩 刘海玲
(天津市药品检验研究院,天津 300070)
硫酸头孢匹罗是Hoechst(德国)和Roussel(法国)公司研制的第四代头孢菌素,1992年在瑞典上市,1999年德国安万特公司获进口许可,同年石药集团中诺药业获批准文号,国内首仿[1]。其抗菌作用强,抗菌谱广,对革兰阳性菌(如葡萄球菌属、粪肠球菌)、革兰阴性菌(如布兰球菌属、假单胞菌)及厌氧菌敏感,对β-内酰胺酶稳定,可治疗敏感细菌引起的呼吸系统感染、泌尿系统感染、腹腔感染、盆腔感染和败血症等[2-3]。本品为注射用无菌粉针剂,有0.25、0.5、1.0和2.0g共4个规格。原料企业42家,批准文号43个;制剂企业58家,批准文号112个。注射用硫酸头孢匹罗在中国药典2015年版、欧洲药典EP9.0、美国药典USP40、英国药典BP2017及JP17均未收载;进口药品注册标准为JX19980078。国内生产企业均执行国家局颁布的注册标准。JP17收载硫酸头孢匹罗原料。
为加强对国家基本药物质量的监督管理,客观的评价药品的质量现状,分析产品的主要质量问题,进而明确提高产品质量的方向[4]。本文在完成法定标准检验的基础上,结合探索性研究对检验结果进一步分析,进而对国产注射用硫酸头孢匹罗的质量现状进行评价。
1 仪器与试药
1.1 仪器
Agilent 1260 series高效液相色谱仪;岛津20A高效液相色谱仪;Shimadzu离子阱飞行时间质谱仪LCMS-ITTOF,LCMS solution V3.80工作站;Shinadzu DTG-60热重分析仪;Novasina LabMaster水分活度仪;Bruker D2phaser X-射线粉末衍射仪;Malvern APA2000粒度仪;Bruker Matrix-F型近红外光谱仪;Dionex ICS-5000离子色谱仪;Varian AA240-FS 原子吸收分光光度计。
1.2 试药
硫酸头孢匹罗对照品(82.8%)由中国食品药品检定研究院提供;来自国内4家生产企业的12批注射用硫酸头孢匹罗均为2017年国家评价性抽验样品;磷酸、磷酸二氢氨、三乙胺为分析纯,甲醇、乙腈为色谱纯,水为超纯水。
2 实验方法
2.1 法定检验
法定检验注射用硫酸头孢匹罗的质量标准均未在各国药典收载,我国也尚无统一的国家标准,执行标准为各生产企业获批的国家食品药品监督管理局注册标准。本次检验涉及的4个执行标准(YBH38002005、YBH35282005、YBH07712006和YBH03142012)均设置有性状、HPLC法鉴别、酸碱度、溶液的澄清度与颜色、有关物质、干燥失重、细菌内毒素、无菌、不溶性微粒、装量差异、可见异物和含量测定项目,部分标准设有化学鉴别、结晶性、头孢匹罗聚合物检查等项目。
2.2 探索性研究
根据法定检验结果以及检验中发现的问题,结合制剂处方工艺及专项调研中对该品种的了解,围绕原料及制剂的生产工艺、质量标准等方面,本次探索性研究重点关注该品种的安全性、工艺合理性、质量标准的可控性等方面的内容。
2.2.1 有关物质Ⅰ研究[5-7]
色谱条件:色谱柱:Agilent XDB C18(250mm×4.6mm, 5μm);以0.03mol/L磷酸二氢铵溶液[用磷酸调节pH值至(3.3±0.1)]-乙腈(90:10)为流动相A,以0.03mol/L磷酸二氢铵溶液[用磷酸调节pH值至(3.3±0.1)]-乙腈(60:40)为流动相B,按表1梯度洗脱程序进行线性梯度洗脱;流速:1.0mL/min;柱温:35℃;检测波长:270nm;进样量:20μL,分别注入液相色谱仪,记录色谱图。
2.2.2 有关物质Ⅱ研究[8-10]
色谱条件:色谱柱:球状亲水硅胶(分子量适用范围为500~15000)为填充剂[TSK-GELG2000SWXL,(7.8mm±300mm, 5μm);或效能相当的色谱柱];流动相:磷酸盐缓冲液[0.005mol/L磷酸氢二钠-0.005mol/L磷酸二氢钠溶液(50:50,V/V)]-乙腈(90:10);流速:1.0mL/min;检测波长:254nm;进样量:20μL,分别注入液相色谱仪,记录色谱图。
2.2.3 碳酸钠含量测定[10]
实验条件:波长:330.3nm;狭缝:0.2nm;灯电流:5.0mA。取对照品溶液及空白溶液在330.3nm的波长处测定吸光度,以浓度为横坐标,以相应的吸光度平均值为纵坐标绘制标准曲线,取供试品溶液同法测定,由标准曲线计算得供试品溶液中钠离子的相应浓度,并计算供试品中碳酸钠的含量。

表1 梯度洗脱程序Tab.1 Linear gradient elution program
2.2.4 制剂中的水分研究[11]
采用热重法和水活度测定法,考察样品中游离水和结晶水。利用热重分析仪及水活度仪对本品制剂和原料中水分的分布情况进一步研究。
热重法:取样品适量置于热重分析仪内微热天平上的器皿内,起始温度为30℃,以10℃/min的速度加温至300℃。
水分活度测定法:取样品适量置于仪器中的样品皿中,设定温度为25℃,平衡时间为25min。
2.2.5 引湿性对样品稳定性影响的研究[12]
根据中国药典2015年版四部通则9103药物引湿性试验指导原则[13],对每个制剂生产企业的各一批样品以及企业B提供的原料进行引湿性试验,并测定引湿前后各样品的水活度,然后对引湿前后样品的有关物质进行测定,判断水分对药品稳定性的影响。
2.2.6 晶型与粒度分布研究[11]
3 结果与分析
3.1 法定检验结果与分析
按现行质量标准检验,4家企业的12批次样品均符合规定,合格率100%。对现行质量标准与产品质量密切相关的质控项目如酸碱度、溶液的澄清度与颜色、有关物质、头孢匹罗聚合物和含量测定等结果进行统计分析。
3.1.1 酸碱度
对12批样品酸碱度测定值进行统计分析,平均值为6.14,分布范围为5.60~6.77,不同生产企业样品酸碱度的平均值略有差异,A企业的样品pH均值最低,为5.93;而C企业的样品pH均值最高,为6.68。A企业来自不同抽样地点的批号相同的3批产品,其pH值分别为6.61、5.76和5.60。来自企业仓库的样品pH值明显高于其他抽样地点的两批样品。本产品是由硫酸头孢匹罗与一定量的无水碳酸钠混合制成的,碳酸钠的含量直接影响制剂的pH值大小。结合该3批样品的碳酸钠含量存在较大差异,且有关物质未见明显不同的结果,初步分析可能与硫酸头孢匹罗与碳酸钠混合工艺的工艺控制有关,造成批内差异较大。
3.1.2 溶液的澄清度与颜色
法定标准要求0.1g/mL的供试品水溶液应澄清无色;如显浑浊,与1号浊度标准液比较,均不得更浓;如显色,与黄色(Y)或黄绿色(YG)9号标准比色液比较,均不得更深(表2);经检验,结果均符合规定(表2)。检验过程中发现,企业B和C的样品颜色均约相当于黄色4号,虽然符合规定,但是颜色偏黄绿色。为保证标准的统一和严谨,结合各企业的检验结果,建议标准规定修订为“不得过黄色或黄绿色7号标准比色液”。

表2 溶液的澄清度与颜色标准规定与检验结果Tab.2 Standard and test results of clarity and color of solution
3.1.3 有关物质
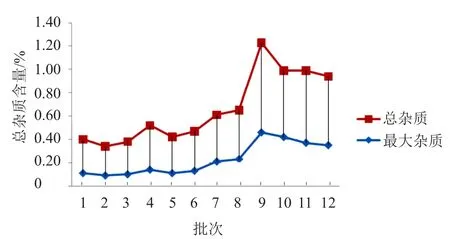
图1 最大杂质和总杂质相关性趋势图Fig.1 Trend diagram of correlation between the maximum impurity and total impurities
各企业均采用HPLC等度洗脱方式、自身对照法对单个杂质和总杂质量进行控制,企业A采用对照品外标法控制特定杂质2、3-环戊烯并吡啶的含量,经统计分析发现,企业A的总杂质含量相对其他3家企业较低。为了研究最大杂质与总杂质的相关性,对企业A的6批产品中的最大单个杂质使用自身对照法计算,通过对12批样品的最大杂质含量与总杂质含量进行相关性统计分析可知,最大杂质含量和总杂含质量呈显著正相关(图1)。由于企业A在质量标准中控制了2,3-环戊烯并吡啶的含量,其色谱图中的最大杂质就是2,3-环戊烯并吡啶,其最大杂质和总杂质的量都比其他3家生产企业低。通过了解硫酸头孢匹罗的合成工艺可知,两种合成路线中,2,3-环戊烯并吡啶都是必须要使用的原料之一。在探索性研究中还发现,样品在高温高湿的情况下极易分解释放出2,3-环戊烯并吡啶,提示在质量标准中控制其含量,是十分必要的。其他3家企业的法定标准采用不同的色谱系统分析有关物质,其最大杂质是否为2,3-环戊烯并吡啶,将在后续的探索性试验中进行重点研究。
看你的创作轨迹,万行长诗《鬣狗公主娜比》与50万字的长篇小说《德克萨斯》,两者几乎是并行交叉完成。你曾说,写历史长篇是一件非常痛苦的事情,但你很享受不断改变自己的过程,因为这除了考验人的意志力,更时刻检验作者对历史文化艺术的独特视角与卓越见解。一部作品的完成,就是一个全新的超越,会倍有成就感。
3.2 探索性研究结果与分析
针对国产注射用硫酸头孢匹罗的生产和质量现状,对有关物质Ⅰ、Ⅱ、制剂中的水分、引湿性对稳定性的影响、碳酸钠含量、晶形与粒度分布等进行研究,进一步评价各生产企业的产品质量。
3.2.1 有关物质Ⅰ分析
按照“2.2.1”项下建立的梯度洗脱方法能洗脱出强保留的杂质,与法定标准采用的等度洗脱方法比较,检出的杂质总量多,而且能同时控制特定杂质2,3-环戊烯并吡啶的含量(图2)。经检验,4个生产企业的12批样品的杂质个数和杂质总量均有明显增加。通过LC-MS对各企业产品的分析,发现最大杂质均为2,3-环戊烯并吡啶。进一步提示质量标准中控制2,3-环戊烯并吡啶的含量是非常必要的(表3和图3)。
3.2.2 有关物质Ⅱ分析
头孢匹罗为β-内酰胺类抗生素,速发型过敏反映在临床上最为常见,而高分子杂质是引起此类过敏反映的过敏原,控制此类高分子杂质的含量是提高β-内酰胺类抗生素药品质量的重要手段。目前现行质量标准大部分没有收载聚合物检测项,只有少数企业的质量标准中采用葡聚糖凝胶G10柱测定聚合物,但分析时间长,灵敏度低,且头孢匹罗对照品在流动相B中不缔合,一般采用与头孢匹罗分子量相近的头孢噻肟或头孢他啶作为替代,但是与头孢匹罗的响应值不一样,未考虑响应因子,从而影响结果的准确性。该研究采用球状蛋白色谱用亲水硅胶(TSK)系统测定的杂质,通过LC-MS分析,主峰前的色谱峰并不都是高分子杂质(聚合物),且每一个色谱峰也不是纯峰,而是多个化合物(杂质)的混合物。而在该系统中检出的杂质,在RP-HPLC系统中只能部分检出,RP-HPLC系统不能反映该品种的全部杂质。而TSK系统(图4)既能检查本品的高分子杂质,又可作为RP-HPLC检查有关物质的一个补充,可全面控制本品的杂质,提高本品的质量。

图2 有关物质色谱图Fig.2 Chromatograms of related substances

表3 两种方法测定有关物质的结果Tab.3 Results of the related substances by two methods

图3 两种方法测定有关物质总杂质的比较趋势图Fig.3 Trend diagram of total impurities in related substances by two methods
3.2.3 碳酸钠含量测定结果
根据各企业的制剂处方,注射用硫酸头孢匹罗中碳酸钠的理论含量为15.5%,而碳酸钠具有引湿性,可引起硫酸头孢匹罗降解,影响制剂的稳定性;另外碳酸钠的粒度较大,易造成与硫酸头孢匹罗混合不均匀,影响药品的均一性。因此碳酸钠的含量与本品的酸碱度、引湿性及稳定性有密切的关系,但现行标准中均未进行控制。按照“2.2.3”项建立的方法对各批次样品进行测定,4家企业碳酸钠含量的平均值分别为15.68%、15.17%、16.20%和15.53%,RSD分别为2.1%、2.2%、3.6%和2.6%。进一步证明各企业制剂中碳酸钠含量批内与批间差异较大,与硫酸头孢匹罗与碳酸钠混合工艺的工艺控制有关。通过对碳酸钠含量和pH值之间的关系进行分析(表4),可知碳酸钠的含量直接影响本品的pH值,二者存在正相关性。

图4 有关物质Ⅱ色谱图Fig.4 Chromatograms of related substances Ⅱ
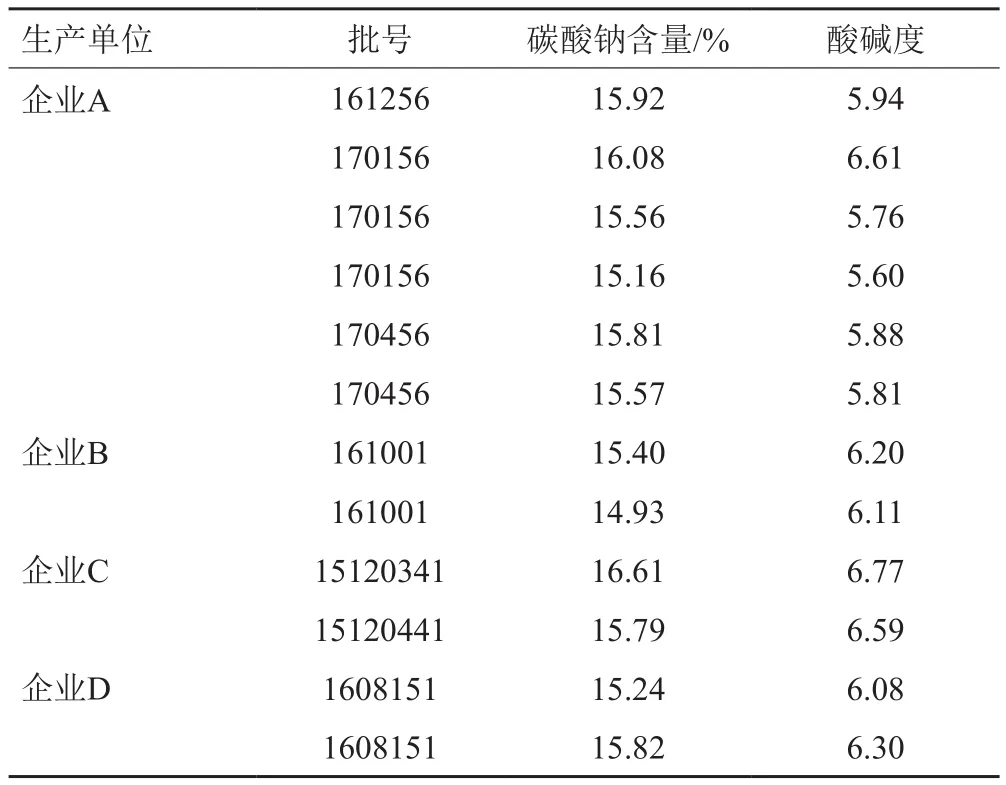
表4 碳酸钠含量与酸碱度的关系Tab.4 Relationship between content of sodium carbonate and pH value
3.2.4 制剂中水分的分析
结合热重分析法,对样品及其原料进行分析,从各企业的样品和原料的热重图谱中可见,没有明显的吸放热过程,说明硫酸头孢匹罗原料中没有结晶水存在。而从各企业制剂的热重图谱中可见,在30~120℃范围内样品中的水缓慢失去,60℃时失重比率分布范围为0.180%~0.493%,120℃时失重比率分布范围为2.050%~2.300%,也充分说明120℃时样品中所含的水分能充分挥发出来(图5)。结合水活度测定结果,各企业样品中游离水含量很少,说明各企业对水分控制效果比较理想,
分别对所有样品采用60℃减压3h和120℃干燥至恒重的方法测定其干燥失重值,120℃干燥至恒重所得干燥失重值略高于60℃减压3h所得干燥失重值,检验数据显示,120℃干燥方法能更充分地把样品中的水分挥发出来,最大限度的体现样品中含有水分的真实情况。
3.2.5 引湿性对样品稳定性影响的分析
原料药的引湿性低于制剂,从而使得原料的有关物质在引湿前后几乎没有明显增加。由于制剂中含有一定量的碳酸钠,导致制剂的引湿性明显高于原料,引湿后制剂中的特定杂质2,3-环戊烯并吡啶和总杂质都明显增加甚至超出限度(图6),说明注射用硫酸头孢匹罗在潮湿的环境下不稳定,易解离出2,3-环戊烯并吡啶和其他杂质。
3.2.6 晶型与粒度分布结果分析
X-射线粉末衍射结果显示,同一厂家不同批次的X-射线粉末衍射特征峰基本一致。企业A的特征峰与其他3家企业有明显区别(图7),说明注射用硫酸头孢匹罗存在不同的结晶状态,可能有亚晶型存在或者混晶型情况。结合法定检验结果,企业A制剂的2,3-环戊烯并吡啶、总杂质和聚合物含量明显低于其他3家企业,表明该厂家的晶型具有一定优势。
不同企业由于所用原料和生产工艺不同,造成产品粒度分布不一致。企业A的不同批次样品的粒度分布差别较大;来自不同抽样地点的批号为170156的3批样品粒度分布也不一致(图8),结合此3批样品的pH值和碳酸钠含量存在显著差异的情况,提示该企业制剂生产过程中应加强对原料和生产工艺的控制。
4 结论
通过对法定标准检验及探索性研究试验结果的比较分析,本品合格率为100%。基于现行标准均为局颁标准,项目设置较全面,基本可以实现对本品的质量控制。但存在质控项目缺失、方法设置不合理、限度不统一等问题,建议进一步完善质量标准,修订有关物质Ⅰ和有关物质Ⅱ检查项并增加碳酸钠检查项。

图5 热重分析图谱Fig.5 Pictures of thermogravimetric analysis

图6 引湿前后的有关物质色谱图Fig.6 Chromatograms of related substances before and after hygroscopy

图7 X-射线粉末衍射图谱Fig.7 Pictures of X-ray powder diffraction

图8 企业A制剂的粒度分布图Fig.8 Particle size distribution map of preparation from manufacturer A
由于碳酸钠的含量与本品的酸碱度、引湿性及稳定性有密切的关系,且碳酸钠和硫酸头孢匹罗粒径分布范围不同,容易混合不均匀,影响产品的质量。提示生产企业进一步改进生产工艺,以保证产品的稳定、安全和可靠。
