环磷酸腺苷信号通过促进线粒体融合防止足细胞凋亡
2019-03-29李肖瑛白寿军查芳芳朱迎春
李肖瑛 白寿军* 查芳芳 朱迎春
作者单位:201700 复旦大学附属中山医院青浦分院
完整的足细胞,包括足突和其间的裂隙膜,是维持蛋白质滤过屏障功能的重要结构基础[1]。足细胞数量减少,足突融合或裂隙膜蛋白表达减少都将导致大量蛋白尿[2-3]。足细胞数量减少也被认为是局灶节段肾小球硬化的最关键致病因素之一,而局灶节段肾小球硬化是各种肾小球疾病进展至肾小球硬化的共同途径[4]。因此,足细胞细胞生物学的改变和肾小球疾病的发生发展密切相关。作者前期工作发现激活环磷酸腺苷(cAMP)信号可以防止嘌呤霉素氨基核苷(PAN)诱导的线粒体膜电位下降[5],提示cAMP的保护作用可能与线粒体途径有关。线粒体生物学作用包括氧化磷酸化、生成动力学、分裂/融合动力学以及线粒体基因组转录等,这些作用和足细胞损伤的关系尚不完全清楚。因此本研究将探讨线粒体形态变化在cAMP防止足细胞凋亡中的作用。
1 材料与方法
1.1 细胞培养 条件永恒小鼠足细胞株由Peter Mundel教授赠送。足细胞培养简要描述如下:诱导分化培养液为含10% FBS RPMI1640培养液;条件培养液在上述培养液中再加入10IU/ml小鼠γ-IFN,促进足细胞增殖。本研究采用15-25代足细胞。生长于I型胶元被覆培养皿中的细胞使用条件培养液,培养于33℃含5% CO2的培养箱中(许可条件),隔天换液。诱导分化时,足细胞被转移至37℃含5% CO2的培养箱中使用分化培养液培养(非许可条件),隔天换液1次。细胞在非许可条件下生长6d后,大部分细胞呈分枝状,细胞体变大,细胞核变大颜色变浅,部分细胞出现双细胞核。待细胞分化后,使用各种试剂或药物刺激。
1.2 线粒体形态染色 细胞接种于12孔板,待分化以及药物刺激后,使用celllight mitchondria-GFP Bacman2.0试剂(美国,Life Technology公司)直接对细胞线粒体进行染色,简要步骤为:试剂以10μl/104细胞的量加入到12孔板的每个孔中,过夜后直接在共聚焦显微镜下观察。
1.3 透射电镜观察 每组标本收集≥107个细胞,浸泡在2.5%戊二醛中4℃固定过夜,再用1.0%锇酸作后固定,然后用LR白色树脂包埋(英国)。超薄切片(70nm)用乙酸双氧铀染色后在电镜75kV(飞利浦CM120;荷兰)电压下观察。
1.4 CCK-8检测 按照CCK-8检测说明书(上海碧云天)操作,叙述如下:细胞接种于96孔板,分化≥6d后使用各种药物刺激,在刺激后的96孔板中,每孔加10μl CCK-8检测试剂,37℃孵育1h后,于450nm波长读取吸光度,所得吸光度值即为足细胞相对含量。
1.5 Western blot分析 检测足细胞p-Drp1、Drp1、Fis1、OPA1、Mfn1、cleaved caspase3、caspase3蛋 白质表达的表达。提取细胞总蛋白,10%SDS-PAGE电泳后转至PVDF膜,封闭后分别用兔抗人p-Drp1一抗(美国Cell Signaling Technology公司,1∶1000),兔抗人Drp1一抗(美国Cell Signaling Technology公司,1∶1000),兔抗人Fis1一抗(美国,Alexis生物化学公司,1∶500),兔抗大鼠OPA1一抗(英国Abcam公司,1∶1000),兔抗人Mfn1一抗(英国Abcam公司,1∶1000),兔抗人cleaved caspase 3一抗(美国Cell Signaling Technology),1∶1000),兔抗人caspase 3一抗(美国Cell Signaling Technology),1∶ 1000)4℃孵育过夜,山羊抗兔荧光二抗(美国LI-COR,1∶5000)室温孵育1h,红外成像系统(美国LI-COR Odyssey)显影后用Image J软件分析结果。
1.6 统计学方法 采用SPSS13.0统计软件。计量资料以(s)表示,组间比较使用方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 cAMP信号防止PAN诱导的线粒体分裂 通过线粒体染色和透射电镜直接观察线粒体的形态变化,PAN 100μg/ml孵育足细胞72h,与对照组相比,线粒体较多的处于分裂状态,而使用cAMP激动剂pCPT-cAMP(pCPT)预孵育24h后,线粒体未分裂,更多的处于融合状态。提示cAMP信号可能通过调节足细胞内线粒体的分裂/融合防止足细胞凋亡。
2.2 PAN通过抑制足细胞线粒体外膜Mfn1蛋白表达,抑制线粒体融合 Mfn1是线粒体外膜蛋白,主要调节线粒体外膜融合。如图1所示,发现PAN时间依赖性抑制足细胞Mfn1的表达。Drp1、Fis1是调节线粒体分裂的蛋白,OPA1是线粒体内膜蛋白,主要调节线粒体内膜融合,如图2,发现PAN并不影响Drp1、Fis1、OPA1的表达,提示PAN可能通过抑制Mfn1的表达,从而抑制线粒体融合。
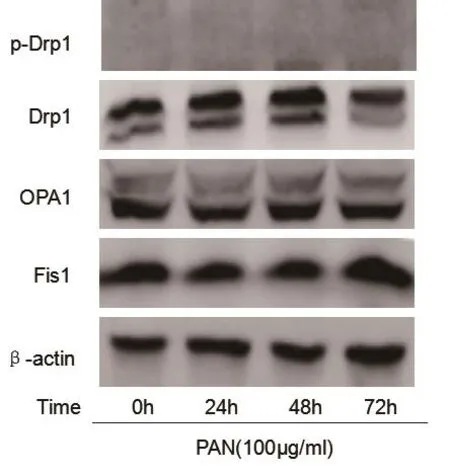
图2 PAN不影响足细胞中p-Drp1、OPA1、Fis1的表达
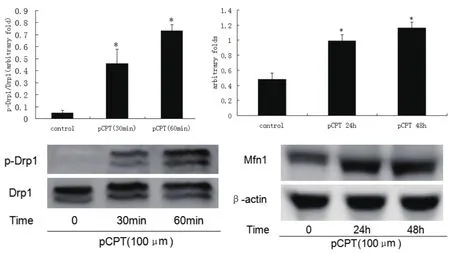
图3 PKA信号促进足细胞中p-Drp1和Mfn1表达增多
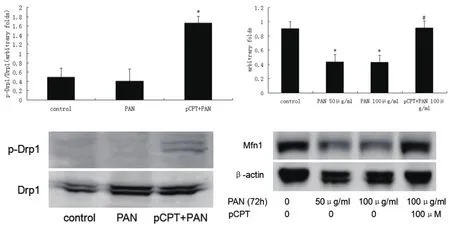
图4 PKA信号防止PAN诱导的Mfn1表达减少,并促进足细胞中p-Drp1表达
2.3 cAMP信号促进Drp1磷酸化和Mfn1蛋白表达,促进线粒体融合 pCPT 100μm刺激足细胞30min、60min可以直接促进足细胞生成p-Drp1,刺激24h、48h还可以直接诱导Mfn1表达上升,如图3。PAN和pCPT共同作用于足细胞依然可以诱导p-Drp1生成,pCPT 100μm预处理24h还可以防止PAN诱导的Mfn1表达下降,如图4。提示cAMP信号可能通过促进Drp1磷酸化和Mfn1蛋白表达增加,促进线粒体融合。
2.4 线粒体分裂/融合直接调节足细胞凋亡 为了证实足细胞凋亡和线粒体分裂/融合的关系,使用花生四烯酸(Ara)和Mdivi-1两个试剂,它们能分别诱导线粒体分裂和融合。Ara时间依赖性诱导足细胞数量下降和cleaved caspase3表达上升,而且可以完全阻断pCPT的保护作用。对照组、PAN组、Ara组、pCPT+PAN组、pCPT+PAN+Ara组 吸 光 度分 别 为(1.01±0.08)、(0.67±0.07)、(0.37±0.03)、(0.87±0.06)、(0.36±0.03),P<0.05。Mdivi-1 可 以部分缓解PAN诱导的足细胞数量下降,对照组、PAN组、Mdivi-1(10μM)+PAN 组、Mdivi-1(50μM)+PAN组吸光度分别为(0.76±0.02)、(0.48±0.01)、(0.51±0.01)、(0.51±0.01),P<0.05。Mdivi-1 也可以部分防止PAN诱导的cleaved caspase3表达上升。见图 5、6。
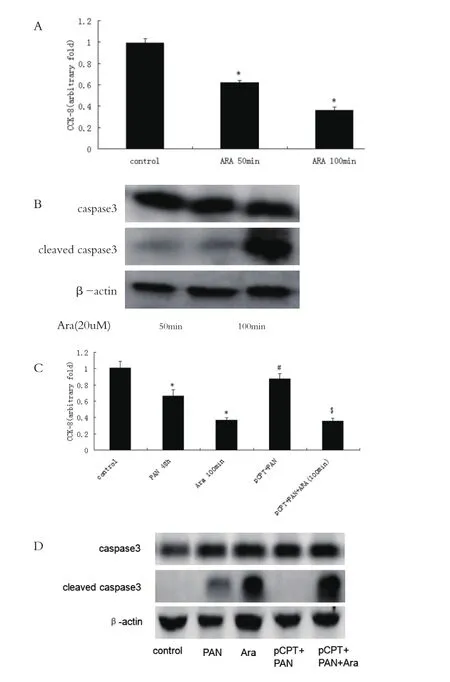
图5 Ara诱导足细胞凋亡(注:A、C:CCK-8检测足细胞数量;B、D:western blot检测足细胞cleaved caspase3表达变化。与对照组比较,⋆P<0.05;与PAN组比较,#P<0.05;与pCPT+PAN组比较,▲P<0.05)
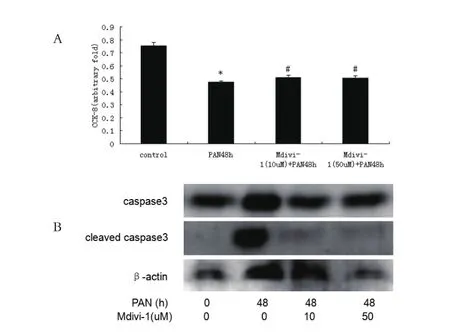
图6 Mdivi-1部分缓解PAN诱导的足细胞凋亡(注:A:CCK-8检测足细胞数量;B:western blot检测足细胞cleaved caspase3表达变化。与对照组比较,⋆P<0.05;与PAN组比较,#P<0.05)
3 讨论
线粒体是细胞有氧代谢的中心环节,是细胞内反应性氧簇的重要来源,也是调节细胞功能、分化、生存/凋亡的一个重要的细胞器[6-8]。线粒体损伤时,线粒体完整性被破坏可导致多种促凋亡因子包括细胞色素C的释放,最终引起细胞凋亡。细胞色素C从线粒体释放至胞浆是一个关键性步骤,细胞色素C与胞质中的细胞凋亡蛋白酶活化因子1结合,直接激活caspase 9,从而引发细胞凋亡[9]。
线粒体是高度动态的细胞器,并且处于分裂与融合的重复周期[10]。促进线粒体分裂和抑制线粒体融合可以导致细胞色素C释放,凋亡以及线粒体膜电位下降。线粒体分裂和融合平衡紊乱可以诱导心肌细胞凋亡,这也是心衰过程中心肌细胞丢失的重要机制[10]。
作者发现,PAN刺激的足细胞与正常对照组相比,其线粒体较多的处于分裂状态,而pCPT预处理的足细胞线粒体较多的处于融合状态。通常线粒体分裂意味着细胞需要更多的ATP或者是清除受损的线粒体。虽然线粒体分裂由Drp1启动,但是并未发现Drp1水平在PAN刺激的足细胞中有所上升。Mfn1是维持线粒体外膜融合的蛋白,PAN刺激后Mfn1表达下降,提示PAN通过抑制线粒体融合,从而促进了足细胞线粒体的分裂,那么足细胞内的线粒体在PAN作用下增加分裂可能是一个被动的过程。线粒体融合过程可以促进正常线粒体将完整的组成成分提供给受损线粒体,包括DNA和蛋白质,从而维持正常的线粒体功能,防止线粒体外膜破损以及凋亡因子释放。过多的分裂的线粒体将削弱细胞对于损伤因子的防护和修复能力,因此增加了细胞的凋亡或死亡。
PKA可以磷酸化Drp1蛋白的丝氨酸637位点,磷酸化的Drp1从线粒体释放入细胞质,导致线粒体融合,同时抑制细胞凋亡。本研究中,pCPT诱导足细胞Drp1丝氨酸637位点磷酸化作用未受到PAN的影响。同时,pCPT还诱导了Mfn1表达上升。提示cAMP信号不仅可以通过增加Drp1磷酸化促进线粒体融合,而且可以通过恢复Mfn1的表达防止PAN诱导的线粒体分裂。因此,cAMP可能从主动和被动两种方式,促进了足细胞线粒体的融合,增加足细胞对于损伤的防护和修复。作者还使用了线粒体分裂诱导剂Ara成功诱导了足细胞数量减少以及cleaved caspase3表达上升,使用Mdivi-1部分抑制了PAN诱导的足细胞损伤,也提示了线粒体分裂可能与足细胞凋亡有关。
本研究主要观察线粒体分裂/融合与足细胞凋亡之间的关系。线粒体的其他功能变化也和足细胞损伤有关。例如,有研究发现激活促进线粒体生成的雌激素相关受体α可以防止PAN诱导的足细胞损伤[11]。Zhu等[12]发现线粒体功能障碍介导了盐皮质激素对足细胞的损伤。线粒体途径产生的反应性氧簇是葡萄糖诱导足细胞损伤的最重要途径之一。说明线粒体功能异常在足细胞损伤中具有重要作用。应进一步检测PKA信号是否对于足细胞中线粒体的生成、线粒体DNA损害以及线粒体ROS产生存在有益的作用。
综上所述,PAN通过诱导线粒体分裂导致足细胞凋亡,pCPT通过激活cAMP信号通路防止线粒体分裂,从而起到足细胞保护作用。
