基于UPLC-Q-TOF/MS平台的结晶肾损伤小鼠的尿液代谢组学研究
2019-03-29王学雷晁玉凡高松燕温晓飞
王学雷,晁玉凡,高松燕,董 昕,温晓飞
(1.上海东方医院泌尿外科,上海 200120;2.海军军医大学药学院测试中心,上海 200433)
进入21世纪以来,泌尿系结石的患病率在全球范围内呈现高发态势,并且伴随全球气候变暖、人们生活习惯和饮食的变化等,发病率在继续上升[1-2]。最新研究显示,中国的男性肾结石患病率为6.5%,女性为5.1%[3]。肾结石病程较长且病程反复,在首次发病后,有50% 的患者可能会在7年内再次发病[4]。并且肾结石可增加发生慢性肾病以及终末期肾病的概率[5-6]。
草酸钙结石约占肾结石的80%[7],目前对草酸钙结石的研究认为肾小管上皮细胞的损伤对草酸钙结石的形成至关重要[8],而细胞内的活性氧簇(reactive oxygen species,ROS)直接参与损伤的过程[9-10]。由于缺乏对疾病整体动态的认识,草酸钙结晶导致肾损伤的机制仍未明确。流行病学研究表明,代谢综合征患者有较高的结石患病率[11],且机体代谢紊乱在结石的形成过程中发挥重要作用[12],因此对草酸钙结石进行系统性的代谢评价有利于疾病的发病机制研究以及早期诊断和个性化防治[1]。代谢组学是继基因组学、蛋白组学之后系统生物学的重要分支,旨在对反映生物体状态变化的内源性代谢物群体进行全面的监测和研究[13-14],可以为草酸钙结石引起的肾损伤的系统性代谢变化研究提供一个有力工具。
尿液中草酸盐含量的升高是草酸钙结石形成的重要因素。目前,乙醛酸盐作为草酸盐的前体被用于诱导草酸钙结石模型[15]。本研究以UPLC-Q-TOF/MS的代谢组学方法为主要研究手段,以常规组织生化分析为辅助,使用乙醛酸盐诱导的小鼠草酸钙结晶模型对草酸钙结晶造成的肾损伤过程中尿液内源性代谢物的变化情况进行系统研究,为疾病的形成机制研究以及早期生物标志物的筛选提供方向。
1 材料和方法
1.1 材料与试剂
色谱级甲醇、乙腈(Merck,Germany)。HPLC级甲酸(Fluka,Switzerland)。乙醛酸(TCI,Japan),加入NaOH调至pH7.4配成乙醛酸盐。超纯水由Milli-Q水净化系统 (Millipore Corp.,USA)制备得到。色氨酸、苯丙氨酸、赖氨酸、牛磺酸、尿酸标准品(Sigma-Aldrich,USA)。
1.2 乙醛酸盐诱导的小鼠结晶肾损伤模型的建立[16]
18只7~8周龄C57B/L6雄性小鼠购自上海斯莱克斯实验动物有限公司。经过1周的适应性饲养,将小鼠随机分为3组,对照组(U0)、模型1 d组(U1)和模型5 d组(U5),每组6只。模型组每天腹腔注射100 mg/kg的乙醛酸盐造模,对照组每天腹腔注射等量生理盐水。
1.3 生物样本的采集[16]
对照组和模型组在最后一次注射后,置于代谢笼中收集24 h尿液(正常饮水,禁食),4 000 r/min离心5 min后,取上清液。眼眶取血,室温静置1 h后,3 500 r/min,4℃离心15 min,取血清。所有离心后尿样和血清于-80 ℃冻存。行心脏灌流后,采集肾脏,置于4%多聚甲醛中固定。
1.4 动物模型评价
测定各组血清中肌酐和尿素氮含量。将固定后的肾组织用石蜡包埋,切成3~4 μm的薄片,采用冯库萨试剂盒(杰美基因,上海)进行染色。在400倍放大倍数下,观察肾组织钙沉积情况。
1.5 样品的制备
将尿液在4 ℃解冻后,取100 μl尿样,加入300 μl甲醇进行蛋白沉淀和代谢物提取。涡旋5 min,将样品置于4 ℃静置10 min,于13 000 r/min、4 ℃离心10 min。取150 μl上清液于进样小瓶中待分析。此外,每个样本各取50 μl上清液混合成质控样本(quality control,QC),用于考察系统的稳定性。
1.6 尿样的UPLC-Q-TOF /MS分析
UPLC-Q-TOF/MS分析使用安捷伦1290 Infinity 液相系统和安捷伦6538 高分辨单四级杆-飞行时间串联质谱联用仪 (Agilent,USA) 。色谱柱为ACQUITY UPLC HSS T3柱(2.1 mm×100 mm,1.8 μm,Waters),柱温40 ℃。流动相为0.1%甲酸(A)-含0.1%甲酸的乙腈(B)。优化后的梯度条件:0~2 min,5% B; 2~10 min,5%~15% B; 10~14 min,15%~30% B; 14~17 min,30%~95% B; 17~19 min,95% B。流速:0.4 ml/min,进样量:3 μl,自动进样器温度:4 ℃。
质谱使用电喷雾离子源(ESI)采集正、负离子数据。为了监测及考察系统的稳定性,在尿液的正、负离子模式下分别随机插入6针QC。通过无监督的主成分分析(PCA)中QC的聚集程度考察系统的稳定性。同时,计算每个离子在QC样品中的相对标准偏差(RSD,%),如RSD大于20%认为变异较大,其显著性的差异可能是由于偶然相关造成的[17]。
1.7 数据处理及统计学分析
使用R软件平台,调用XCMS程序包,进行峰的识别、校正和积分。将变量根据80%原则筛选去除噪音信号[18]和面积归一化后,导入到SIMCA-P 11.0 (Umetrics,Sweden)进行多元统计分析。采用无监督的PCA分析表征样本组间的分离趋势以及观测离群值[19],用得分图表征结果。采用有监督的偏最小二乘法判别分析(PLS-DA)进行差异物质的筛选,用得分图和S-Plot图表征结果。S-Plot图中每个点代表一个变量,离原点越远的变量,其可能对组间差异的贡献率越大,则VIP(variance importance)值就越大[20]。并根据R2、Q2值以及排列测试的结果对模型进行验证[21],R2表示数据模型在某方向上可以解释的变量与总变量的比值,Q2表示模型的预测能力[22]。将VIP值大于1的变量作为显著差异物质的候选变量。

1.8 差异代谢物的鉴别[23]
首先,利用在线网络数据库如Metlin(http://metlin.scripps.edu/),Human Metabolome Database (http://www.hmdb.ca/)进行匹配,以及利用MassHunter定性软件对精确m/z值进行分子式匹配,对离子进行推断性鉴别;然后,进行MS/MS分析,对采集的MS/MS碎片与Metlin数据库中的碎片信息进行比对以确定代谢物;对于易得到标准品的代谢物,将其保留时间以及MS/MS碎片信息与标准品进行比对,最终确证代谢物。
2 结果与讨论
2.1 肾钙含量测定
冯库萨染色(图1)显示,对照组的肾脏中未出现钙沉积,模型组的肾小管腔及间质中均可见大量的黑色钙盐沉积,肾小管腔明显扩大。且U5组的钙盐沉积情况比U1组更明显。
2.2 血清生化指标分析
如图2所示,与U0组相比,U5组中血肌酐(P<0.05)、尿素氮(P<0.001)的含量均显著升高,且U5组尿素氮的含量比U1组明显上升(P<0.05),表明模型组出现了一定的肾损伤。

图1肾脏组织的冯库萨染色图(×400) A.U0组;B.U1组;C.U5组
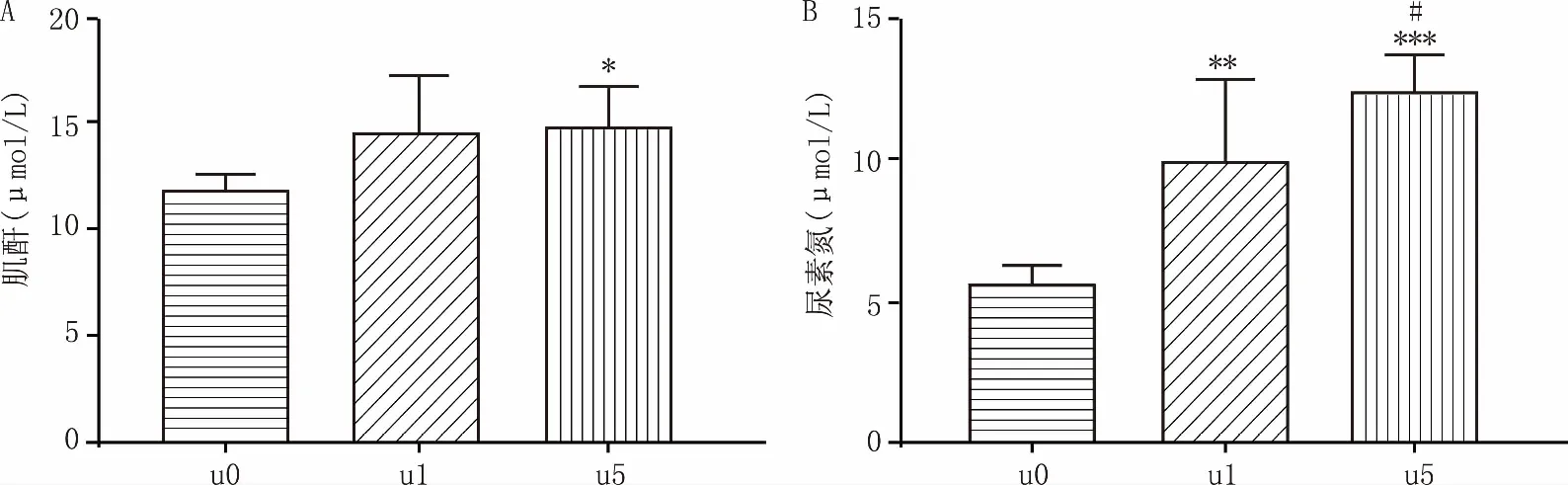
图2 血清中的肌酐和尿素氮含量 A.肌酐含量;B.尿素氮含量*P<0.05,**P<0.01,***P<0.001,与U0组比较;#P<0.05,与 U1组比较
2.3 尿液代谢组学轮廓分析与差异代谢物的筛选
UPLC-Q-TOF/MS采用正、负两种模式对尿液进行数据采集,两种模式下典型的总离子流图(TIC)见图3,色谱峰分布均匀。如图4所示,正、负离子模式下,QC的聚集状况均良好,表明系统的稳定性良好。U0组、U1组和U5组的PCA得分如图5 A、5B所示,U5与U0组分离趋势显著,U1与U0组分离趋势不明显。同时,笔者使用Metaboanalyst软件将3组数据进行聚类分析,从图 5 C、5D可以看出,U1组的个体差异较大,不能与U0很好的区分。因此,对U5与U0组尿液进行有监督的PLS-DA分析,筛选乙醛酸盐诱导的结晶肾损伤的差异代谢物。根据R2、Q2值以及排列测试对PLS-DA模型进行验证。PLS-DA得分和S-Plot见图6 A-D所示,正、负离子模式下U0和U5组明显分离。正模式下,R2Y=0.98,Q2=0.708;负模式下,R2Y=0.992,Q2=0.786;排列测试图如图6 E、6F所示,模型均良好,未出现拟合现象。笔者结合VIP值和离子在组间的变化倍数(fold change,FC)筛选差异物质。VIP >1且|FC|>1.5的离子认为是U0和U5组的显著差异离子,同时剔除在QC样本中RSD (%) 值大于20的离子。经独立样本t检验,认为P<0.05的变量是乙醛酸盐诱导的结晶肾损伤尿液中潜在的生物标志物。
图3 尿液正、负离子模式下典型的总离子流图 A.正离子模式下;B.负离子模式下

图4 3组尿样及QC样品正、负离子模式下的主成分分析得分图 1.正离子模式下;B.负离子模式下
对差异代谢物进行鉴别,最终从尿液中鉴别出21个差异代谢物,见表1。

表1 乙醛酸盐诱导的结晶肾损伤小鼠尿液差异代谢物列表
注:“—”表示缺失碎片离子
如表1所示,与对照组(U0)相比,模型组(U1、U5)尿液中代谢物有11种显著下调,10种显著上调。其中,三甲基赖氨酸、尿酸、苏氨酸、苯乳酸、牛磺酸、4-吡哆酸显著下调;琥珀酸、赖氨酸、苯丙氨酸、色氨酸、氧代壬酸和脂肪酰基甘氨酸显著上调。为了直观地展现差异物质在3组中的变化趋势,笔者使用Metaboanalyst软件(http://www.metaboanalyst.ca)绘制热图(图7)。
3 讨论
对筛选出的21种差异代谢物建立代谢相关网络 (图8),涉及的通路有氨基酸代谢、能量代谢、牛磺酸代谢、次牛磺酸代谢、 VB代谢和嘌呤代谢等。
模型组尿液中芳香族氨基酸(AAA)苯丙氨酸和色氨酸明显升高,表明在结晶肾损伤过程中AAA代谢受到干扰,这与肾脏疾病跟AAA降解、合成或排泄密切相关[24-25]。牛磺酸是哺乳动物细胞中一种重要的含硫β-氨基酸[26],被认为是一种内源性抗氧化剂和膜稳定剂。许多研究已经证明牛磺酸对多种类型肾损伤的保护作用,包括缺血/再灌注损伤、高血糖、氧化应激和外源性物质造成的损伤[27]。而模型组中牛磺酸显著下降,表明牛磺酸和次牛磺酸代谢在结晶损伤过程中受到干扰。
脂肪酰甘氨酸作为脂肪酸的代谢产物,由乙酰辅酶A(acyl-CoA)与甘氨酸在线粒体酶甘氨酸N-酰基转移酶(glycine N-acyltransferase)的催化作用下产生[28]。而在一些有机酸血症中,由于甘氨酸N-酰基转移酶的高亲和力,一些acyl-CoA与甘氨酸的结合优于与卡尼汀的结合[29],从而影响线粒体内脂肪酸的β氧化[30-32]。本研究中,模型组尿液中的乙烯乙酰甘氨酸显著上升,表明乙醛酸盐诱导的结晶肾损伤过程中脂肪酸β氧化可能出现障碍,而脂肪酸β氧化异常会导致脂质过氧化和氧自由基的产生,这也与ROS的累积与肾小管细胞的损伤以及钙盐的附着有重要关系结论[33-35]相一致。

图7 尿液中21种差异物质聚类分析热图 注:红色越深代表量越高,绿色越深代表量越低
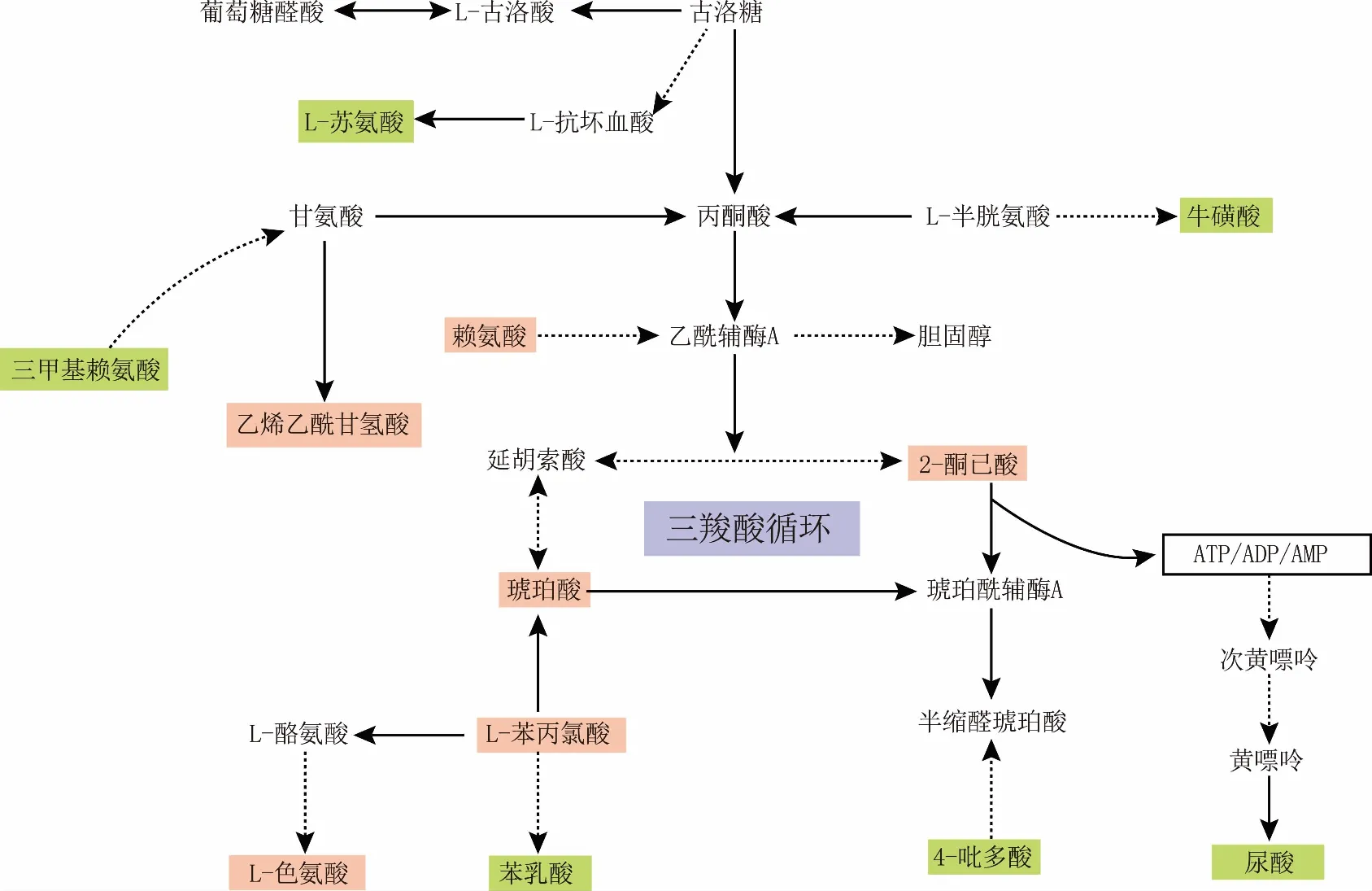
图8 乙醛酸盐诱导的小鼠结晶肾损伤尿液显著差异代谢物代谢网络图 注:红色表示上调,绿色表示下调
4-吡哆酸是VB6的重要代谢产物,VB6转化成4-吡哆酸后排出体外。VB6可以通过减少草酸的内源性合成抑制草酸钙结晶的形成,多项研究表明补充VB6可以减少尿液中草酸的排泄[36-39]。内源性草酸可以经甘氨酸-乙醛酸-草酸[40]途径合成。VB6是氨基酸代谢中转氨酶的辅酶[38],大量VB6存在时,乙醛酸可以在丙氨酸乙醛酸氨基转移酶(alanine glyoxylate aminotransferase,AGT)催化下氨基化,转化成甘氨酸,减少草酸的生成,而乙醛酸的上游代谢物乙醇酸也会转化为VB6。本研究中,小鼠给予乙醛酸后,4-吡哆酸的含量在尿液中显著下降,表明存在大量乙醛酸时干扰VB6的代谢。
尿酸是嘌呤代谢中的重要物质,在机体内,次黄嘌呤可以被代谢为黄嘌呤,而黄嘌呤可以被继续代谢为尿酸。本研究中,模型组尿样中尿酸的含量下降表示尿酸经肾脏的排泄发生障碍。作为嘌呤代谢的重要下游产物,尿酸对肾脏疾病的影响存在很大争议。有报道称尿酸对慢性肾脏病(CDK)的进展是一个潜在的重要风险因素,也有一些研究表明,可溶性尿酸作为一种强大的抗氧化剂,可以发挥其保护作用[41-43]。虽然尿酸的作用在本文中无法很好的阐述,但可以说明在此模型结晶形成过程中嘌呤代谢受到了强烈干扰,给继续研究其机制以及标志物的筛选提供了重要参考。
本研究中,课题组利用乙醛酸盐诱导的小鼠结晶肾损伤模型,采用基于UPLC-Q-TOF/MS的代谢组学方法从尿液中筛选出21个差异代谢物,主要涉及氨基酸代谢、能量代谢、牛磺酸和次牛磺酸代谢、嘌呤代谢和VB6代谢,为疾病机制研究以及早期标志物的筛选提供了重要参考,但要阐明疾病的具体机制可能还需要结合蛋白质组学数据。
