桂七青芒果皮多糖提取工艺的响应面优化 及其体外抗氧化活性
2019-03-28,,,
, , ,
(百色学院化学与环境工程学院,桂西区域生态环境分析和污染控制重点试验室,广西百色 533000)
芒果是我国著名的土特产之一,因具有较高的营养价值、鲜美丰腴的口味而广为消费大众熟悉并喜爱。广西百色市右江河谷芒果产量及质量均位居国内前列,被誉为“中国芒果之乡”。百色芒果种类繁多,其中的桂七青芒是百色地区特有的芒果名品,以其香气浓郁、纤维含量低、果肉香甜不腻受到广大消费者的喜爱。目前,桂七青芒的主要消费方式仍然以鲜食为主,果皮即以垃圾的形式舍弃。桂七青芒果皮较厚,纤维含量较大,自然降解慢。果皮作为芒果果实的一部分同样含有大量多糖[1-4],大量的果皮被遗弃,不仅是资源的一种浪费,同时亦会对环境造成较大的污染。因此,芒果果皮亟待再利用。
热水浸提法是一种应用极为普遍的植物多糖的提取方法,优势在于能够较好的保证多糖结构的完整性,但也具有时间长、效率低的缺陷。为了调高提取效率,科研工作者经常采取一些措施,超声波辅助是其中之一[5-6]。超声波主要通过机械作用破坏细胞组织,对多糖的结构及抗氧化活性几乎没有影响[7]。目前尚未关于桂七青芒果皮中多糖的提取及其抗氧化活性测试的报道,因此,本课题研究采用超声波辅助热水浸提法提取桂七青芒果皮中的多糖,优化工艺条件,并开展多糖生物活性的体外测试,为促进芒果果皮的开发利用提供数据参考。
1 材料与方法
1.1 材料与设备
桂七青芒果皮青绿无黑点 百色市右江区城西大型农产品批发市场;三氯乙酸、邻苯三酚、2,2′-联氮基双(2-乙基苯并二氢噻唑啉-6-磺酸)二铵盐(ABTS)、铁氰化钾[K3Fe(CN)6]、抗坏血酸(VC)均为分析纯 上海麦克林生化科技有限公司;乙醇、浓硫酸、苯酚等其他常用化学试剂及药品 均为分析纯,国药集团化学试剂有限公司。
KQ-202KDB型高功率数控超声波清洗器 超声波仪器有限公司;UV-2800型紫外可见分光光度仪 上海美普达仪器有限公司;SHA-B型恒温水浴振荡器 常州国华电器有限公司;DHG-1型电热鼓风干燥箱 上海一恒科学仪器有限公司;SHA-B型恒温水浴振荡器 常州国华电器有限公司。
1.2 实验方法
1.2.1 桂七青芒果皮粉末样品的制备 剥取桂七青芒的果皮,去除残余果肉后洗净并切成2 cm×4 cm×0.3 cm的条状碎块,置于电热鼓风干燥箱中60 ℃烘干至前后两次质量之差不超过0.01 g。粉碎,过60目筛制得果皮粉末样品。果皮粉末密封在自封袋中,避光冷藏(4 ℃)保存,以备使用[8]。
1.2.2 多糖的提取 在圆底烧瓶中按一定比例加入桂七青芒果皮粉末及蒸馏水,在一定的超声功率和温度下,超声提取一定时间。相同条件下反复提取三次,合并提取液,Sevag法去蛋白,过滤,得多糖提取液[9]。
1.2.3 单因素实验 准确称取桂七青芒果皮粉末1.000 g,固定其它因素及水平[10-11]:液料比60∶1 mL/g,超声时间20 min,超声功率700 W,考察不同温度:45、55、65、75、85、100 ℃对多糖提取效果的影响情况;
固定其它因素及水平:提取温度65 ℃、超声时间20 min,超声功率700 W,考察不同液料比:25∶1、40∶1、60∶1、80∶1、100∶1 mL/g对多糖提取效果的影响情况;
固定其它因素及水平:提取温度65 ℃、液料比60∶1 mL/g、超声功率700 W,考察不同超声时间:10、15、20、25、30 min对多糖提取效果的影响情况;
固定其它因素及水平:提取温度65 ℃、液料比60∶1 mL/g、超声时间20 min,考察不同超声功率:200、400、600、700、800 W对多糖提取效果的影响情况。
1.2.4 多糖提取工艺的响应面优化 以单因素实验结果为参考,以多糖得率为响应值(Y),提取温度(A)、液料比(B)及超声功率(C)为自变量,截取任意一因素内显著影响多糖提取效果的三个水平,利用Design-Expert 8.0.6软件中的Box-Behnken法设计并安排提取多糖的优化试验以获取最佳工艺参数[12]。
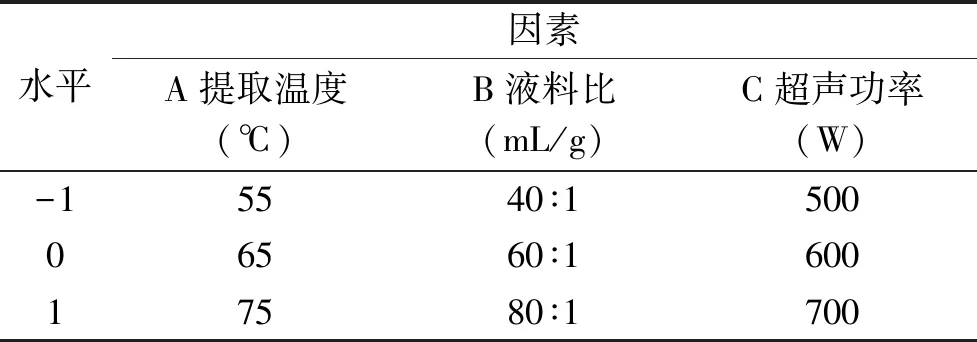
表1 响应面优化试验设计因素水平表Table 1 Variables and levels in the response surface experiment design
1.2.5 多糖得率的测定
1.2.5.1 葡萄糖标准曲线的绘制 精确配制并移取0.1000 mg/mL葡萄糖标准溶液 0.00、10.00、20.00、40.00、60.00、70.00 mL至100 mL容量瓶中,蒸馏水稀释,定容,配制浓度分别为0.00、10.00、20.00、40.00、60.00、70.00 μg/mL葡萄糖待测液。
准确移取上述6种不同浓度的葡萄糖待测液各2.00 mL至干燥的试管中,分别依次加入5%苯酚溶液3.00 mL及浓硫酸15.00 mL,混合均匀,置于40 ℃恒温水浴锅中反应30 min后取出,冷却至室温,于490 nm处测定体系吸光度[13]。以吸光度A对葡萄糖浓度c(μg/mL)进行线性回归,得回归方程为:A=0.126c-2.076×10-3,R2=0.9995。
1.2.5.2 提取液中多糖含量的测定 将多糖提取液置于旋转蒸发仪上浓缩至30 mL后转移至100 mL容量瓶中,定容,测定体系吸光度,代入葡萄糖标准曲线回归方程计算多糖含量。
1.2.5.3 多糖得率的计算 按照式(1)计算多糖得率(%)。
多糖得率(%)=多糖含量×100/桂七青芒果皮粉末样品质量
式(1)
1.2.6 多糖抗氧化活性的体外测试
1.2.6.1 多糖溶液的配制 多糖提取液浓缩至100 mL,并转移至1.0 L的锥形瓶中,加入四倍量无水乙醇,混合均匀并将锥形瓶置于冰箱中冷藏(4 ℃)、醇沉。72 h后,浓缩除去大部分溶剂。浓缩液3000 r/min离心10 min,弃去上清液,收集底部沉淀。沉淀经丙酮洗涤至丙酮洗液无色后,再用少量蒸馏水溶解,冷冻干燥,得固体多糖。称取一定质量的固体多糖,少量蒸馏水溶解,定容至50 mL,配制不同浓度的多糖溶液(1.6、2.2、2.9、3.6、4.3 mg/mL)。
1.2.6.2 对羟基自由基(·OH)清除效果的测定 分别向5支干燥试管中依次加入0.1500 mmol/L硫酸亚铁溶液1.00 mL,2.000 mmol/L水杨酸-乙醇溶液0.40 mL、蒸馏水0.40 mL、6.000 mmol/L过氧化氢溶液1.00 mL、不同浓度多糖溶液0.20 mL,混合均匀,置于37 ℃恒温水浴锅中反应1 h,510 nm处测定体系吸光度Ax(x=1~5)。固定其它条件及试验流程,以蒸馏水代替过氧化氢溶液,测定对照吸光度Ax0;以蒸馏水代替多糖溶液,测定空白吸光度A0,按式(2)计算多糖对·OH的清除率[14]:
·OH清除率 η(%)=[A0-(Ax-Ax0)]×100/A0
式(2)

式(3)
1.2.6.4 对ABTS自由基清除效果的测定 分别向5支干燥试管中依次加入不同浓度多糖溶液0.20 mL、6.999 mmol/L ABTS溶液3.00 mL。混合均匀后,将五支试管置于黑暗环境中室温反应1 h,734 nm处测定体系吸光度Ax(x=1~5)。固定其它条件及试验流程,以pH=7.4磷酸缓冲生理盐水代替ABTS溶液,测定对照吸光度A0,按式(4)计算多糖对ABTS自由基的清除率[16]:
ABTS自由基清除率η(%)=(A0-Ax)×100/A0
式(4)
1.2.6.5 总还原力的测定 分别向5支干燥试管中依次加入不同浓度多糖溶液1.00 mL、pH=6.6磷酸缓冲溶液2.50 mL、1%铁氰化钾溶液2.50 mL,混合均匀,置于50 ℃恒温水浴锅中反应25 min。取出,冷却至室温,继续加入10%三氯乙酸溶液2.50 mL,3000 r/min恒速离心10 min。取上清液2.50 mL,依次加入蒸馏水2.50 mL、1%三氯化铁溶液1.00 mL,混合均匀,室温反应10 min,700 nm处测定体系吸光度Ax(x=1~5)。固定其它条件及试验流程,以蒸馏水代替铁氰化钾溶液,测定对照吸光度Ax0;以蒸馏水代替多糖溶液,测定空白吸光度A0,按式(5)计算多糖的总还原力(总还原力吸光度成正比)[17]:
总还原力η=Ax-Ax0-A0
式(5)
1.3 数据处理
使用Origin 9.0进行整理和绘图;同时利用Design-Expert 8.0.6软件中的Box-Behnken法进行回归模型方程的建立及方差分析,获取响应值最大时各因素的最佳组合。
2 结果与分析
2.1 单因素实验
2.1.1 提取温度对多糖得率的影响 由图1可以看出,多糖的得率随温度增高而提升,提取温度设定在65 ℃时,得率达到最大值13.83%。温度继续升高,多糖得率迅速下降。当体系温度较低时,多糖分子的运动能力随温度的升高而增大,易从样品中溶出并扩散到溶剂中,多糖得率上升。但有机分子对温度变化较为敏感,多糖分子在较高温度时易失去生物活性以沉淀形式析出导致多糖得率下降。因此,提取温度设定为65 ℃较为合适。
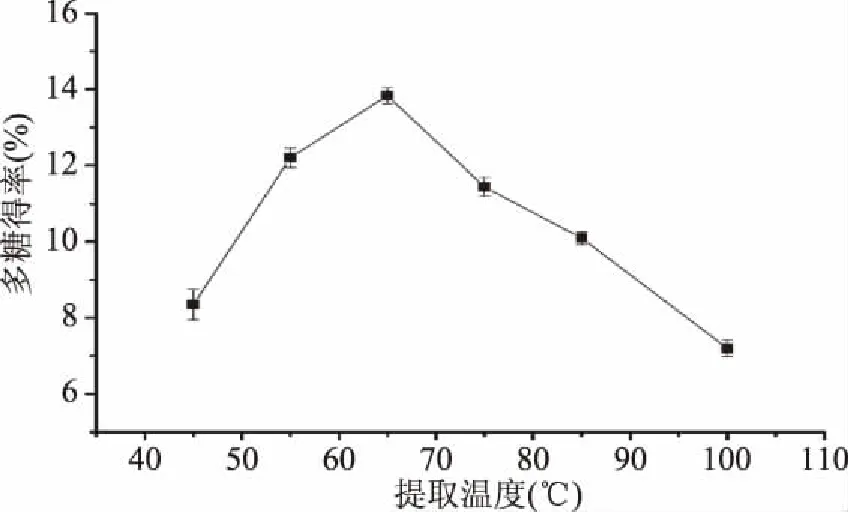
图1 提取温度对多糖得率的影响Fig.1 Effect of temperature on polysaccharides yield
2.1.2 液料比对多糖得率的影响 由图2可以看出,当液料比<60∶1 mL/g时,多糖得率升高且增速明显;当液料比为60∶1 mL/g时,多糖得率达到最大值13.83%,液料比继续增加,多糖得率开始缓慢下降。多糖总量一定,适当增加溶剂用量,增大的扩散压促使更多的多糖分子向溶剂中扩散,多糖得率随之上升。过度增大液料比使得溶剂用量增速快于多糖得率增速,造成溶剂浪费,同时亦会导致样品其它杂质成分溶出。杂质成分的增多可能会抑制多糖的溶出,得率缓慢下降。综合提取效率及后续浓缩工作,本着节约的原则,液料比设定为60∶1 mL/g较为合适。
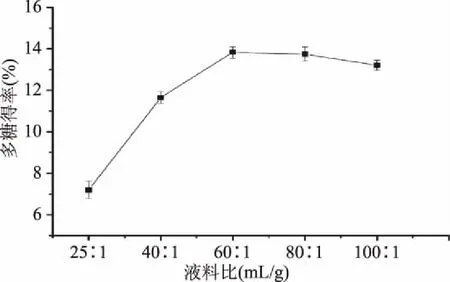
图2 液料比对多糖得率的影响Fig.2 Effect of liquid-material ratio on polysaccharides yield
2.1.3 超声时间对多糖得率的影响 由图3可知,多糖得率在一定时间内随时间延长而增加,超声时间为20 min时多糖得率达到最大值13.69%,继续延长超声时间,多糖得率下降。超声波的主要作用在于破碎样品细胞的细胞壁,延长超声时间,细胞壁破碎充分,有利于多糖分子从样品细胞中溶出并向外扩散,多糖得率上升。超声时间过长,体系空化作用加剧,伴随空化过程产生的局部高温会使多糖分子分解甚至失活,多糖得率下降。因此,超声时间设定为20 min较为合适。

图3 超声时间对多糖得率的影响Fig.3 Effect of ultrasonic time on polysaccharides yield
2.1.4 超声功率对多糖得率的影响 由图4可以看出,多糖得率随超声功率增加而迅速升高,当超声功率为600 W时,多糖得率取得最大值14.01%。当超声功率高于700 W后,多糖得率随超声功率增加迅速下降。在一定的超声时间内,细胞壁的破碎效果随超声功率的增加而愈加充分,多糖分子被充分溶出,得率上升。超声功率过大导致体系局部过热,多糖分子受高温影响失去生物活性以沉淀形式析出导致多糖得率下降。因此,超声功率设定为600 W较为合适。

图4 超声功率对多糖得率的影响Fig.4 Effect of ultrasonic power on polysaccharides yield
2.2 提取工艺的响曲面优化结果
2.2.1 响应面优化试验设计与数据分析 通过对桂七青芒果皮多糖提取的单因素试验考察可知,多糖得率的波动幅度随超声时间延长较其他因素小,说明超声时间为四个考察因素中的次要因素。因此,设立多糖得率为响应值(Y),提取温度(A)、液料比(B)、超声功率(C)三因素为自变量,利用响应面法设计三因素三水平优化试验,安排并实施17个试验点,试验方案及结果如表2所示。

表2 响应面优化试验设计及结果Table 2 Experimental design and results for response surface analysis
2.2.2 回归方程的方差分析及显著性检验 利用Design-Expert 8.0.6软件程序对表3中展示的优化设计试验结果进行回归拟合分析,获得多糖得率(Y)对提取温度(A)、液料比(B)、超声功率(C)的三元二次回归方程:
Y=-65.55694+1.03220A+0.08345B+0.13581C+8.25000×10-4AB-4.67500×10-4AC+9.50000×10-5BC-5.95250×10-3A2-1.35687×10-3B2-9.05250×10-5C2


表3 回归模型的方差分析表Table 3 Variance analysis of regression model
通过模型的方差分析可知,提取温度A(p=0.0038)、液料比B(p<0.0001)、超声功率C(p=0.0062)三因素及其二次项对多糖得率的影响均达到极显著水平(p<0.01),主次顺序为:液料比>提取温度>超声功率。方差分析显示三因素之间存在交互作用,其中,交互作用AC(p=0.0013)对多糖得率的影响极显著,而交互作用AB(p=0.1130)、BC(p=0.0754)的影响不显著。
2.2.3 交互作用对多糖得率影响的响应面分析 依据回归方程的方差分析,利用Design-Expert 8.0.6软件绘制出三因素中任意两因素之间的交互作用响应面分析图。在响应面分析图中,响应曲面的陡峭程度越大,说明相应的交互作用对多糖得率的影响越显著。对比图5~图7可以发现,交互作用AC的响应曲面具有显著的陡坡,而交互作用AB、BC响应曲面坡度小而相对平滑,说明交互作用AC的影响极显著。等高线图中轴向等高线密度与交互作用影响强度成正比。比较图5~图7中等高线图,交互作用AC轴向等高线密度明显高于交互作用AB、BC,亦说明交互作用AC的影响极显著。响应面分析结果与方差分析中显著性的结果相一致。

图5 交互作用AB对多糖得率影响的响应面分析图Fig.5 Response surface ofinteractive AB effect on polysaccharides yield

图6 交互作用AC对多糖得率影响的响应面分析图Fig.6 Response surface ofinteractive AC effect on polysaccharides yield

图7 交互作用BC对多糖得率影响的响应面分析图Fig.7 Response surface of interactive BC effect on polysaccharides yield
2.2.4 提取工艺最佳参数的确定及实验验证 经过Design-Expert 8.0.6对响应面优化试验数据的回归分析,确定最佳提取工艺参数:提取温度67.66 ℃,液料比72.80∶1 mL/g,超声功率613.61 W,在此条件下多糖得率可达14.06%。便于实际试验操作,调整工艺参数为:提取温度68 ℃,液料比73∶1 mL/g,超声功率620 W,超声时间20 min。严格执行所得最佳工艺条件,平行实验5次,桂七青芒果皮多糖的实测平均得率为13.64%±0.12%,与模型预测值14.06%相对误差在3%以内,说明该工艺切实可行。
2.3 多糖的抗氧化活性体外测试
2.3.1 对·OH清除效果的测定 ·OH主要通过夺取饱和氢原子而影响机体健康,多糖分子中含有较多的活性氢原子可与之发生反应,从而消除·OH对机体健康的危害。由图8可以看出,桂七青芒果皮多糖具有一定的清除·OH的能力,且清除效果随着多糖浓度的增加而增强,当多糖浓度为4.3 mg/mL时对·OH的清除率达到52.41%,但明显弱于各阶段相同浓度VC的清除能力。

图8 桂七青芒果皮多糖对·OH的清除效果测定Fig.8 Scavenging effect of polysaccharides from guiqi-mango peel on ·OH

图9 桂七青芒果皮多糖对的清除效果Fig.9 Scavenging effect of polysaccharides from guiqi-mango peel on
2.3.3 对ABTS自由基清除效果的测定 ABTS自由基是一种氮自由基,该种自由基由于与相邻苯环发生p-π共轭而具有较高的稳定性。由图10可以看出,在多糖浓度较低时(<3.0 mg/mL)对ABTS自由基的清除能力随浓度增加增速明显,当多糖浓度>3.0 mg/mL时清除率增速趋缓,当多糖浓度为4.3 mg/mL时对ABTS自由基的清除率达到59.10%,但均弱于各阶段相同浓度VC对ABTS自由基的清除能力。

图10 桂七青芒果皮多糖对ABTS自由基的清除效果Fig.10 Effect of polysaccharides from guiqi-mango peel on ABTS radical
2.3.4 总还原力的测定 多糖分子中含有醛羰基,可还原氧化剂,因而具有较强的还原能力。由图11可以看出,多糖总还原力在低浓度阶段(<3.6 mg/mL)随浓度增加迅速提高;当多糖浓度>3.6 mg/mL时,总还原力继续增加但增速趋缓。当多糖浓度为4.3 mg/mL时,总还原力达到0.455。在所测定的浓度范围内,多糖的总还原力均明显低于相同浓度VC的总还原力。

图11 桂七青芒果皮多糖的总还原力Fig.11 Total reducing power of polysaccharides from guiqi-mango peel
3 结论
本课题采用超声波辅助热水浸提法提取桂七青芒果皮中的多糖,并通过响应面法对提取工艺进行优化,建立三元二次回归模型。在模型分析的基础上方便实际操作,确定多糖提取的最佳工艺参数:提取温度68 ℃,液料比为73∶1 mL/g,超声功率620 W,超声时间20 min,该条件下实测多糖得率为13.64%±0.12%,与模型预测值14.06%相差<3%,说明该工艺切实可行。多糖的抗氧化活性体外测试结果表明多糖具有较好的抗氧化活性,当多糖浓度为4.3 mg/mL时,对羟基自由基、超氧阴离子自由基、ABTS自由基的清除率分别达到52.41%、83.47%、59.10%,总还原力达到0.455,且其抗氧化能力与浓度成正向线性关系。本课题的研究结果为桂七青芒果皮中多糖的提取及百色芒果的综合开发利用提供了一定的数据支持。
