银屑病患者血浆中前蛋白转化酶枯草溶菌素9的表达及对外周血CD4+T细胞活化的影响
2019-03-28胡煜栾超练霓郝志敏孙玉洁王焱顾恒陈敏
胡煜 栾超 练霓 郝志敏 孙玉洁 王焱 顾恒 陈敏
中国医学科学院北京协和医学院皮肤病医院江苏省皮肤病与性病分子生物学重点实验室,南京210042
研究发现银屑病与许多系统性疾病密切相关,包括心血管疾病、肥胖、高脂血症、糖尿病和代谢综合征等[1-2]。前蛋白转化酶枯草溶菌素9(proprotein convertase subtilisin/kexin type 9,PCSK9)是一种由肝脏合成的蛋白酶,能够与肝脏低密度脂蛋白受体(LDLR)相结合,促进LDLR 降解,从而提高血浆低密度脂蛋白(LDL)浓度[3]。靶向抑制PCSK9 活性后能够降低血浆LDL 浓度[4-5]。而且,PCSK9 可能是动脉粥样硬化发病机制中的炎症因子,可通过沉默PCSK9降低apoE敲除小鼠动脉粥样硬化主动脉中肿瘤坏死因子α(TNF-α),Toll 样受体4(TLR-4)和核因子κB(NF-κB)的表达[6]。此外,PCSK9还能够通过诱导炎症因子TNF-α、白细胞介素1(IL-1)和IL-6 来驱动巨噬细胞的炎症反应[7]。为探究PCSK9在银屑病发病机制中的作用,本研究检测银屑病患者外周血中PCSK9 的表达以及PCSK9 对外周血CD4+T细胞分泌细胞因子的影响。
对象与方法
一、对象
2016年2月至2017年12月于中国医学科学院皮肤病医院门诊收集30例确诊的寻常性银屑病患者,其中男16 例,女14 例,年龄18 ~66(40.20±16.20)岁,病程1 个月至15(5.62 ± 4.42)年。所有患者均处于进展期,银屑病皮损面积和严重程度指数(PASI)2.1 ~28.8(12.35±6.25)。所有纳入患者近3个月内未系统使用糖皮质激素、维A酸制剂及免疫抑制剂等系统治疗,1个月内未使用外用药物或光疗,无高血压、糖尿病、高血脂、心血管疾病病史,无感染、肿瘤或其他严重系统疾病史,无自身免疫性疾病史,排除妊娠、哺乳期妇女。对照组30例为2016年2月至2017年12月于中国医学科学院皮肤病医院招募的健康志愿者,其中男15 例,女15例,年龄18 ~54(36.23±13.58)岁。患者组与对照组性别及年龄差异均无统计学意义(性别χ2=0.067,P=0.796,年龄t=-1.028,P=0.308)。本研究经过中国医学科学院皮肤病医院(研究所)医学伦理委员会批准,批件号为(2016)快审第(KY019)号,所有研究对象均签署知情同意书。
二、试剂
淋巴细胞分离液LymphoprepTM为挪威Axis-Shield 公司产品;Trizol 试剂为美国Invitrogen 公司产品;逆转录试剂盒HiScript Q RT SuperMix for qPCR、RT-PCR 试剂盒AceQ qPCR SYBR Green Master Mix(High ROX Premixed)均来自南京诺唯赞生物科技有限公司;PCSK9 Quantikine ELISA 试剂盒来自美国R&D Systems公司;BD IMagTMCD4+分离系统来自美国BD Biosciences 公司;人干扰素γ(IFN-γ)酶联免疫吸附试验(ELISA)试剂盒及人IL-17A ELISA 试剂盒来自美国RayBiotech 公司;重组PCSK9蛋白为美国BPS Biosciences公司产品。
三、方法
1.外周血单个核细胞(PBMC)分离和总RNA提取:取受试者静脉血10 ml,1 000 r/min(离心半径16 cm)离心10 min 分离血浆,用Ficoll 密度梯度离心法通过淋巴细胞分离液LymphoprepTM分离PBMC。Trizol 试剂提取PBMC 中总RNA,利用NanoDrop 2000C 超微量分光光度计测定在波长260、280和230 nm的吸光度,计算RNA浓度并评估纯度。
2.实时荧光定量PCR(qRT-PCR)检测PBMC中PCSK9 表达:参照逆转录试剂盒HiScript Q RT SuperMix for qPCR说明书将总RNA反转录为cDNA。参照AceQ qPCR SYBR Green Master Mix(High ROX Premixed)试剂盒说明书进行qPCR反应,内参基因为3磷酸甘油醛脱氢酶(GAPDH)。20 μl反应体系包括:10 μl AceQ qPCR SYBR Green Master Mix,0.4 μl 正向引物,0.4 μl 反向引物,2 μl 模板cDNA 和7.2 μl 双蒸水。反应条件为:95 ℃5 min 1 个循环;95 ℃10 s,60 ℃30 s,40 个循环;95 ℃15 s,60 ℃60 s,95 ℃15 s,1 个循环。PCSK9 正向引物5′-AGGGGAGGACATCATTGGTG-3′,反向引物5′-CAGGTTGGGGGTCAGTACC-3′。GAPDH 正向引物5′-ATGGGGAAGGTGAAGGTCG-3′,反向引物5′-GGGGTCATTGATGGCAACAATA-3′。
3.ELISA 法检测血浆中PCSK9 表达:参照PCSK9 Quantikine ELISA 试剂盒说明书操作,绘制标准曲线,检测血浆中PCSK9的表达水平。
4.外周血CD4+T淋巴细胞分离:分离PBMC加入10倍体积1×BD磁珠缓冲液洗涤,然后每107细胞加入50 μl BD IMagTMCD4+磁珠,混匀,室温孵育30 min 后,加入1 ml 1×BD 磁珠缓冲液,将细胞转移至FACS管中,置于磁力架8 ~10 min。之后弃上清液,将检测管移出磁场,用1 ml 1×BD 磁珠缓冲液冲洗并重悬附于管壁的细胞后,重新置入磁场2 ~4 min,弃上清液,移出磁场,再次重悬后置入磁场2 ~4 min,弃上清液后所得细胞用于后续实验。
5.CD4+T淋巴细胞的刺激培养:将分离的外周血CD4+T淋巴细胞以4×105个/ml的浓度接种于含5%胎牛血清、1%青霉素、链霉素及L-谷氨酰胺的RPMI 1640 培养液的24 孔培养板中。每例受试者的CD4+T 淋巴细胞均分为实验组和对照组,实验组加入2 μg/L 重组PCSK9 蛋白、对照组不加重组PCSK9蛋白培养24 h,收集培养基上清液。
6.ELISA法检测培养基上清液细胞因子水平:参照人IFN-γ ELISA 试剂盒及人IL-17A ELISA 试剂盒说明书操作,绘制标准曲线,对培养基上清液中的IFN-γ和IL-17A水平进行定量检测。
7.统计学分析:采用SPSS22.0统计软件。计数资料采用χ2检验;计量资料用±s表示,组间比较采用独立样本t检验,血浆PCSK9浓度与PASI的关系采用Pearson相关性分析,P<0.05判定为差异有统计学意义。
结果
一、银屑病患者及对照组PBMC 和血浆中PCSK9的表达水平
qRT-PCR 均未检测到银屑病患者和对照组PBMC中PCSK9 mRNA的表达。
ELISA检测显示,银屑病组血浆PCSK9水平为(243.58±11.91)μg/L,对照组为(199.74±31.09)μg/L,两组差异有统计学意义(t=5.761,P<0.001)。银屑病患者血浆PCSK9水平与PASI评分无显著相关性(r=0.187,P=0.431)。
二、PCSK9对银屑病患者和健康对照CD4+T淋巴细胞分泌IFN-γ和IL-17A的影响
银屑病患者实验组IFN-γ 和IL-17A 表达水平均高于银屑病患者对照组(表1),两组差异均有统计学意义(均P<0.05)。健康对照实验组和对照组均未检测到IFN-γ和IL-17A的表达。
讨论
PCSK9 是一种主要由肝细胞合成的分泌型蛋白,在机体中参与调控血脂和胆固醇代谢过程[8]。PCSK9 不仅能够通过诱导LDLR 降解,提高血浆LDL 浓度,还可以通过与LDLR 之间的相互作用调节脂蛋白a的表达,从而参与调节胆固醇和脂类代谢[9]。此外,研究发现PCSK9在机体炎症反应过程中也扮演着重要的角色。氧化的LDL 通过剂量依赖性方式影响巨噬细胞中IL-1α、IL-6 和TNF-α 的分泌,进一步上调PCSK9的表达[10]。Li等[11]研究发现,在稳定型冠心病患者中血浆PCSK9水平与白细胞计数呈正相关,提示血浆PCSK9表达与稳定型冠心病患者慢性炎症状态存在潜在的相互作用。同样,研究表明,在类风湿关节炎(RA)患者中,血清PCSK9 水平明显高于对照组,且与RA 病情活动度呈正相关,提示类风湿关节炎患者全身的炎症状态有可能诱导RA 患者PCSK9 表达增多,PCSK9 通过参与IL-1α、IL-6 和TNFα 等炎症因子的分泌,参与并加重RA 的炎症反应[12]。虽然已经明确PCSK9在代谢紊乱和免疫性疾病中起重要作用,但目前还没有研究涉及PCSK9 与银屑病发病机制的关系。本研究发现,银屑病患者血浆PCSK9 含量明显增高,提示PCSK9可能参与银屑病的发病机制。
表1 ELISA法检测PCSK9对银屑病患者CD4+T淋巴细胞分泌IFN-γ和IL-17A的影响(ng/L,±s)
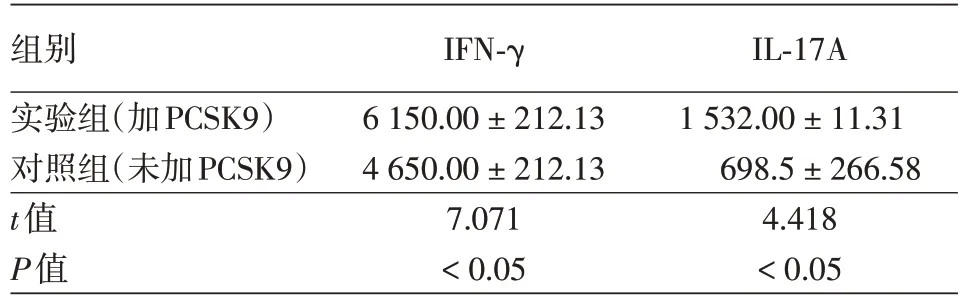
表1 ELISA法检测PCSK9对银屑病患者CD4+T淋巴细胞分泌IFN-γ和IL-17A的影响(ng/L,±s)
注:n=30。PCSK9:前蛋白转化酶枯草溶菌素9;IFN-γ:干扰素γ;IL-17A:白细胞介素17A
组别实验组(加PCSK9)对照组(未加PCSK9)t值P值IFN-γ 6 150.00±212.13 4 650.00±212.13 7.071<0.05 IL-17A 1 532.00±11.31 698.5±266.58 4.418<0.05
为了进一步研究PCSK9 是通过何种途径参与银屑病的异常炎症免疫反应过程,我们分离培养了进展期银屑病患者CD4+T 淋巴细胞,加入重组人PCSK9蛋白进行混合培养,发现PCSK9能够诱导促炎症细胞因子IFN-γ和IL-17A的分泌,而在健康对照人群CD4+T 淋巴细胞中未观察到该变化,考虑可能与银屑病患者异常的炎症反应状态相关。IFN-γ 作为Th1 细胞主要分泌的细胞因子,不仅在银屑病患者血清中高表达,并且表达水平与银屑病患者疾病严重程度相关[13]。IL-17A是Th17细胞的主要效应细胞因子,能够刺激角质形成细胞产生趋化因子、细胞因子和其他促炎介质,从而维持银屑病慢性炎症状态[14]。因此,我们推测PCSK9可能通过诱导CD4+T 细胞分泌炎症细胞因子,从而促进银屑病的异常炎症免疫反应。我们研究发现,银屑病组血浆中PCSK9表达水平高于对照组,但其表达水平与PASI 评分没有相关性,推测PCSK9 可能作为CD4+T 细胞炎症反应过程的诱导分子参与银屑病的发生发展进程,但与银屑病严重程度并不相关。
本研究仍有不足之处,首先未对CD4+T 淋巴细胞亚群进行分析。在银屑病的发病机制中,除了Th1 和Th17 细胞亚群之外,以分泌IL-22 为主的Th22 细胞也在其中发挥重要作用。因此,应进一步探究PCSK9 与CD4+T 淋巴细胞亚群之间的关系。其次,角质形成细胞作为银屑病另一重要靶细胞,其异常增殖、凋亡与银屑病发病过程密切相关。接下来我们将研究PCSK9 对角质形成细胞表型的影响来进一步揭示PCSK9在银屑病中的作用。
综上所述,本研究显示,PCSK9 在银屑病患者血浆中明显增高,PCSK9可能通过诱导银屑病患者CD4+T 淋巴细胞分泌IFN-γ 和IL-17A 在银屑病的发病机制中起重要作用。
