S100β蛋白在脑损伤中的作用及重组人红细胞生成素的干预机制研究*
2019-03-19杨柳王颖洁张莉白雪梅
杨柳,王颖洁,张莉,白雪梅
(大连医科大学附属二院 儿科,辽宁 大连 116027)
随着新生儿存活率提高,新生儿脑损伤及其伴随的神经系统后遗症成为儿科领域关注的重要问题[1-2]。关于其发病机制及治疗方面的研究也较多。为探寻更有效控制和治疗新生儿脑损伤的方法,提高脑损伤新生儿的生存率及改善其预后,本课题对新生大鼠脑损伤发生前后S100β蛋白表达的变化及重组人红细胞生成素(recombinant human erythropoietin,rhEPO)应用与否对S100β蛋白表达的影响进行比较,并在临床观察rhEPO应用对新生儿脑损伤的疗效及对外周血S100β蛋白表达的影响,从而有机地将动物实验与临床实验结合起来,进一步探讨S100β蛋白在新生大鼠缺氧缺血性脑损伤中的意义;明确rhEPO对缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)新生大鼠S100β蛋白的调节作用及对新生儿脑损伤的治疗价值,为rhEPO治疗脑损伤提供理论依据,也为S100β蛋白对新生儿脑损伤的早期诊断、程度评估、疗效及预后评价提供依据。
1 材料与方法
1.1 动物实验及分组处理
1.1.1 实验动物 健康 2 日龄 SD 大鼠(清洁级,母鼠带养)120只(P2),雌雄不限,体重8~15 g。
1.1.2 分组及处理 饲养至 7 日龄,随机分成 3 组 :假手术组、HIBD组和rhEPO组,每组40只。假手术组切开颈部皮肤,分离左颈总动脉后不予结扎,缝合切口后不做低氧处理。HIBD组和rhEPO组采用改良Rice法[3]复制HIBD模型,大鼠乙醚麻醉后,常规消毒切开颈部皮肤,分离并结扎左颈总动脉,缝合切口,待大鼠清醒后置于37℃恒温水浴密闭缺氧舱中,以2 L/min流量向舱内通入8%氧+92%氮混合气体2 h。存活大鼠出现活动减少,间断性抖动,鼻、耳部、四肢及尾部呈缺氧的青紫状,呼吸加深加快,翻身能力、平衡能力及意识较差或存在障碍提示模型复制成功。rhEPO组在复制HIBD术后即刻腹腔注射rhEPO(北京四环生物制药有限公司)5000u/(kg·次),假手术组及HIBD组复制模型后即刻给予腹腔注射等容积生理盐水。
1.1.3 取样及指标检测 各组大鼠分别在出生后第3、5和7天及注射生理盐水和rhEPO后6和24h,第3和7天断尾取血,每次1ml,离心得血清标本,采用ELISA法检验血清中S100β蛋白表达水平。
1.2 临床实验
1.2.1 一般资料 选取2015年2月—2017年10月大连医科大学附属二院妇产科或新生儿科确诊为脑损伤的新生儿25例(脑损伤组),其中轻度脑损伤15例,重度脑损伤10例;选择同期出生的健康新生儿29例为对照组。脑损伤新生儿诊断:①出血性脑损伤:出血急性期MRI表现为T1WI无异常或稍低信号,T2WI呈高信号,亚急性期早期(即出血4~7d),T1WI呈高信号,T2WI稍低信号,慢性期(出血14d以后)T1WI和T2WI均为高信号。②缺血性脑损伤:局灶性缺血性脑损伤MRI表现为半卵圆中心、侧脑室旁簇状或线状的短T1、短T2信号,DWI示受累脑组织明显高信号;弥漫性缺血性损伤仅DWI表现为侧脑室白质大片状高信号改变,神经元轴突损伤表现为大脑皮层、丘脑、小脑、基底核、脑干部位DWI高信号。根据颅脑MRI结果并结合临床确定诊断。本课题经本院伦理委员会同意,与家长进行沟通签署知情同意书,取得家长签字的知情同意书。
1.2.2 纳入与排除标准 纳入标准 :入院时日龄 7d新生儿,符合脑损伤的诊断标准。排除标准:并发宫内TORCH感染,严重先天性畸形,先天性心脏病,遗传代谢性疾病,母亲为甲状腺疾病患者。
1.3 治疗方法
脑损伤的新生儿均给予皮下注射rhEPO(北京四环生物有限公司,国药准字 S20083023),500u/(kg·次),3次/周,疗程3~4周。
1.4 指标检测
脑损伤组在应用rhEPO治疗前和治疗后第3、7和14天,分别留取外周静脉血2ml,同一时间点取对照组血样,将所有血样进行离心处理,取血清,采用ELISA法测定血清S100β蛋白浓度。
1.5 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,多组间不同时间点比较采用重复测量设计的方差分析检验,P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠出生后不同时间的外周血S100β蛋白表达比较
3组大鼠出生后第3、5和7天外周血S100β蛋白表达比较,采用重复测量设计的方差分析,结果:①不同时间点的S100β蛋白表达无差异(F=0.374,P=0.689);② 3组的 S100β 蛋白表达无差异(F=0.681,P=0.504);③3组的S100β蛋白表达变化趋势无差异(F=0.514,P=0.538)。见表1和图1。
2.2 3组大鼠治疗后不同时间的外周血S100β蛋白表达比较
3组大鼠治疗后6和24h,第3和7天外周血S100β蛋白表达比较,采用重复测量设计的方差分析,结果:①不同时间点的S100β蛋白表达有差异(F=276.375,P=0.000);② 3组的S100β蛋白表达有差异(F=238.175,P=0.000),rhEPO 组和 HIBD 组较假手术组高;③3组的S100β蛋白表达变化趋势有差异(F=221.260,P=0.000)。见表2 和图2。
表1 3组大鼠出生后不同时间的外周血S100β蛋白表达比较 (n=40,μg/L,±s)

表1 3组大鼠出生后不同时间的外周血S100β蛋白表达比较 (n=40,μg/L,±s)
组别 第3天 第5天 第7天假手术组 5.26±0.76 5.34±0.75 5.41±0.75 HIBD 组 5.39±0.72 5.32±0.74 5.39±0.74 rhEPO 组 5.28±0.69 5.27±0.70 5.37±0.69
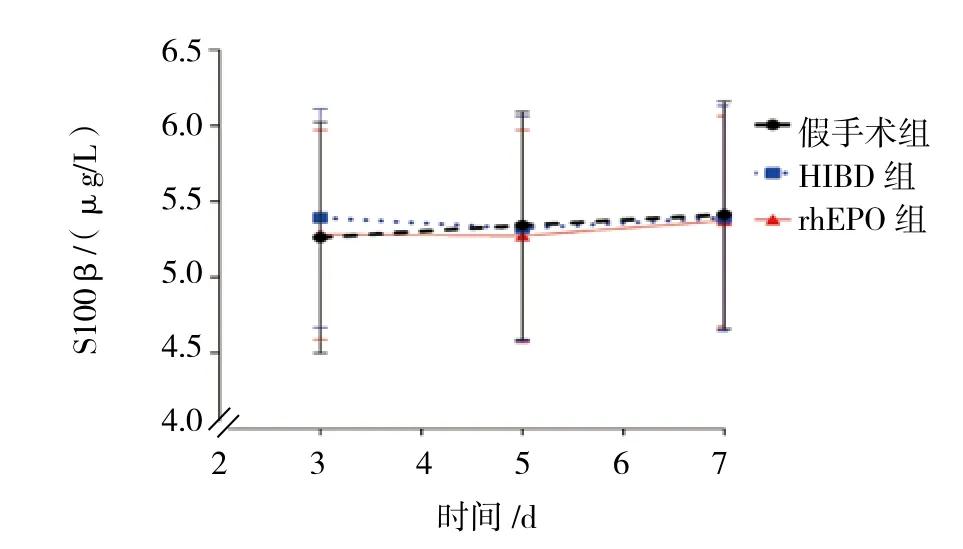
图1 3组大鼠出生后不同时间的外周血S100β蛋白表达比较 (n=40,±s)
表2 3组大鼠治疗后不同时间的外周血S100β蛋白表达比较 (n=40,μg/L,±s)
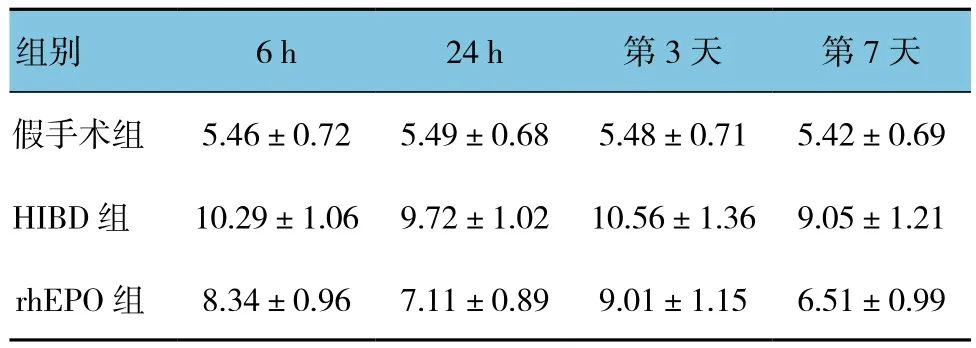
表2 3组大鼠治疗后不同时间的外周血S100β蛋白表达比较 (n=40,μg/L,±s)
组别 6 h 24 h 第3天 第7天假手术组 5.46±0.72 5.49±0.68 5.48±0.71 5.42±0.69 HIBD 组 10.29±1.06 9.72±1.02 10.56±1.36 9.05±1.21 rhEPO 组 8.34±0.96 7.11±0.89 9.01±1.15 6.51±0.99
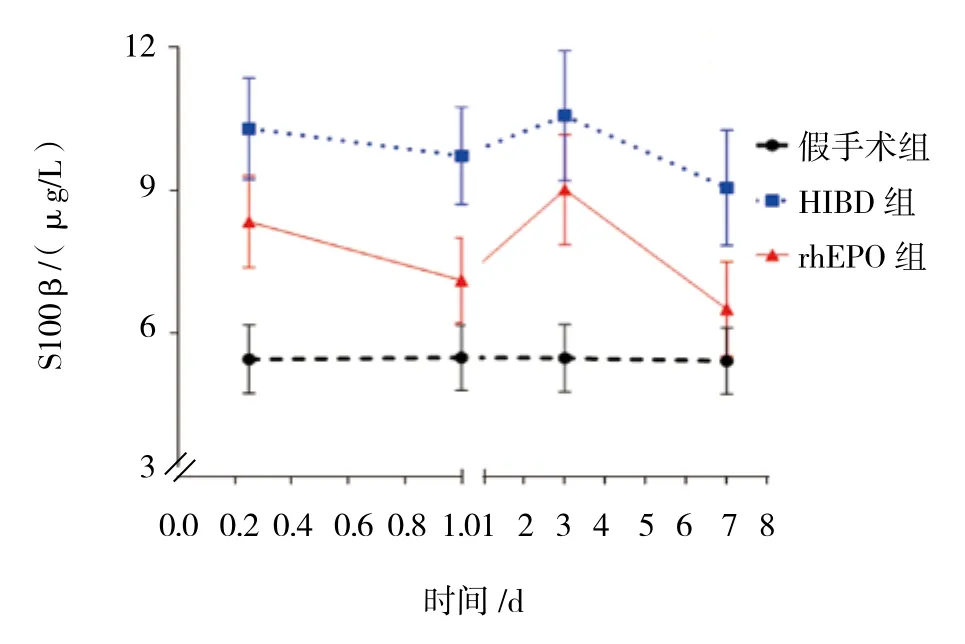
图2 各组大鼠治疗后不同时间的外周血S100β蛋白表达比较 (n=40,±s)
2.3 两组新生儿治疗前后外周血S100β蛋白表达比较
两组新生儿治疗前、治疗后第3、7和14天外周血S100β蛋白表达比较,采用重复测量设计的方差分析,结果:①不同时间点的S100β蛋白表达有差异(F=4.085,P=0.000);② 3 组 S100β 蛋白表达有差异(F=7.939,P=0.000),脑损伤组较对照组高 ;③ 3组S100β 蛋白表达变化趋势有差异(F=2.123,P=0.044),脑损伤组外周血的S100β蛋白表达呈双峰变化,见图3和表3。
2.4 轻度和重度脑损伤新生儿治疗前后外周血S100β蛋白表达比较
3组治疗前、治疗后第3、7和14天外周血S100β蛋白表达比较,采用重复测量设计的方差分析,结果:①不同时间点间的S100β蛋白表达有差异(F=12.771,P=0.000);②3组S100β蛋白表达有差异(F=42.890,P=0.000),重度脑损伤组较其他两组高;③3组S100β蛋白表达变化趋势有差异(F=13.839,P=0.000),轻度和重度脑损伤新生儿组外周血的S100β蛋白表达呈双峰变化。见表4和图4。
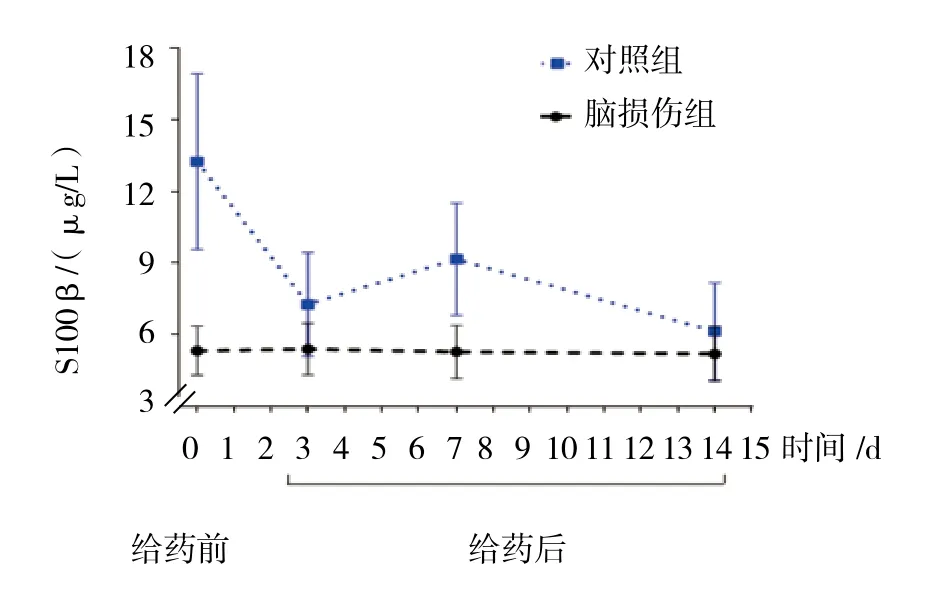
图3 两组新生儿治疗前后外周血S100β蛋白表达比较 (±s)
表3 两组新生儿治疗前后外周血S100β蛋白表达比较 (μg/L,±s)

表3 两组新生儿治疗前后外周血S100β蛋白表达比较 (μg/L,±s)
组别 n 治疗前治疗后第3天 第7天 第14天对照组 29 5.32±1.03 5.39±1.09 5.28±1.11 5.19±1.15脑损伤组 25 13.24±3.68 7.26±2.17 9.15±2.34 6.13±2.04
表4 轻度和重度脑损伤新生儿治疗前后外周血S100β蛋白表达比较 (μg/L,±s)
表4 轻度和重度脑损伤新生儿治疗前后外周血S100β蛋白表达比较 (μg/L,±s)
组别 n 治疗前治疗后第3天 第7天 第14天对照组 29 5.32±1.03 5.39±1.09 5.28±1.11 5.19±1.15轻度脑损伤组 15 11.98±3.16 6.48±2.05 6.52±1.96 5.48±1.09重度脑损伤组 10 15.13±3.73 8.43±2.29 13.10±3.69 7.11±1.36
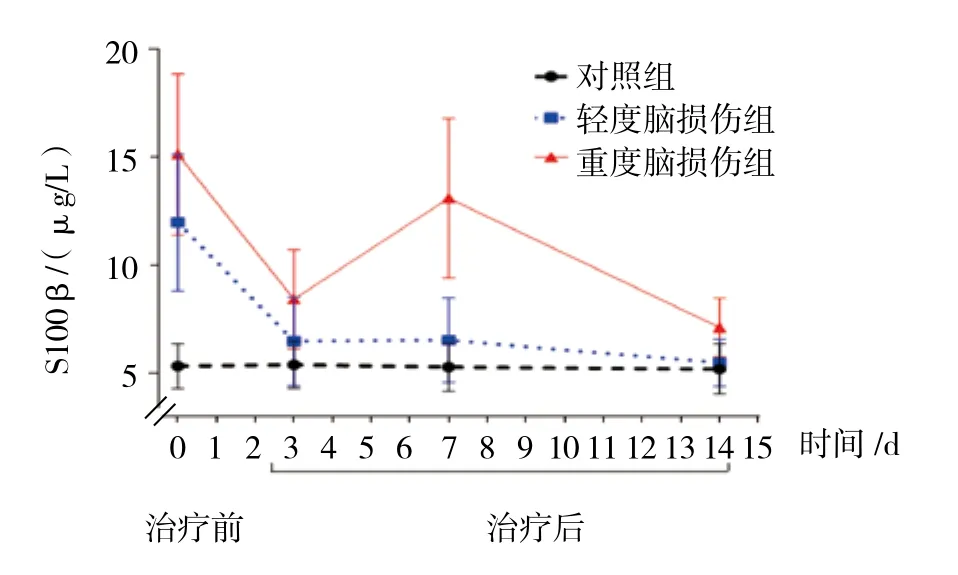
图4 轻度和重度脑损伤新生儿治疗前后外周血S100β蛋白表达比较 (±s)
3 讨论
随着早产儿及重度缺氧缺血性脑病新生儿存活率提高,新生儿缺氧缺血性脑损伤及其伴随的神经系统后遗症成为儿科领域关注的重要问题[4-6]。发病率有逐年上升的趋势,关于其发病机制及治疗方面的研究也较多。
S100β蛋白,作为中枢神经特异蛋白,存在于神经系统星形胶质细胞及少突细胞中,通过钙离子信号转导途径调节细胞代谢及信号传递[7-8]。发生脑损伤时过量的S100β蛋白刺激胶质细胞释放炎症因子、一氧化碳NO导致神经元死亡。S100β蛋白是由胶质细胞产生,作用于神经元及其周围的环境,是神经胶质细胞和神经元相互联系的中介物质之一,在脑的发育过程中和脑损伤时S100β蛋白是一种神经营养因子,适量表达对脑组织起营养保护作用。神经胶质细胞表达过量时,加速神经系统炎症的恶化,并导致神经系统功能紊乱。正常情况下,S100β蛋白不能通过血-脑屏障进入血液,但在一些病理情况下可检测到血清S100β升高。发生脑损伤时过量的S100β蛋白刺激胶质细胞释放炎症因子、NO导致神经元死亡。因此,有学者认为S100β蛋白是迄今最能反映脑损伤程度的特异性蛋白,由于S100β蛋白在脑损伤后有很好的时间变化规律,而且与脑损伤程度有紧密相关性,稳定性又比其他神经生化指标高,研究其在脑损伤后的动态规律变化,将能从分子水平细胞水平给脑损伤程度和治疗效果提供依据[9-10]。本研究结果显示,与对照组比较,不论出生第7天的HIBD新生鼠或第7天诊断为脑损伤的新生儿,外周血的S100β蛋白均增高,可见HIBD新生鼠或诊断为脑损伤的新生儿均存在中枢神经系统受损的情况。
有文献显示,脑损伤大脑各部位的S100β表达呈双峰变化,如皮质部、海马和丘脑均有双峰的变化,虽然各部位双峰出现时间略有差异,但趋势相似,本结果显示,HIBD组外周血S100β表达在第3和14天呈低值,给药前和给药第7天呈高值,与缺血再灌注的二次脑损伤相关,双峰程度也与预后相关。病情较轻或预后良好的脑损伤新生儿在发病时S100β蛋白呈高表达,随着治疗时间延长,外周血S100β蛋白呈降低趋势,病情较重或预后不佳患儿外周血S100β蛋白双峰现象明显,因此也有法医报道将S100β蛋白水平作为生前伤及死后伤鉴别的主要指标,但本课题随访时间较短,病情较轻或预后良好的脑损伤新生儿也可能存在S100β蛋白的双峰表达,而且新生儿的血脑屏障发育尚不成熟S100β蛋白的穿透性也较高,且S100β蛋白在不同的组织也有表达,致使脑损伤新生儿的S100β蛋白在外周血的表达更为复杂,因此有必要扩大样本和延长时间检测。
针对新生儿脑损伤神经保护的研究虽然很多,但是目前尚无一种理想的药物应用于临床,因此,寻找新型高效的脑保护药物以防治新生儿脑损伤是临床上亟待解决的难题。本研究结果显示,不论新生大鼠及新生儿脑损伤,给予rhEPO均可降低外周血S100β蛋白水平达到治疗的目的。rhEPO是一种作用于造血细胞,促进红细胞生成的糖蛋白[11-12],rhEPO能参与rhEPO受体信号通路,以信号转导分子的身份调节细胞内信号的传递[13]。国内外多项临床研究发现[13-15],应用rhEPO能够促进早产儿脑和神经发育,减轻新生儿缺氧缺血性脑损伤时早期脑损害、促进后期神经元及少突细胞的分化、抗神经细胞凋亡等,新生动物或新生儿经腹或皮下注射rhEPO能提高其神经行为能力,rhEPO对心脏也具有良好的保护作用。脑卒中新生鼠实验中,rhEPO可缩小雌性鼠脑梗死范围,提高远期神经预后。rhEPO为神经细胞的发育和存活提供了新途径。在动物模型研究中已证实rhEPO可通过一系列广泛的细胞信号传导通路发挥神经保护作用,抗神经细胞凋亡是目前研究最深入的机制之一[16-17]。
综上所述,S100β蛋白在新生大鼠及新生儿脑损伤可呈双峰变化,其中轻度新生儿脑损伤的S100β蛋白无双峰变化,rhEPO可用于治疗新生大鼠及新生儿脑损伤。但是有关RHEPO对S100β蛋白的调节作用等方面的问题有待于进一步研究。
