18F-FDG PET/CT检查指标预测肝细胞癌微血管侵犯临床价值研究*
2019-03-18幸奠奎程婧
幸奠奎,程婧
肝细胞癌(HCC)是全世界常见的恶性肿瘤之一[1]。全球每年因为HCC导致的死亡人数在50万以上。近年来,我国HCC的发病率呈缓慢上升的趋势,死亡率也逐渐增加,排在癌症死亡的第三位[2-4]。肿瘤具有增长迅速和侵袭能力强的特性,给HCC的治疗带来了很大的困难。目前,治疗肝癌的方法很多,包括手术切除肿瘤、局部射频消融治疗和介入栓塞化疗治疗等。外科手术切除术是治疗HCC患者重要的手段之一,但术后肿瘤复发率高,患者长期生存仍然面临严峻的挑战[5-7]。近年的研究表明,微血管侵犯(microvascular invasion,MVI)是术后HCC复发的主要原因。MVI是一个病理学概念,即在显微镜下观察时,表现为内皮细胞衬覆的血管腔内存在癌细胞团[8,9]。肿瘤侵犯是手术切除肿瘤或肝移植术后肿瘤复发、转移的重要独立危险因素。血管侵犯包括大血管侵犯和微血管侵犯,其中大血管侵犯可经术前影像学检查直接检出,但目前对MVI只能经组织病理学检查才能发现[10-12]。随着影像学技术的发展,影像学检查技术逐步被用于检测HCC患者MVI的存在。氟[18F]脱氧葡萄糖(18F-FDG)的完整化学名为“2-氟 -2-脱氧 -D-葡萄糖”[13,14]。18F-FDG是PET/CT标配的显像剂。PET/CT检查已被用于HCC的早期鉴别诊断、疗效评估和复发监测等方面,但是应用该方法检查HCC患者是否存在MVI的研究还较少[15-17]。本研究使用PET/CT检查了HCC患者,旨在探讨其发现MVI的临床价值。
1 资料与方法
1.1 一般资料 采用回顾性队列研究方法,收集2014年2月~2015年12月我院诊治的99例HCC患者的临床资料,男76例,女23例;年龄范围在42~66岁,平均年龄为(53.3±8.5)岁。其中57例患者有慢性乙型肝炎病史,23例有慢性丙型肝炎病史。经术后组织病理学检查,证实有MVI患者42例,无MVI患者57例。存在MVI与无MVI患者年龄、肿瘤组织学类型和肿瘤细胞分化程度比较,差异均无统计学意义(P>0.05)。MVI是指在显微镜下观察,发现内皮细胞衬覆的血管腔内癌细胞团超过50个时,则称为MVI阳性。根据Edmondson和Steiner分级法,将肿瘤细胞分化分为I、Ⅱ、Ⅲ和Ⅳ级。患者签署知情同意书,本研究经我院医学伦理学委员会批准。
1.218F-FDG PET-CT检查 纳入患者均在术前行18F-FDG PET-CT检查,并且检查与手术间隔时间<2周,影像学检查未见静脉癌栓和远处肿瘤转移,在行18F-FDG PET-CT检查前和术前未进行过任何针对肿瘤的有创检查或未进行相关治疗和穿刺活组织检查等。排除标准:(1)HCC复发的患者;(2)其他病理学类型肝癌,如肝内胆管细胞癌、混合型肝癌、转移瘤等;(3)影像学检查发现存在门静脉栓子;(4)有其他部位恶性肿瘤病史。患者禁食至少6 h。在给药前,检查血糖水平。对血糖水平大于130 mg/dl者,暂停检查,并处理和重新安排检查。给予18F-FDG 55~170 MBq静脉注射。排尿后60 min,开始扫描。采用组合的PET/CT系统(SIEMENS Biograph 6)采集图像和数据[18,19]。由两名资深核医学医师完成对PET/CT检查图片的阅片和评价,分别观察18F-FDG摄取和肝脏放射性分布情况。应用Multimodality工作站行半定量分析,勾画HCC患者病灶感兴趣区(ROI),采用固定阈值法,以标准摄取值(standardized uptake value,SUV) 3.0作为阈值,由软件自动得出肿瘤最长径、最大标准摄取值(maximum standardized uptake value,SUVmax) 等。当存在多个病灶时,只分析最大病灶。
1.3 统计学分析 应用SPSS 19.0软件处理数据。计量资料以(±s)表示,组间比较采用 t检验,P<0.05为差异有统计学意义。
2 结果
2.118F-FDG PET/CT检查结果 在99例HCC患者中,18F-FDG PET/CT检查结果显示,患者肝内病灶呈低密度或稍低密度影,多呈类圆形或呈不规则状,部分肿瘤周围伴有子灶。PET/CT检查显像阳性73例(73.7%)。术后组织病理学检查发现MVI阳性42例(图1),MVI阴性57例(图2)。所有患者其他部位未见18F-FDG摄取异常增高现象。18F-FDG PET/CT检查显示,MVI阳性组肿瘤最长径和SUVmax值均显著大于 MVI阴性组(P<0.01,表 1)。
表1 MVI阳性与MVI阴性HCC患者18F-FDG PET/CT检查结果(%±s)比较

表1 MVI阳性与MVI阴性HCC患者18F-FDG PET/CT检查结果(%±s)比较
例数 PET/CT检查阳性 肿瘤直径(cm) SUV max MVI阳性 42 36(85.7) 7.6±2.8 7.4±5.2 MVI阴性 57 37(64.9) 5.4±2.4 5.3±5.2统计值 x2=5.4 t=-3.8 t=-3.6 P值 0.021 <0.05 <0.05
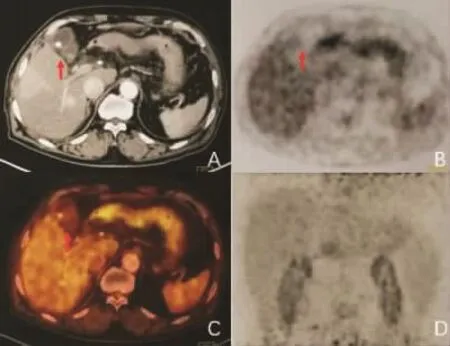
图1 57岁男性HCC伴MVI患者18F-FDG PET/CT检查表现
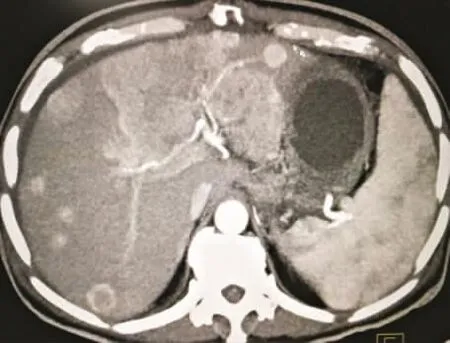
图2 53岁男性HCC无MVI患者CT检查表现 显示肝内圆形低密度阴影,界限清晰
2.2 存在MVI与无MVI的HCC患者肿瘤组织学类型和肿瘤分化程度比较 MVI阳性与MVI阴性患者肿瘤组织学类型差异无统计学意义(P>0.05),但MVI阳性患者肿瘤分化为III/IV型比例显著高于 MVI阴性患者(88.1%对 75.4%,P<0.05,表 2)。
2.3 治疗与随访情况 所有HCC患者接受肝叶切除术治疗,术后随访12~24个月,中位随访时间为18个月,99例HCC患者1 a总体生存率为81.8%,无瘤生存率为60.6%,其中MVI阳性组1 a总体生存率和无瘤生存率分别为66.7%和47.6%,显著低于 MVI阴性组的91.2%和70.2%(P<0.05)。
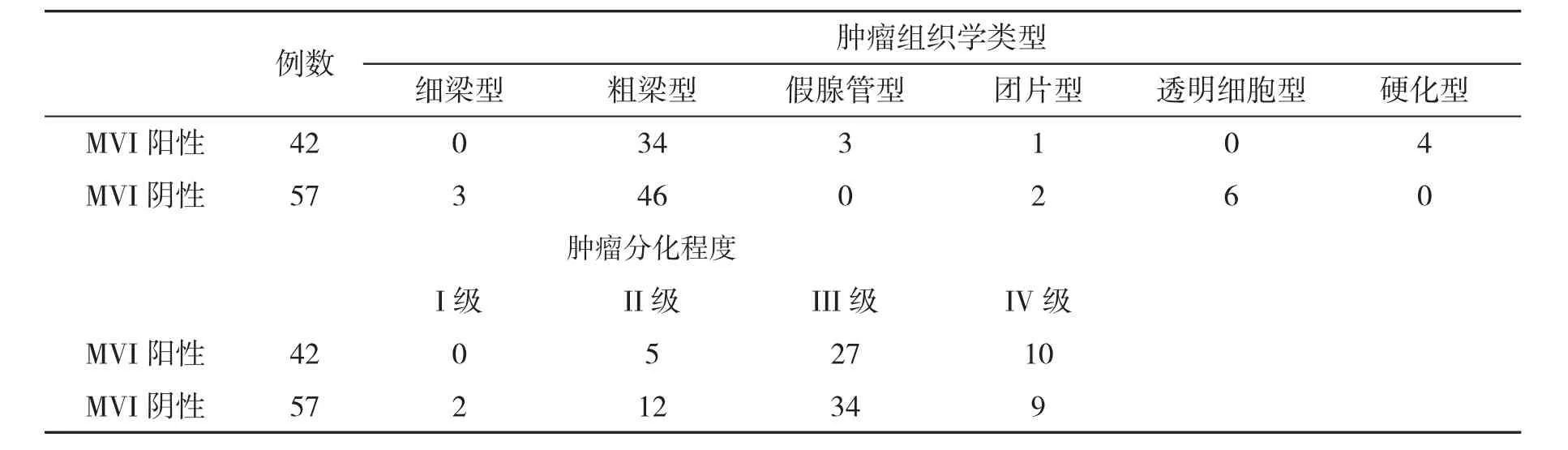
表2 存在MVI与无MVI的HCC患者肿瘤组织病理学特征比较
3 讨论
MVI是HCC复发的高危因素,MVI是HCC发生转移或侵袭的前兆。同时,MVI也是临床医生努力改善肝癌术后生存的重要切入点。如果能够在术前诊断出患者存在MVI的情况,将为临床医生对选择合适的治疗方法提供指导。MVI多见于癌旁肝组织内门静脉小分支和肿瘤包膜内血管,与门静脉血流动力学紊乱造成HCC出瘤血管迂曲和血流缓慢。MVI也可发生于次要的出瘤血管,如肝静脉分支,偶尔可发生于肝动脉、胆管以及淋巴管等脉管小分支[20-23]。有文献报道,HCC患者MVI发生率为15.0%~57.1%,其差异变化可能与标本取材和肿瘤分期不同等有关。本组HCC患者MVI发生率为42.4%。目前,MVI的诊断仍需要通过术后组织病理学检查来明确,导致临床医生无法在临床治疗决策及评估前作出正确的判断,可能延误了对病情的准确判断和正确的处理。
18F-FDG PET/CT扫描检查是分子影像学的重要方法,该方法由PET检查提供病灶的功能和代谢等分子信息,而CT检查提供病灶的精确解剖定位,一次检查即可了解全身的整体情况,诸如肿瘤部位、远处侵犯和其他器官功能状况。本研究发现的合并MVI的HCC患者的一些扫描特征值得总结和应用,其是否能在术前对肿瘤的分期判断方面发挥作用,仍需要积累资料。
本研究的局限性在于纳入患者例数较少,肿瘤的细胞分化、肿瘤分期和合并基础疾病等方面还未分层比较,尤其是对合并MVI与无MVI患者远期生存情况仍需要观察。后续研究可以继续扩大患者样本量和多中心研究以进一步验证。首先,应该对是否存在MVI进行科学的判定,如取材部位的确定、诊断标准和定量方法等。再结合18F-FDG PET/CT扫描指标,找到可应用的对应指标,以作出是否合并存在MVI的客观依据,再对患者进行并发症、转移和生存随访。
