低盐饮食对高果糖所致心肌肥大的保护作用
2019-03-14李思奇邓淑华谢晶舟文丽静苏焕厚王丽京郑凌云
李思奇,邓淑华,谢晶舟,文丽静,苏焕厚,王丽京,郑凌云
(广东药科大学生命科学与生物制药学院,广东 广州510006)
心肌肥大是许多心血管疾病(如急性心肌梗死、高血压、先天性心脏病和糖尿病性心肌病)发生发展共有的病理变化,是心脏在各种内在或外在病理作用刺激下的适应性结构反应和代偿机制[1-2]。其主要特征为心肌细胞体积增大,蛋白质含量增加,心肌肥大标志物表达增加[3],从而使心肌耗氧增加,或进入心肌冬眠状态,心脏收缩功能减弱引起组织重构最终导致心力衰竭[4]。因此有效阻止和逆转心肌肥大是防止心衰的关键。
有研究显示,随着饮食结构的改变,果糖和盐的摄取呈现进行性增加的趋势[5-6]。果糖的甜度是蔗糖的1.5倍,由于其生产廉价被广泛应用于蛋糕、饮料等糖类制品中[7-8]。动物研究证实富含果糖的饮食可增加心血管疾病的风险包括高血压、高血糖、血脂异常[9]。血压的升高又会增加心脏的容量负荷、压力负荷从而使心脏出现代偿性增生肥大[10]。
而盐的摄取对心血管的损伤是把双刃剑,过量会增加患心血管疾病的风险。且长期高盐饮食可导致心肌重构,主要病理变化为不同程度的心肌肥大和心脏纤维化[11],且随摄盐量的增加,患者心脏重塑越显著[12]。临床统计表明低盐饮食干预能有效控制高血压患者的动态血压[13],提示低盐饮食可能通过控制血压调节心肌负荷。
研究也表明,高果糖饮食引起的心肌线粒体水肿、心肌肥厚、高血压、糖脂代谢异常等与果糖本身促进肾小管水钠重吸收有密切关系[14]。但同时也有研究证实心肌肥大本身是引发心衰的独立危险因素,并不依赖血压的进行性升高[15]。
因此,高果糖引起的心肌肥大是否与促进水钠潴留有关并不十分清楚,本研究利用低盐饮食探究盐在高果糖导致的心肌肥大中的作用及其机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 SPF级Wistar大鼠48只(雄性),6~8周龄,体质量180~200 g,由广东省医学实验动物中心提供,生产许可证号:SCXK(粤)2011-0029。
1.1.2 试剂与仪器 TS-12N全自动生物组织脱水机(湖北孝感宏业医用仪器公司);石蜡切片机(Leica,德国);石蜡包埋机(湖北孝感亚光医用电子技术有限公司);光学显微镜(日本奥林巴斯);Sirius Red染色试剂盒(Sigma,美国);HE染色试剂盒(江西南昌雨露有限公司);果糖(AMRESCO,美国);APES(北京中杉金桥生物公司);兔抗大鼠α-平滑肌肌动蛋白(α-SMA,武汉博士德);羊抗兔二抗(北京中杉金桥生物公司);DAB显色剂(CST,美国)。
1.2 方法
1.2.1 动物模型的建立 将实验大鼠随机分为5组,每组8只:(1)对照组(Con组),给予标准大鼠配合饲料(含0.5%NaCl,w/w)并饮用蒸馏水8周;(2)高盐组(HS组),给予8%高盐饲料,饮用正常的蒸馏水;(3)高果糖组(HF组),10%果糖水(w/v)及大鼠配合饲料;(4)高果糖联合高盐组(HFHS组),饮用10%果糖水(w/v)并给予8%高盐饲料;(5)高果糖联合低盐组(HFLS组),饮用10%果糖水(w/v)并给予0.07%低盐饲料(w/w)。
1.2.2 大鼠心质量体质量比检测 对各组大鼠进行称重后,麻醉小鼠后对其解剖,收集各组大鼠心脏组织称重,计算后得到数据。
1.2.3 大鼠心脏HE染色 收集各组大鼠心脏组织并将其横切后固定,脱水,包埋后制备3 μm组织切片,用APES处理过的载破片收集组织切片,烘干。组织切片梯度脱蜡:二甲苯Ⅰ、二甲苯Ⅱ各30 min,无水乙醇Ⅰ、无水乙醇Ⅱ各15 min,95%(φ)乙醇10 min,90%乙醇5 min,95%乙醇5 min后,苏木素染色1~2 min,流水返蓝1 h后伊红染10 s,透明后中性树胶封片拍照,采用Ipp软件测量小鼠单个心肌细胞面积。
1.2.4 大鼠心脏Sirius Red染色 取各组大鼠心脏组织石蜡切片,脱蜡后天狼星红染色液滴染1 h,流水稍加冲洗,去除切面表面染液后苏木素染核10 min,流水返蓝10 min,透明后中性树胶封片拍照,采用Ipp软件计算天狼星红阳性表达率。
1.2.5 大鼠心脏免疫组化染色 取各组大鼠心脏组织石蜡切片,脱蜡后PBS洗净残余乙醇,置于枸橼酸盐溶液中高压修复,37 ℃ 3%H2O2-CH3OH孵育30 min,PBS洗后10%BSA封闭1 h,兔抗大鼠α-SMA 1∶100稀释后4 ℃孵育过夜,次日复温后洗净残余一抗,37 ℃敷二抗2 h,显微镜下显色观察,出现阳性表达后终止显色,苏木素复染返蓝20 min,透明后封片拍照,采用Ipp软件计算α-SMA阳性表达率。
1.3 统计学方法

2 结果
2.1 低盐饮食对心质量体质量比的影响
由图1可看出:与Con组(0.003 008±0.000 2086)相比,HS组(0.003 455±0.000 3674)、HF组(0.003 296±0.000 2381)、HFHS组(0.003 615±0.000 5157)心质量体质量比都有显著升高(P<0.05),提示高盐、高果糖都会造成一定程度的心脏重塑,而HFLS(0.002 800±0.000 3674)组较HF组心质量体质量比明显降低(P<0.01),提示高果糖合并高盐加重心脏重塑,低盐饮食对高果糖引起心脏重塑有保护作用。
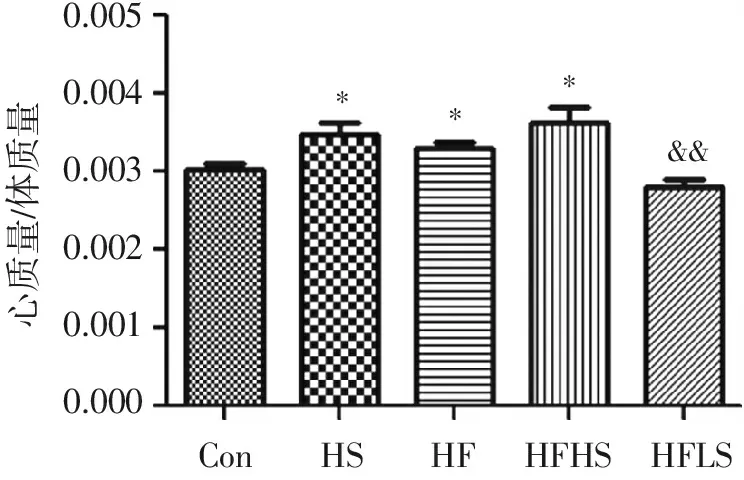
0.0050.0040.0030.0020.0010.000心质量/体质量ConHFHSHFHSHFLS***&&
与Con组比较:*P<0.05; 与HF组比较:&&P<0.01。
图1高盐、高果糖、高盐联合高果糖及低盐对心质量体质量比的影响
Figure1Effect of high salt,high fructose,high salt combined with high fructose and low salt on the ratio of rat heart and body weight
2.2 高盐、高果糖、高盐联合高果糖及低盐对单个心肌细胞面积的影响
由图2可看出:与Con组心肌单个细胞面积(0.189 9±0.079 06)μm2比较,仅高盐饮食对心肌单个细胞面积影响不大(0.196 6±0.187 3)μm2,但HF组(0.442 3±0.178 0)μm2的心肌细胞明显增大(P<0.01),部分细胞间间隙模糊,心肌纤维融合、断裂呈波浪状改变,伴有炎性细胞浸润。HFHS组(0.420 9±0.235 9)μm2心肌细胞面积与对照组相比也有明显增加,与HF组相比心肌细胞面积增加不明显,伴有心肌纤维融合、断裂更加严重,炎性细胞浸润明显。而HFLS组心肌细胞横截面积(0.157 1±0.068 51)μm2相对于HF组有明显减小(P<0.01),无明显炎症细胞浸润,心肌细胞间间隙清晰,细胞结构有明显改善,说明低盐饮食在一定程度上改善了高果糖诱导的心肌肥大。
2.3 高盐、高果糖、高盐联合高果糖及低盐对心肌间质胶原沉积的影响
由图3可看出:Con组天狼星红阳性表达率为(4.104±2.010)%,心肌间质几乎无胶原纤维分布;HS组天狼星红阳性表达率(10.94±1.603)%及HF组天狼星红阳性表达率(8.68±3.407)%相对于Con都有所增加(P<0.05),但HF组增加趋势没有HS组明显,提示单纯高盐或单纯高果糖均可引起明显的心脏纤维化,单纯高盐在刺激心肌纤维化上作用更强。

与Con比较:**P<0.01; 与HF组比较:&&P<0.01。
图2高盐、高果糖、高盐联合高果糖及低盐对单个心肌细胞面积的影响
Figure2Effect of high salt,high fructose,high salt combined with high fructose and low salt on the myocardial cell area
高果糖联合高盐后,天狼星红阳性表达相比HS组及HF组都有明显增加,说明联合作用后心肌间质胶原沉积效果叠加。相反,低盐饮食(3.250±1.434)%能显著减轻高果糖引起心肌纤维化程度(P<0.01)。
2.4 高盐、高果糖、高盐联合高果糖及低盐对心肌成纤维细胞增生的影响
由图4可以看出,HF组α-SMA阳性表达率(0.138 7±0.063 81)%和HS组α-SMA阳性表达率(0.086 43±0.038 78)%相对于对照组(0.019 75±0.033 87)%明显增加(P<0.01),提示单纯高盐或高果糖皆可促进心肌成纤维细胞增多;HFHS组阳性表达率(0.164 3±0.054 05)%较HF组明显增多,提示两者对心脏纤维化的作用机制可能存在差异;而HFLS组阳性表达率(0.031 64±0.052 23)%与对照组相比明显减少(P<0.01),提示低盐饮食可有效逆转高果糖引起的心脏纤维化增生。
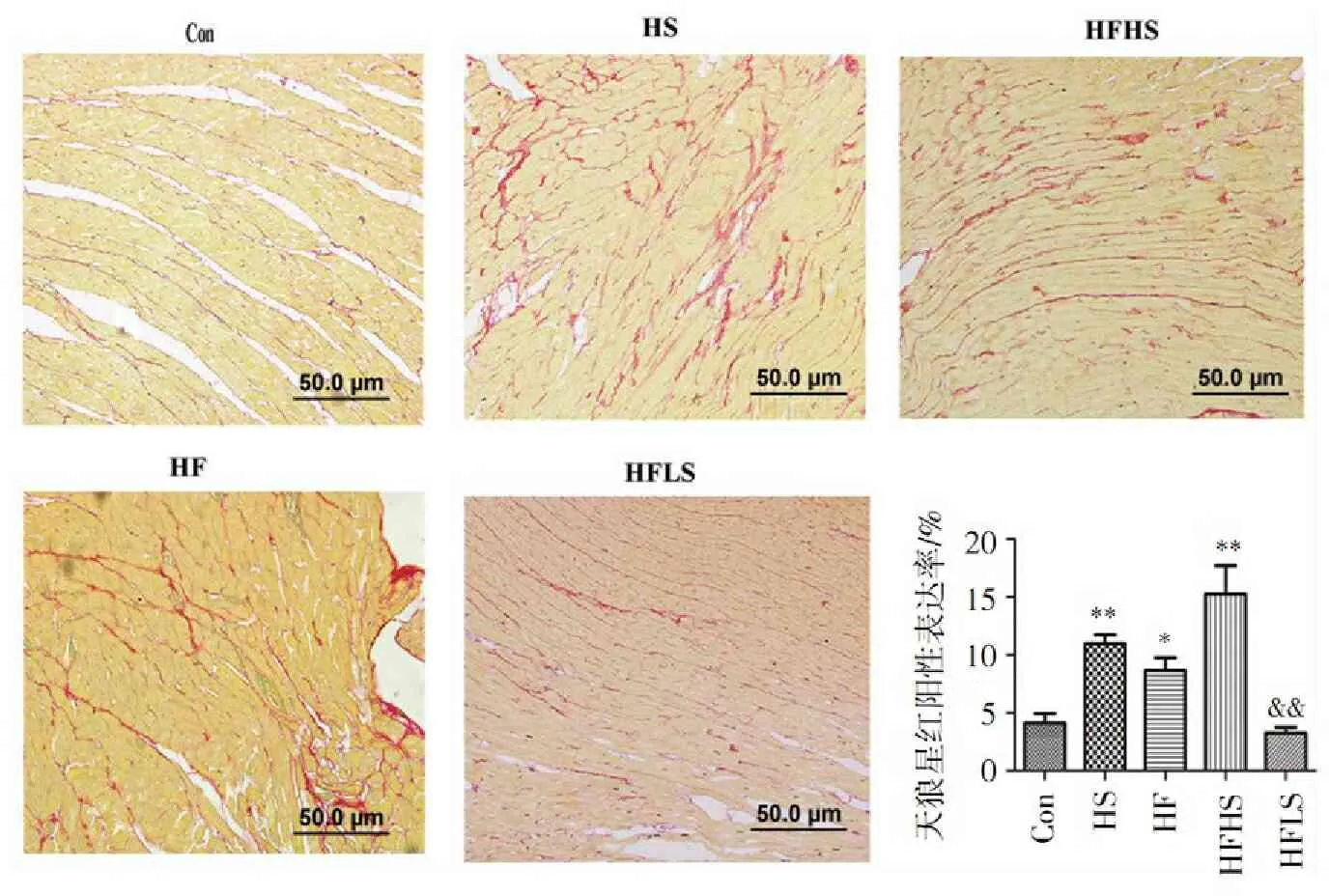
与对照组比较:*P<0.05,**P<0.01;与HF组比较:&&P<0.01。
图3高盐、高果糖、高盐联合高果糖及低盐对天狼星红阳性表达的影响
Figure3Effect of highsalt,high fructose,high salt combined with high fructose and low salt on the positive staining areas of Sirius Red
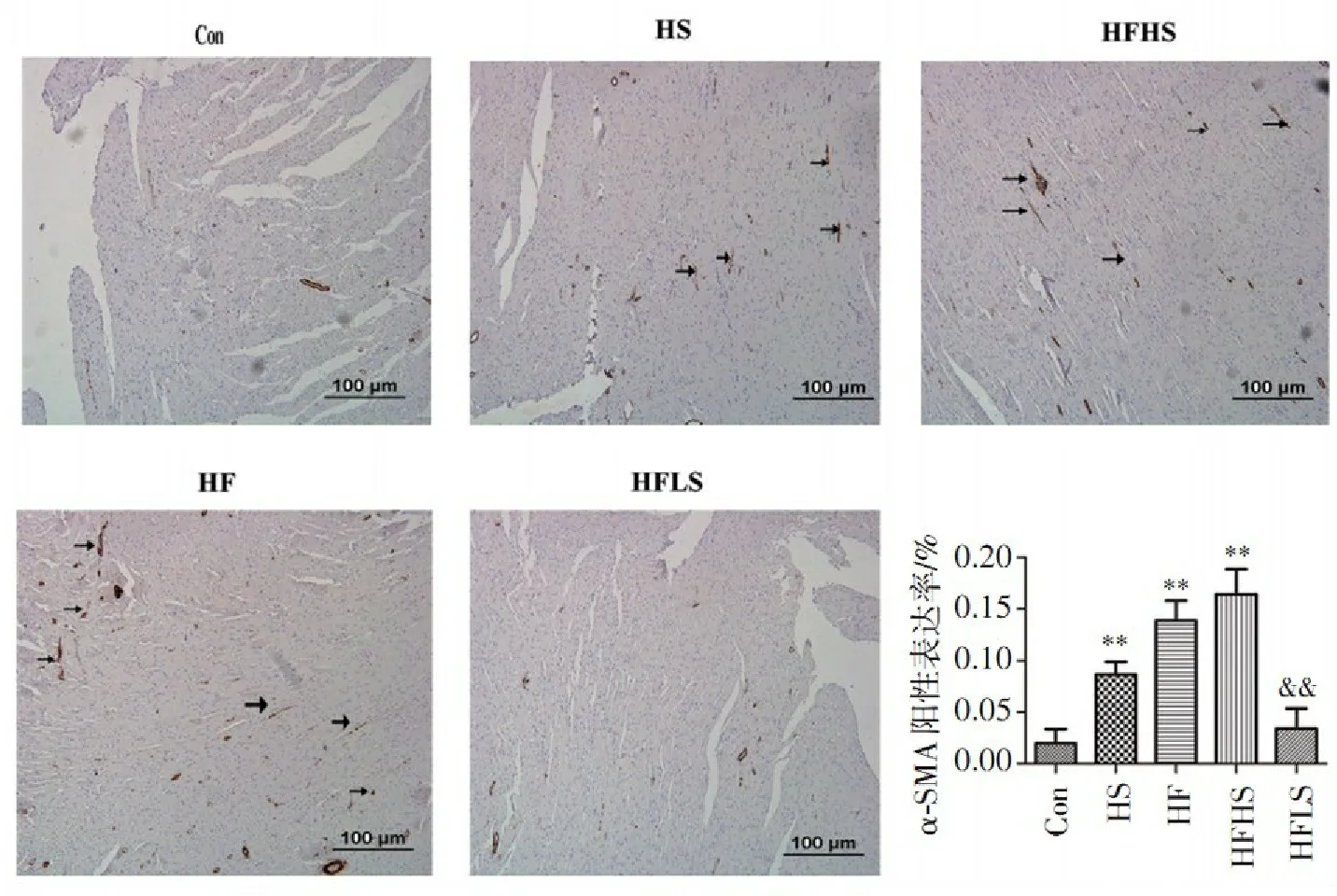
与Con组比较:**P<0.01;与HF组比较:&&P<0.01。
图4高盐、高果糖、高盐联合高果糖及低盐对α-SMA阳性表达的影响
Figure4Effect of high salt,high fructose,high salt combined with high fructose and low salt on the positive staining areas of α-SMA
3 讨论
研究表明,左心室肥大是加重心力衰竭、脑卒中、心肌缺血及猝死等心血管疾病的危险因素[16]。单纯高果糖可刺激离体大鼠心肌细胞肥大[17],动物实验发现高果糖干预小鼠10周时出现心肌肥厚[18]。HF组大鼠心质量体质量比及心脏单个细胞面积明显增加,与文献报道相似。因为高果糖饮食能提高近端小管对Na+的通透性,促使Na+的重吸收[19],导致钠水潴留、血压升高、心脏压力负荷增加。同时前期研究结果证实[20],醛固酮受体抑制剂螺内酯能通过降低钠离子重吸收降低肾损伤抑制血压升高,提示高果糖饮食诱导心肌肥大可能与钠离子在肾小管的运输相关。
高盐摄入可增强脂联素介导的对肾脏钠-葡萄糖共转运蛋白2(SGLT2)的抑制作用,从而增加尿钠及尿糖排泄,这一作用在血糖控制不佳时明显降低[21],提示盐摄入在血糖异常情况下参与对水钠代谢的调节。研究证实,高盐饮食可引起心肌肥大[22],本研究中HF组心肌细胞部分呈现面积增大,统计结果与Con组差别不显著,可能是高盐摄入时间较短,所引起的大鼠心肌细胞肥大的程度较轻。同期在小鼠上的研究显示4周的8%高盐饮食确实可导致显著的心肌肥大,与文献报道相符[22]。HFHS组心肌细胞面积明显大于Con组与HS组,提示高果糖引起的心肌肥大不仅是因为其促进水钠潴留作用,还与其他因素相关。
心肌肥大作为心脏的结构性适应,与非心肌细胞(如成纤维细胞、平滑肌细胞、内皮细胞等)以及细胞外基质(主要是胶原纤维)的共同改变有关[23]。心肌胶质纤维骨架是心肌毛细血管的保护支架,同时保证心肌收缩、舒张立体结构功能,其异常主要表现为细胞外基质胶原沉积增多,排列紊乱,Ⅰ型胶原及Ⅲ型胶原比例失调[24]。
天狼星红染色结果显示,单纯高盐或高果糖饮食均可明显增加心脏胶原沉积,高盐对其影响更明显,高果糖组在低盐饮食后明显改善心肌细胞表型,提示高盐可能通过破坏心肌胶质纤维骨架,影响心肌细胞正常收缩舒张功能,低盐饮食则可通过清除细胞外基质胶原沉积而改善心脏纤维化。
心脏中成纤维细胞活化能够调节心肌细胞的肥大[25]。本研究显示,HF组心脏α-SMA阳性染色相对于Con组明显增加,提示高果糖可诱导心脏成纤维细胞异常增殖。进一步分析,高盐联合高果糖饮食后,心脏成纤维细胞进一步增殖,低盐饮食可逆转这一现象。有研究显示心脏肥厚并不都伴随着心肌纤维化,系统性高血压患者虽然右侧心肌细胞无肥大,但右室却有胶原沉积。提示心肌肥大并非胶原沉积的必然条件[26]。本研究中单纯高盐诱导后,HS组相对于Con组细胞外基质沉积明显增加,且伴有α-SMA表达的成纤维细胞异常增殖,而心肌细胞单个面积与Con相比没有明显增加。大多数实验性高血压动物,在心肌肥大早期就伴随心肌纤维化[27]。笔者前期研究[20]表明,与对照组相比,高果糖和单纯高盐都可引起大鼠血压升高,但两组间血压值无明显差异。
本研究结果证实,高盐引起的心肌损伤主要以心肌纤维化为主,高果糖则引起的心脏损伤主要以心肌肥大为主,同时伴有成纤维细胞增殖和细胞外基质沉积,这可能与果糖促进水钠的重吸收有一定关系,但也同时表明高果糖本身对心肌细胞有致肥大效应且不完全依赖血压的进行性升高。低盐饮食可能通过调控成纤维细胞增殖和活性减少细胞外基质沉积及心肌细胞间胶质纤维骨架形成而改善高果糖引起的心肌肥大伴纤维化病理损伤。此外,低盐饮食还可能直接通过干预高果糖本身对心肌细胞的作用而抑制心肌细胞肥大,但其具体分子机制需进一步体外实验验证。
