云南樱桃Cerasus yunnanensis优株组培无菌材料获得方法的研究*
2019-03-13张晓明叶小玲胡晓敏
张晓明 叶小玲 胡晓敏
(1.广州旺地园林工程有限公司,广东 广州 510335;2. 英德市旺地樱花种植有限公司,广东 英德 513000;3.韶关市旺地樱花种植有限公司,广东 韶关 512000;4.广州天适集团有限公司,广东 广州 510335)
云南樱桃Cerasus yunnanensis属蔷薇科Roseace樱属落叶乔木,原产我国云南、四川和广西[1]。广州天适集团有限公司多年前从野生云南樱桃中选育出一优良单株,具有生长速度快、冠型好、花量繁密、花瓣大、花色粉红艳丽、耐热性好、抗逆性强等优点,适合华南及周边地区种植,推广前景广阔[2]。
该优株可通过种子进行繁殖,但实生苗难以保持母本优良性状,生长量、花型和花色分化均较大,不稳定。其常规无性繁殖主要采用嫁接繁殖,嫁接所用砧木种类和穗条木质化程度对其嫁接成活影响很大,在广东适宜的嫁接时间为12月至次年1月,鉴于嫁接用母株枝条数量及嫁接时间的限制,严重制约了其快速推广应用[3~4]。组织培养快速繁殖技术为其大规模高效繁殖提供了有效途径,其中无菌系的建立是其组培快繁技术关键之一。
樱花组织培养技术研究较晚,目前有关樱花无菌系建立的报道不多[5~6],已有的樱属植物外植体灭菌方法对该云南樱桃优株外植体灭菌效果差。该云南樱桃优株长期定植于户外,因长期暴露在空气中,体表附着大量微生物,体内内生菌多,脱毒困难[7]。其体内内含物多,褐化现象严重。此外,樱属植物多具皮孔,叶基部有托叶,清洗和脱毒过程中托叶易脱落,而导致外植体容易受到清洁剂、消毒剂等伤害;其叶片基部的腺体分泌大量粘液,吸引昆虫攀爬和吮食,导致细菌入侵,从而增加了外植体消毒的困难。可见,对污染和褐化的控制是其无菌系建立的关键所在。本文以云南樱桃优株的嫩枝为外植体,通过研究预处理方式、取材时间、取材部位和消毒方法对其无菌材料获得的影响,完善其无菌系建立技术,为其组培快繁技术建立奠定基础,并为其他樱属植物组培快繁技术提供参考借鉴。
1 材料与方法
1.1 材料
在广州天适集团有限公司韶关市乳源县大布基地内,从7年生的优株上剪取嫩枝作为外植体。
1.2 方法
1.2.1 预处理方法的筛选
本试验共设置4种预处理方法,其中处理1~3所用外植体是2013年4月取自优株上的半木质化枝条,处理4所用外植体取自2013年1月初嫁接于钟花樱桃(寒绯樱)Cerasus campanulata上的该优株萌枝。取外植体应选择天气晴朗的 10∶00—11∶00时段。各处理如下:
1)将外植体置于自来水下冲洗去表面泥土,剪去叶片(留叶柄),在自来水中加入适量洗洁精和2滴吐温,用棉球蘸洗洁精溶液轻轻刷洗外植体表面,然后用自来水冲洗干净洗洁精,再用消毒剂进行表面消毒灭菌。
2)将外植体置于自来水下冲洗去表面泥土,将其基部用灭过菌的湿润纱布包裹,按自然生长方向置于烧杯中,套上保鲜袋,放入4℃冰箱低温冷藏,分别于l d、3 d、5 d、7 d和10 d后取出,剪去叶片,在自来水中加入适量洗洁精和2滴吐温,用棉球蘸洗洁精溶液轻轻刷洗腋芽及茎段,用自来水冲洗干净后用消毒剂进行表面消毒灭菌。
3)将外植体置于自来水下冲洗去表面泥土,剪去叶片(留叶柄),在自来水中加入适量洗洁精和2滴吐温,用棉球蘸洗洁精溶液轻轻刷外植体表面,用自来水冲洗干净洗洁精,然后把其基部用灭过菌的湿润纱布包裹,按自然生长方向置于烧杯中,套上保鲜袋,放入4℃冰箱低温冷藏,ld后取出置于超净工作台,用消毒剂进行表面消毒灭菌。
4)取得的外植体按处理1进行预处理。
以上各预处理后,取外植体顶芽下第4~5个茎节进行表面消毒灭菌,均按1.2.4中的d处理进行。
1.2.2 取材时间的筛选
分别于2013年4月、7月和10月,于天气晴朗的 10∶00—11∶00 时段,剪取半木质化萌枝的顶芽下第4~5个茎节为外植体,按照预处理2的方法冷藏1 d,然后用1.2.4中的d处理进行外植体的表面灭菌。
1.2.3 取材部位的筛选
2013年4月于天气晴朗的10∶00—11∶00时段,剪取半木质化萌枝为外植体,将其分为3部分(Ⅰ号为顶芽及顶芽以下2个茎节,Ⅱ号为Ⅰ号外植体以下2~3个茎节,Ⅲ号为Ⅱ号以下茎节),采用1.2.1预处理2的方法冷藏1 d,然后用1.2.4中的d处理进行外植体的表面灭菌(Ⅰ号、Ⅱ号和Ⅲ号升汞的较佳处理时间分别为2~3 min、4~5 min和6~8 min)。
1.2.4 消毒灭菌方法的筛选
2013年4月于天气晴朗的10∶00—11∶00时段,剪取半木质化萌枝为外植体,将外植体置于自来水下冲洗去表面泥土,剪去叶片(留叶柄),在自来水中加入适量洗洁精和2滴吐温,用棉球蘸洗洁精溶液轻轻刷洗外植体表面,后用自来水冲洗干净,在超净工作台上将枝条分成2~3 cm小段,无菌水冲洗干净后,在每个无菌玻璃瓶中放置5~10个芽段,再按照以下5种消毒方式进行表面消毒:
a)2%次氯酸钠溶液8~20 min(时间依据材料幼嫩程度而定);
b)0.1%升汞溶液2~8 min(时间依据材料幼嫩程度而定);
c)75%酒精溶液30 s+0.1%升汞溶液2~8 min;
d)1%新洁尔灭5 min+0.1%升汞溶液2~8 min;
e)1%新洁尔灭5 min+75%酒精溶液30 s +0.1%升汞溶液2~8 min。
其中2%次氯酸钠和0.1%升汞溶液具体的消毒时间根据茎段的幼嫩程度而定,如1.2.3中分级,Ⅰ级茎段2%次氯酸钠溶液处理时间为8 min,而0.1%升汞溶液处理时间为2 min。各消毒剂使用后都需用无菌水清洗干净,消毒和清洗过程中要不停地晃动玻璃瓶,使外植体与消毒剂或无菌水充分接触,每次无菌水冲洗时需晃动玻璃瓶不少于30 s。把消毒后的外植体置于接种盘中,用接种刀切除叶柄以及外植体两端受伤部位,再接种于诱导培养基上,每瓶接种1个外植体。
每个处理接种100瓶。15 d后观察并记录各小组的污染率、褐化/死亡率和成活率。
2 结果与分析
2.1 预处理方式对外植体存活的影响
表1结果显示,通过将野外枝条嫁接到砧木上于温室内养护管理的效果最好,污染率和褐化/死亡率均在10%以内,存活率高达82%。野外采集的外植体宜随采随处理,及时处理的存活率最高,达51%,随着冷藏时间的延长,污染率和褐化/死亡率升高,而成活率降低。当枝条贮藏时间超过7 d,基本很难获得存活个体。此外,枝条带叶冷藏较去掉叶片清洗后保存效果好,可能是清洗后冷藏加速了托叶脱落。试验过程中发现,随着冷藏时间的延长,托叶脱落现象加重,5 d后托叶基本都脱落,增加了植物材料与环境的接触面,加重了环境中微生物、杀菌剂等对外植体的损害(图1~2)。故野外采回来的外植体应尽快处理,冷藏时间不宜超过5 d。
综上,合适的预处理方式可有效减轻云南樱桃优良单株外植体的带菌情况。对于野外材料,条件允许情况下,可以先在温室嫁接,再取其萌枝作为外植体。若条件不允许,则采回后应及时处理,且外植体带叶冷藏的时间不宜超过5 d,采集和处理过程中尽量减少托叶的脱落。
2.2 采集时间对外植体存活的影响
表2的试验结果显示,不同的取材时间会影响云南樱桃优株进瓶效果。在3个取材时间中,4月为最佳取材时间,取材接种的外植体污染率和褐化/死亡率均最低,而存活率最高,高达51%。由于7月份南方降雨量大、气温高、湿度大,各类菌的活动旺盛期,此时取材接种的外植体效果最差,污染率高达57%,而存活率仅19%。10月份取材接种外植体效果不理想,稍好于7月处理的外植体的效果。综上,云南樱桃优株外植体的最佳采集时间为春季3—4月,一般是在春季抽梢半木质化到萌动腋芽长出芽鳞前。
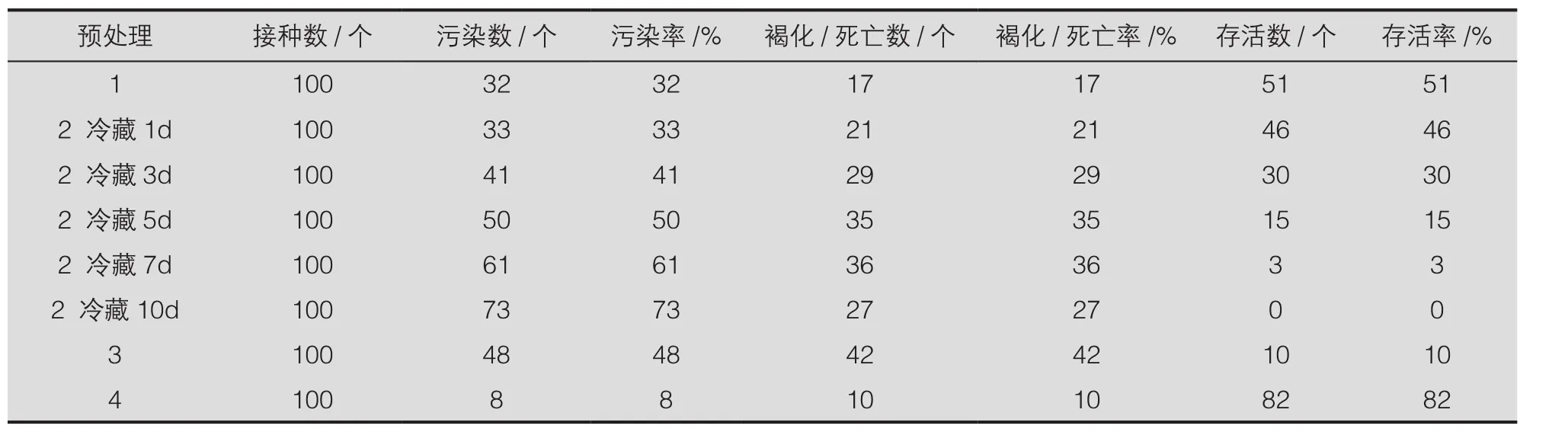
表1 不同预处理方式对外植体存活的影响

表2 不同取材时间对外植体存活的影响

图1 优株枝Ⅱ冷藏5 d

图2 优株枝Ⅲ冷藏5 d
2.3 取材部位对外植体存活的影响
表3表明,云南樱桃优株Ⅱ号外植体接种效果最好(图3),存活率高达65%,污染率和褐化/死亡率均最低。Ⅰ号外植体效果其次,Ⅲ号外植体效果最差(图4)。三者之间污染率相差不大,Ⅲ号外植体褐化/死亡率远高于Ⅰ号和Ⅱ号外植体,由于Ⅲ号外植体木质化程度较高,茎段不及Ⅱ号外植体充实,易被消毒剂渗透。Ⅰ号外植体幼嫩,对消毒剂承受力不及Ⅱ号外植体。综上,云南樱桃优株最佳的取材部位为Ⅱ号(即顶芽下第4~5个茎节)。
2.4 消毒方法对外植体存活的影响
植物各部分的表面带着的各种微生物可以通过消毒剂进行表面消毒,云南樱桃优株内生菌较多,单独使用一种消毒剂效果不理想。
表4结果显示,云南樱桃优株的最佳消毒组合是处理d—1%新洁尔灭5 min+0.1%升汞2~8 min(依据茎段幼嫩程度而定),此消毒处理外植体存活率最高,可达59%,褐化/死亡率最低。处理e效果其次,存活率为48%。处理b和c外植体诱导效果差别不大,处理c较处理b多了酒精30 s处理,外植体的污染率降低了9%,但褐化/死亡率却提高了10%,可能酒精不适合作为云南樱桃优株消毒剂,或者酒精使用时间过长。单独使用次氯酸钠的脱毒效果最差,污染率高达60%,存活率仅为16%。综上,云南樱桃优株嫩枝的表面消毒最佳处理为处理d—1%新洁尔灭5 min+0.1%升汞2~8 min(依据茎段幼嫩程度而定)。

表3 不同取材部位对外植体存活的影响

表4 不同消毒方法对外植体存活的影响

图3 嫁接萌枝Ⅱ

图4 嫁接萌枝Ⅲ
3 结论与讨论
无菌系的建立是云南樱桃优良单株组培快繁关键技术之一。本研究表明:1)外植体宜随采随处理,且枝条带叶冷藏时间不宜超过5 d,随着枝条冷藏时间延长,托叶脱落现象加重,增加了消毒剂对外植体的损害,外植体存活率与冷藏时间成反比。2)已有的樱花组织培养研究中,外植体灭菌的存活率一般在45%~70%[8~10]。本试验中,将云南樱桃优株的野外枝条嫁接到砧木上于温室内养护管理,再取其萌枝作为外植体,可有效降低其污染率,外植体存活率可达82%,对于野外材料,条件允许情况下,可以先在温室嫁接。3)外植体最佳采集时间为春季3—4月,外植体带菌情况、引起褐变的物质的量因生长季节不同而有所差异,在适宜的季节采集合适的外植体,可以有效减少污染、褐化的发生[11]。4)最佳的取材部位为顶芽下第4~5个茎节,配合表面消毒方法即1%新洁尔灭5 min+0.1%升汞溶液2~8 min,外植体存活率可达65%,75%酒精对外植体进行消毒可降低污染率,但对外植体伤害较大,褐化/死亡率提高,这与王红梅等[8]对垂枝樱外植体灭菌的研究结果一致。
本研究通过对外植体进行预处理,选择合适的取材时间、取材部位和消毒方式等方法,能够有效降低污染率和褐化死亡率,提高外植体存活率,可高效快速建立云南樱桃优株的无菌系,有利于快速开展其组培快繁技术后续研究,同时可为其他樱花品种的组培快繁技术研究提供参考和借鉴。
该云南樱桃优株树形优美、花色鲜艳、花量大、耐热性好、抗逆性强,是非常适合华南地区种植的新优樱花观赏品种。目前已在广东、广西等省份大量应用推广,生长及开花表现良好,深受人们喜爱(图5~6)。组培快繁技术相关研究为其工厂化育苗及快速推广提供了有力保障。

图5 广州琶洲开花效果

图6 广州番禺宝墨园开花效果
