视网膜色素上皮细胞表达IL-1β和IL-6与细胞自噬的关系
2019-03-12罗永锋
罗永锋,李 蓉,王 强,姚 杨
作者单位:1(467100)中国河南省郏县光明眼科医院;(710077)中国陕西省西安市,西安医学院第一附属医院 2眼科;3感染控制科;4中心实验室
0 引言
细胞自噬是一种普遍存在于真核生物中的溶酶体降解途径,能对损伤的细胞器和毒性蛋白聚合物等细胞内产物进行包裹、消化、降解和再利用,以满足细胞自身的代谢需要以及细胞器的更新[1-2]。自噬在衰老、肿瘤、炎症、神经退行性疾病中起重要作用,故已成为目前生物学领域的研究热点。炎症反应的发生在很大程度上与细胞自噬存在密切关联,其机制涵盖多个方面,并且在眼科疾病中可能发挥重要作用[3]。
视网膜色素上皮(retinal pigment epithelium,RPE)是一种具有多种复杂生理生化功能的色素细胞,分泌的多种生长因子可影响神经视网膜细胞及其自身的生理特性,也与眼部疾病的发生密切相关[4]。在正常生理条件下,炎性细胞因子主要由单核巨噬细胞产生,病理条件下神经胶质细胞、RPE细胞等也可分泌[5]。炎性因子 IL-1β和 IL-6具有多种生物功能活性,与机体免疫、各种器官的生理功能有关,目前对于RPE细胞表达IL-1β和IL-6与细胞自噬的关系尚不清楚。LC3、Beclin-1和p62等是参与自噬体或自噬溶酶体形成的关键蛋白,近年来作为自噬标记物被广泛用于相关研究中[6-7]。3-甲基腺嘌呤(3-MA)和氯喹(CQ)是两种应用广泛的自噬抑制剂,分别作用于自噬的早期和晚期阶段。基于此,本研究观察细胞自噬在缺氧条件下RPE细胞表达IL-1β和IL-6中的作用。
1 对象和方法
1.1 对象 ARPE-19细胞系(武汉普诺赛生命科技有限公司);DMEM/F12培养基(美国Gibco公司);3-MA(美国Selleck公司);CQ(美国Sigma公司);兔抗人LC3B多克隆抗体(美国CST公司);兔抗人Beclin-1多克隆抗体(美国CST公司);兔抗人p62多克隆抗体(美国CST公司);兔抗人GAPDH多克隆抗体(杭州贤至生物有限公司);HRP标记羊抗兔二抗(武汉博士德生物工程有限公司);人IL-1β和IL-6 ELISA试剂盒(欣博盛生物科技有限公司)。三气培养箱(上海力申科学仪器有限公司,HF-100型);倒置相差显微镜(日本Olympus公司,IX51型);全自动酶标仪(美国Thermo scientific公司,Multiskan MK3型)。
1.2 方法
1.2.1 细胞培养及分组 用不含EDTA的0.25%胰酶消化ARPE-19细胞,用含10%FBS+1%青霉素和链霉素的DMEM/F12培养基终止消化,轻轻吹打混匀成单细胞悬液,传代至培养皿中,在37℃、5%CO2及饱和湿度条件下培养。取对数生长期、生长状态良好的细胞(5~10代)接种于6孔板,每孔5×105个细胞。待细胞贴壁后将细胞分为缺氧组、3-MA+缺氧组、CQ+缺氧组、正常对照组,其中缺氧组细胞置于 O2∶CO2∶N2体积比为 1∶5∶94 的培养箱中培养24h;3-MA+缺氧组细胞先用10mmol/L 3-MA预处理2h,然后处理方法同缺氧组;CQ+缺氧组细胞先用50μmol/L CQ预处理2h,然后处理方法同缺氧组。对照组细胞在正常氧条件下培养。
1.2.2 ELISA 所有分组的细胞因子均采用酶联免疫吸附剂测定分析方法(ELISA)进行检测,具体参照说明书进行操作。分别设空白孔、标准孔、待测样品孔。空白孔加标准品和样品稀释液100μL,余孔分别加标准品或待测样品100μL。酶标板覆膜,36℃孵育90min。充分洗板后空白孔加入生物素化抗体稀释液,其余孔中加入生物素化抗体工作液100μL,覆膜后36℃温育1h。充分洗板后向空白孔加入酶结合稀释液,其余孔加酶结合物工作液100μL,覆膜后36℃温育30min。洗板后每孔加显色剂(TMB)100μL,酶标板加上覆膜在37℃避光孵育15min,每孔加终止液100μL,终止反应,用酶标仪在450nm波长测量各孔的光密度(OD值)。
1.2.3 Western blot 细胞处理完成之后,弃培养液,预冷PBS漂洗3次,加400μL含PMSF的裂解液使细胞充分裂解,离心提取细胞总蛋白,通过BCA法测定蛋白浓度。30%丙烯酰胺SDS-PAGE凝胶电泳后将蛋白转至PVDF膜,5%脱脂奶粉封闭液常温封闭2h;一抗孵育:将膜分别放入稀释好的抗体 LC3B(1∶1000)、Beclin-1(1∶1000)、p62(1∶1000)及 GADPH(1∶1000)中,4℃摇床过夜。用TBST洗膜3次,每次10min;二抗孵育:将膜放入用稀释液稀释好的HRP标记的二抗(1∶50000)中避光常温孵育1~2h。用TBST洗膜3次,每次10min;ECL显色曝光,扫描胶片后使用BandScan系统软件分析蛋白条带。将目的蛋白LC3B、Beclin-1和p62与内参GAPDH灰度的比值作为目的蛋白的相对表达量。实验均在不同时间3次生物学重复。
统计学分析:采用统计软件SPSS20.0对数据进行处理及分析,计量资料以均数±标准差(珋x±s)表示,计量资料均符合正态分布,方差齐,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 ARPE-19细胞形态 培养24h在倒置显微镜下观察,ARPE-19细胞形态呈现扁圆形、梭形、多角形或者不规则形,贴壁良好,胞浆内未见明显黑色素颗粒。不同组之间的细胞形态未见明显差异,见图1。
2.2 各组RPE细胞表达IL-1β及IL-6的浓度比较 IL-1β和IL-6浓度的标准曲线(图2)及相应的浓度方程为:y=(-0.2463+311.0454x)/(1+0.1937x-0.1366x2),y=(0.9089+117.3496x)/(1-0.4715x+0.0727x2),获得各组细胞上清液中IL-1β和IL-6的浓度。ELISA结果显示培养的细胞在未受到刺激的情况下仅仅产生少量的IL-1β和IL-6。缺氧刺激之后,上清液中IL-1β和IL-6的产量迅速增加,3-MA或CQ可以明显抑制IL-1β和IL-6的产生(图3)。缺氧组、3-MA+缺氧组、CQ+缺氧组及对照组细胞的 IL-1β 浓度分别为 195.01±5.62、167.80±3.15、131.78±5.38、98.37±5.49pg/mL,总体比较差异有统计学意义(F=211.89,P<0.01)。两两比较发现,缺氧组的IL-1β浓度明显高于对照组、3-MA+缺氧组和 CQ+缺氧组,差异均有统计学意义(P<0.01)。缺氧组、3-MA+缺氧组、CQ+缺氧组及对照组细胞的IL-6浓度分别为252.32±12.48、165.45±10.13、90.07±5.37 和 53.13±2.60pg/mL,总体比较差异有统计学意义(F=317.15,P<0.01)。两两比较发现,缺氧组的IL-6浓度明显高于对照组、3-MA+缺氧组和CQ+缺氧组,差异均有统计学意义(P<0.01),见图3。

图1 倒置显微镜下观察ARPE-19细胞形态(×100) A:对照组;B:缺氧组;C:3-MA+缺氧组;D:CQ+缺氧组。

图2 IL-1β及 IL-6的浓度标准曲线 A:IL-1β;B:IL-6。

图3 ELISA检测 IL-1β及IL-6浓度的统计柱状图 A:IL-1β;B:IL-6。bP<0.01 vs缺氧组。

图4 Western blot检测各组细胞LC3B、Beclin-1和 p62的蛋白条带图。
2.3 各组RPE细胞自噬水平的比较 Western blot实验结果显示,与对照组比较,缺氧组细胞自噬激活,表现为LC3B-Ⅱ/Ⅰ比值、Beclin-1这两种蛋白条带增强和 p62蛋条带减弱。与缺氧组比较,当采用自噬抑制剂3-MA预处理细胞,LC3-Ⅱ/Ⅰ及Beclin-1的表达则明显降低,p62的表达明显升高;采用自噬抑制剂 CQ预处理细胞,Beclin-1的表达明显降低,LC3-Ⅱ/Ⅰ及p62的表达明显升高,见图4。缺氧组、3-MA+缺氧组、CQ+缺氧组及对照组细胞中的LC3B-Ⅱ/Ⅰ、Beclin-1及p62的相对蛋白表达量分别为(0.50±0.05、0.34±0.01、0.67±0.05 和 0.24±0.02)、(0.97±0.05、0.78±0.06、0.54±0.01 和 0.32±0.03)和(0.32±0.10、0.78±0.08、0.96±0.02 和 1.03±0.02)。组间总体比较差异均有统计学意义(LC3B-Ⅱ/Ⅰ:F=80.65,P<0.01;Beclin-1:F=139.29,P<0.01;p62:F=70.64,P<0.01)。之后两两比较发现,缺氧组细胞中LC3B-Ⅱ/Ⅰ和Beclin-1的相对蛋白表达量均明显高于对照组和3-MA+缺氧组,缺氧组中LC3B-Ⅱ/Ⅰ的相对蛋白表达量低于CQ+缺氧组,差异均有统计学意义(P<0.01)。缺氧组细胞中p62相对蛋白表达量明显低于对照组、3-MA+缺氧组和CQ+缺氧组,差异均有统计学意义(P<0.01),见图5。
3 讨论
RPE细胞是一种具有多种复杂生理生化功能的色素细胞,在眼的发育和视觉功能中起着非常重要的作用[8]。在疾病状态下,视网膜细胞的结构和功能会发生改变,其中RPE细胞是病变的中心环节,其结构或功能异常会导致视网膜感光细胞功能受损、视网膜退化等疾病的发生。研究证实,RPE细胞是参与增生性玻璃体视网膜病变、年龄相关性黄斑变性及糖尿病视网膜病变等的主要细胞,它分泌的IL-1β、IL-6等炎性因子在趋化细胞移动、启动细胞增生、分泌胶原和纤维血管膜形成中可能发挥重要作用[9-12]。RPE 受刺激后能分泌 IL-4、IL-6、IL-8、IL-10、干扰素-γ和单核细胞趋化蛋白-1等多种炎性细胞因子[13]。上述眼底疾病的发生与缺氧、慢性炎症密切相关。本研究以ARPE-19细胞(广泛用于眼底疾病研究的一种细胞模型)为研究对象,也发现在缺氧刺激条件下,RPE细胞分泌IL-1β、IL-6的水平升高,与上述文献报道的结果相符。
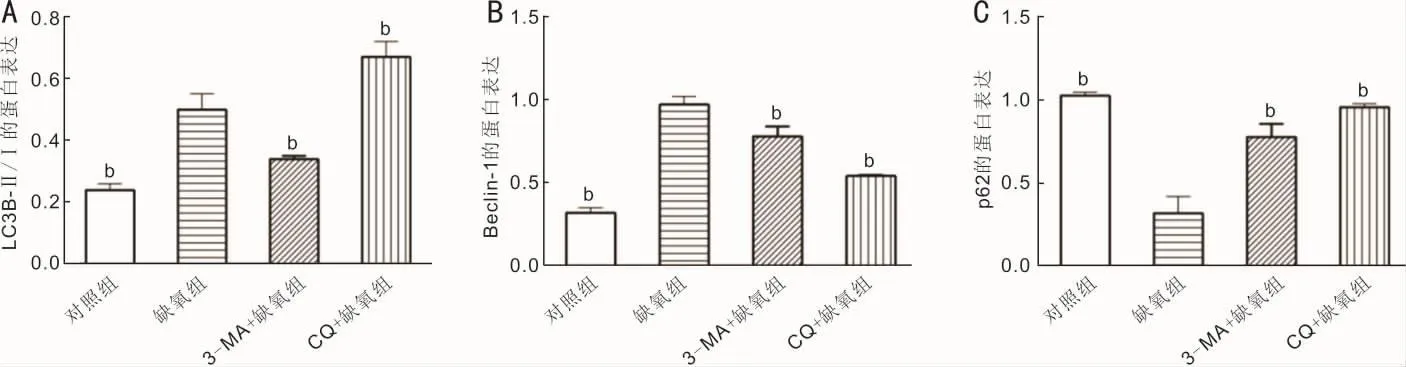
图5 各组细胞LC3B-Ⅱ/Ⅰ、Beclin-1和p62蛋白相对表达量的统计柱状图 A:LC3B-Ⅱ/Ⅰ蛋白;B:Beclin-1蛋白;C:p62蛋白。bP<0.01 vs缺氧组。
作为普遍存在于真核生物细胞内的一种机制,细胞自噬能对内环境稳定进行自我维持,且在生长、发育等多种生理活动中发挥重要作用,多种代谢应激可诱导自噬激活[1]。作为自噬标记蛋白,LC3、Beclin-1 和 p62 等被广泛用于自噬的研究中。LC3是自噬相关蛋白ATG8在哺乳动物的类似物,参与前体膜的延长和闭合,也参与自噬体的形成,故ATG8/LC3是自噬的重要分子标记物[14]。LC3在其C末端被ATG4剪切,形成LC3-Ⅰ。LC3-Ⅰ通过ATG7和ATG3与磷脂酰乙醇胺相结合形成酯化产物LC3-Ⅱ,特异性结合于自噬体膜上。LC3-Ⅱ始终稳定地保留在自噬体膜上直到与溶酶体融合。Beclin-1是自噬相关蛋白ATG6在哺乳动物的类似物,是其他自噬蛋白基因参与自噬形成过程的必须成分[15],当自噬被抑制时,Beclin-1的表达降低。p62/SQSTM1蛋白是一种同LC3相互作用的蛋白,对降解底物的识别和包裹起着关键作用,p62的蛋白表达越低,说明底物降解越少,则自噬活性越强,即p62的水平与自噬活性呈负相关[16]。由于LC3抗体对LC3-Ⅱ具有更高的亲和力,会造成假阳性结果,因此判断自噬活性的强弱还需同时考虑溶酶体活性的影响。在研究中需要结合LC3-Ⅱ及p62的蛋白表达综合判断自噬活性的强弱。本研究发现在缺氧条件下,RPE细胞的LC3B-Ⅱ/Ⅰ(LC3B是LC3的主要亚型)、Beclin-1蛋白表达增加及p62蛋白表达下降,证实缺氧诱导了RPE细胞的自噬激活。
众所周知,视网膜对缺氧及继发的氧化应激高度敏感,故各种缺血性视网膜疾病,如糖尿病视网膜病变、视网膜静脉阻塞等都与缺氧密切相关。因此,本研究将缺氧作为刺激条件,观察RPE细胞功能与其自噬水平的关系。鉴于不同自噬抑制剂的作用机制存在差异,在本研究中我们采用了两种自噬抑制剂对RPE细胞进行了干预,以避免使用某一种抑制剂可能带来的结果偏差。其中,3-MA是一种应用广泛的自噬抑制剂,它作用于自噬诱导阶段,特异性阻断自噬体的形成[17],故作用后 LC3-Ⅱ/Ⅰ及Beclin-1的表达降低,p62的表达升高(不能被降解);CQ是一种溶酶体自噬抑制剂,可以阻止晚期阶段自噬体与溶酶体的结合,抑制自噬的降解,使得自噬体在细胞内增加,作用后会使LC3-Ⅰ向LC3-Ⅱ的转换增加更为明显[18],故作用后LC3-Ⅱ/Ⅰ及p62的表达升高,而Beclin-1的表达降低(自噬过程被抑制)。10mmol/L是用3-MA处理ARPE-19 细胞的常用浓度[19-20],故本研究也采用了这一浓度。此外,有研究发现,10~30μg/mL CQ不会影响细胞活力和代谢,且10~20μg/mL的浓度对细胞活力的影响无明显差异[21]。另一研究提示,10μmol/L CQ 作用于ARPE-19细胞24h不会导致细胞死亡,而在250μmol/L时几乎100%的细胞死亡,预测LD50介于100~120μmol/L之间[22]。因此,本研究选择 50μmol/L(即 16μg/mL)浓度的CQ来抑制自噬也是合理的。本研究发现缺氧刺激可促进RPE细胞表达IL-1β、IL-6,3-MA或 CQ处理后减少了二者的表达。3-MA和CQ预处理得到的结果一致,证明抑制自噬能减少RPE细胞表达IL-1β和IL-6。
IL-1β是IL-1家族成员之一,是细胞间信号传递的基本的介质,具有多种生物功能活性,例如促进成纤维细胞增生、透明质酸酶和前胶原的合成等[5,23]。IL-6是一种单链糖蛋白,是与机体免疫、各种器官生理功能有关的多向性细胞因子,调节细胞生长、分化、凋亡、转化及免疫反应[24-25]。目前,越来越多的研究认为自噬与机体免疫和炎症有着密切的关系,但在眼科的相关研究较少[3,26]。因此,本研究观察了不同刺激条件下RPE细胞分泌IL-1β和IL-6的情况及其与细胞自噬的联系。结果表明,在缺氧刺激条件下 RPE细胞自噬激活,表现为LC3B-Ⅱ/Ⅰ、Beclin-1 表达增强,p62 表达减弱,同时细胞分泌IL-1β和IL-6的水平升高,且采用自噬抑制剂3-MA和 CQ能够减少 IL-1β和 IL-6的表达。鉴于IL-1β和 IL-6在纤维增生等病理过程中起重要作用[27-28],我们推测缺氧诱导自噬激活并促进 RPE细胞分泌IL-1β和IL-6,可能是这些炎性因子参与多种眼底疾病病理过程的重要机制。不过,自噬对RPE细胞分泌IL-1β和IL-6的具体调控机制,以及对纤维增生性眼病的确切影响还需进一步研究。
