氮浓度对铜绿微囊藻、大型溞和金鱼藻三者相互作用的影响
2019-03-11姜小玉赵闪闪褚一凡李杲光靳同霞马剑敏
姜小玉 赵闪闪 褚一凡 陈 艳 李杲光 靳同霞 马剑敏
(河南师范大学生命科学学院, 新乡 453007)
水体富营养化已成为世界上大多数淡水和近海海洋生态系统的主要水质问题[1], 并导致蓝藻水华频发。研究表明[2], 生态修复是有效控制水华的最佳途径。生态修复方法中利用水生植物[3]和生物操纵[4]技术控制藻类水华取得了明显成效。
大型水生植物与浮游植物同为水生生态系统的初级生产者, 两者生态位高度重合, 对光照、空间、营养等资源竞争激烈[5]。大型水生植物还能通过化感作用抑制藻类的生长[6]。姚远等[7]通过微宇宙实验发现水体中的沉水植物能使浮游植物的生物量显著降低。生物操纵是利用浮游动物的摄食控制藻类。陈济丁等[8]发现, 可以直接添加大型溞等大型植食性浮游动物, 使其达到并保持一定的密度, 从而有效抑制藻类的暴发式增殖。
氮磷浓度直接影响重建水生植被的可能性和生物操纵的有效性。根据Liebig[9]最小因子定律,对限制浮游植物增长的氮磷等营养盐加以控制是减轻水体富营养化的重要基础[10]。研究发现, 内陆水体(湖泊等)一般是磷限制[11]; 外源水体(海湾等)通常是氮限制[12, 13]。限制因子会因周围环境和人类干预而发生转换, 还存在共同限制的情况[14—16]。当氮磷共同限制或限制性因素不确定时, 单一减少氮或磷输入并不能有效防治水体富营养化现象[17]。美国中西部因种植玉米引发过高的氮浓度排入水体, 导致藻类水华大面积暴发, 渔业损失惨重[18],另考虑到海湾和湖泊、河流之间可能存在的相互影响, 所以即使我国富营养化湖泊主要以磷为限制因子[11], 也必须采取以控磷为主, 控氮为辅的措施以减缓富营养化现象, 不可过度放宽对氮的控制[19, 20]。
本实验室先前做了一系列氮磷浓度影响溞-草-藻控藻效果的研究[21—23], 结果发现水生植被的恢复重建与生物操纵相结合可以取得极佳抑藻(蓝藻)效果的磷浓度范围为0.2—0.5 mg/L, 但其氮浓度阈值范围仍未可知。为了进一步弄清楚水体氮浓度对实施生物操纵和重建水生植物的影响, 本实验选用铜绿微囊藻、金鱼藻和大型溞为实验材料, 研究不同氮浓度对生物操纵和草-藻竞争的影响, 为蓝藻水华的防治提供依据与参考。
1 材料与方法
1.1 实验材料
铜绿微囊藻(Microcystis aeruginosa, FACHB 573): 购自中国科学院淡水藻种库, 采用BG-11培养基[24], 置于恒温光照培养箱(温度25℃, 光强2600 lx,光暗比14h∶10h)培养, 选择指数生长期的藻种用于实验。
大型溞(Daphnia magna): 采自新乡市牧野湖,纯化培养后, 置于恒温光照培养箱驯化, 选择同一母体繁殖三代以上的体型相似的幼龄大型溞用于实验。
金鱼藻(Ceratophyllum demersum): 采自新乡市牧野湖, 反复冲洗干净, 培养于BG-11培养基, 置于实验室靠窗实验台。选择生长良好、长势一致的0.1 g的顶枝用于实验。
1.2 实验方法
培养液的配置 以BG-11培养基为基础, 用柠檬酸铁代替柠檬酸铁铵, 用CoCl2·6H2O代替Co(NO3)2·6H2O, 配置无氮磷的培养液。因为适合铜绿微囊藻生长的最佳磷浓度范围为1.0—1.5 mg/L[25], 为保证磷源充足, 用磷标液(磷酸二氢钾)将培养液磷浓度调节为1.5 mg/L; 结合水华程度判别的氮、磷参考标准[26]和已有研究[25, 27], 用氮标液(硝酸钾)将培养液氮浓度梯度调节为0.5、2、4、8和16 mg/L, 包含从轻度到重度水华的范围。培养液初始pH为7.5, 均为无菌环境。
接种方法 实验前将藻种扩大培养7d, 在无N、P的BG-11培养液中饥饿处理48h, 以去除藻细胞中蓄积的N、P, 取一定量体积的藻种离心(4000 r/min, 10min)后, 弃上清液, 再用15 mg/L的NaHCO3洗涤2次, 离心弃上清液, 无菌水稀释后用于接种。
实验设置 实验采用1000 mL的锥形瓶, 装800 mL不同氮浓度的培养液, 每个氮浓度设3个重复, 置于恒温光照培养箱(温度25℃, 光强2600 lx,光暗比14h∶10h)培养, 每天定时摇晃每锥形瓶3次,实验周期15d。每3天取10 mL藻液, 测定藻液的OD680值, 计算藻细胞密度。实验结束后测定藻液的OD680值、大型溞数目和金鱼藻质量, 计算各自的增长率; 并测定培养液中的氮、磷浓度, 计算氮磷削减率。采用溞-草-藻搭配组合, 设置4个不同处理组合和1个空白对照。根据相关实验结果[22], 接种铜绿微囊藻初始密度为1.0×105cells/mL, 金鱼藻顶枝0.1 g, 大型溞5只。
具体组合方式如下:
组合 0: 铜绿微囊藻单独培养(空白对照);
组合 1: 溞-藻共培养;
组合 2: 草-藻共培养;
组合 3: 金鱼藻种植水培养铜绿微囊藻(用配置好的5种氮浓度梯度的培养液培养金鱼藻, 15d后,取出金鱼藻, 补充培养液氮磷至初始浓度, 然后接种铜绿微囊藻);
组合 4: 溞-草-藻共培养。
1.3 测定指标
铜绿微囊藻细胞密度: 实验前, 每2天测定藻液的OD680, 用血球计数板计数藻细胞, 为期14d, 创建OD680值与藻细胞密度回归方程:y=1522.2x-4.6892,R2=0.9984; 其中,y是藻细胞密度(×105cells/mL),x是OD680值。实验中, 每3天测定藻液的OD680值,换算得到藻细胞密度。
大型溞数目: 肉眼计数。
金鱼藻质量: 吸水纸吸干表面水分, 称重。
培养液中的氮、磷浓度(指水中的氮磷浓度,不包括生物体吸收、吸附的氮磷): 藻液经离心(4000 r/min, 10min)后, 取上清液, 采用过硫酸钾氧化紫外分光光度法测定氮浓度, 钼锑抗分光光度法测定磷浓度[28]。
1.4 数据处理
铜绿微囊藻生长速率:μ=(lnX2-lnX1)/(T2-T1)。式中,X1和X2分别为实验初期和结束后铜绿微囊藻的细胞密度; (T2-T1)为培养天数, 为15d。
采用Monod方程[29]探讨铜绿微囊藻单独培养实验中, 藻生长速率与氮浓度的关系, 方程如下:μ=μmax·x/(x+Ks)。式中,μmax为藻的最大生长速率;x为氮浓度;Ks为半饱和速率常数。
铜绿微囊藻、大型溞和金鱼藻的增长率计算方法见靳萍等[30]。
培养液中氮、磷削减率:R=(C0-Ct)/C0×100%。式中,C0和Ct分别为实验初期和结束后培养液中的氮磷浓度。
用EXCEL 2013处理数据并作图, 其中Monod方程拟合曲线用Origin 8.0制得, 用SPSS 19.0进行统计分析。
2 结果
2.1 铜绿微囊藻单独培养
如图 1所示, 氮浓度为16 mg/L时, 在培养周期内铜绿微囊藻生长曲线呈“J”型, 其他各浓度下则呈“S”型。实验末期, 氮浓度为4—8 mg/L时, 铜绿微囊藻生长速率减慢, 但藻细胞密度仍在3×107cells/mL以上; 氮浓度为0.5—2 mg/L时, 铜绿微囊藻细胞密度不再增加, 藻类无法持续增长。
如图 2所示, Monod方程对实验结果拟合度良好,R2=0.99699。由拟合方程可知, 磷浓度为1.5 mg/L, 氮浓度为0.5—16 mg/L时, 铜绿微囊藻最大表观生长速率为2.15/d, 氮的半饱和浓度为1.97 mg/L。故当培养液中磷浓度较高时, 应将氮浓度降低到1.97 mg/L以下, 以控制藻类短期内暴发性增殖, 与生长曲线所得结果一致。
2.2 溞-藻共培养
在溞-藻共培养时, 铜绿微囊藻的生长曲线如图 3所示, 与对照组(图 1)相比, 各氮浓度处理组铜绿微囊藻的细胞密度较低, 表明在大型溞的摄食下,微囊藻的密度增长均受到了抑制。氮浓度为8—16 mg/L时, 铜绿微囊藻的增长率远大于大型溞(图4), 呈现暴发式增长, 实验末期藻细胞密度在1.5×107cells/mL以上, 且持续增加(图 3), 培养液呈蓝绿色, 抑藻效果差。氮浓度为0.5—4 mg/L时, 铜绿微囊藻的增长率显著低于其他氮浓度处理组(P<0.05), 大型溞的增长率则与之相反(P<0.05)(图4), 实验末期, 铜绿微囊藻生长速率减慢, 藻细胞密度不再上升(图 3), 培养液较清澈, 抑藻效果好。故利用大型溞控制铜绿微囊藻的有效氮浓度范围为0.5—4 mg/L。
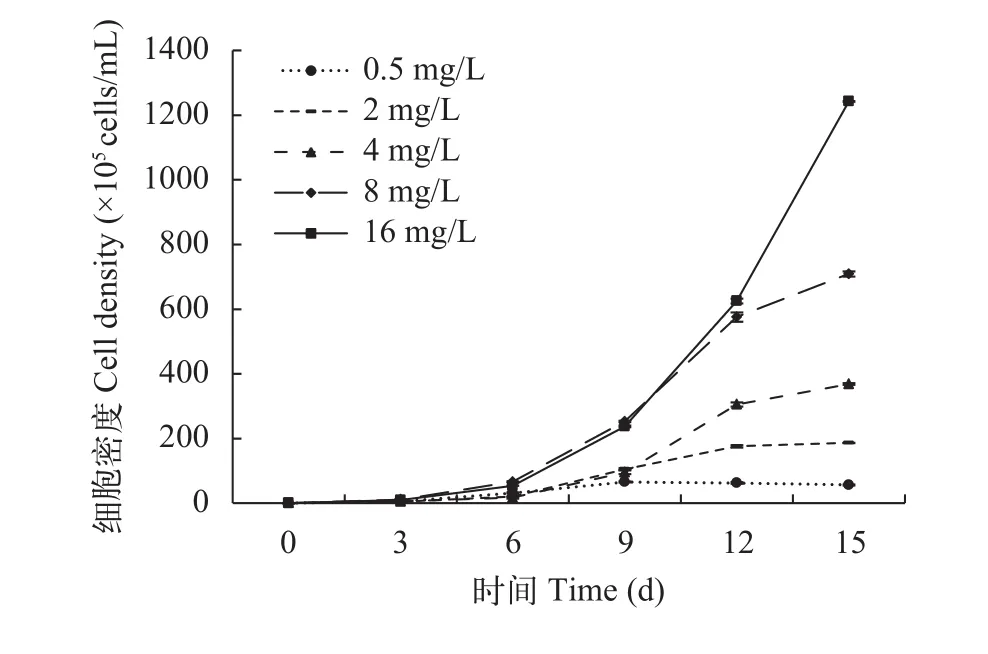
图 1 铜绿微囊藻单独培养时的生长曲线Fig. 1 Growth curve of M. aeruginosa when cultured individually
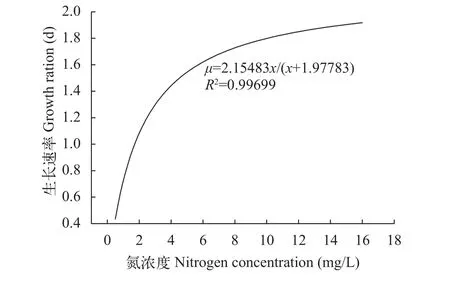
图 2 铜绿微囊藻生长速率与氮浓度的关系Fig. 2 The relationship of growth rate and nitrogen concentration for M. aeruginosa
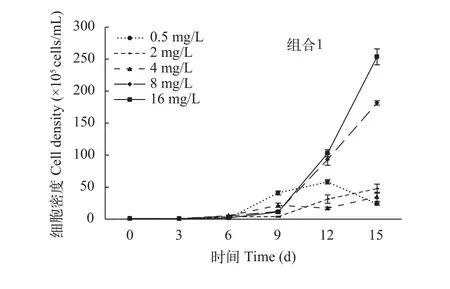
图 3 与大型溞共培养时, 铜绿微囊藻的生长曲线Fig. 3 Growth curve of M. aeruginosa when co-cultured with D.magna
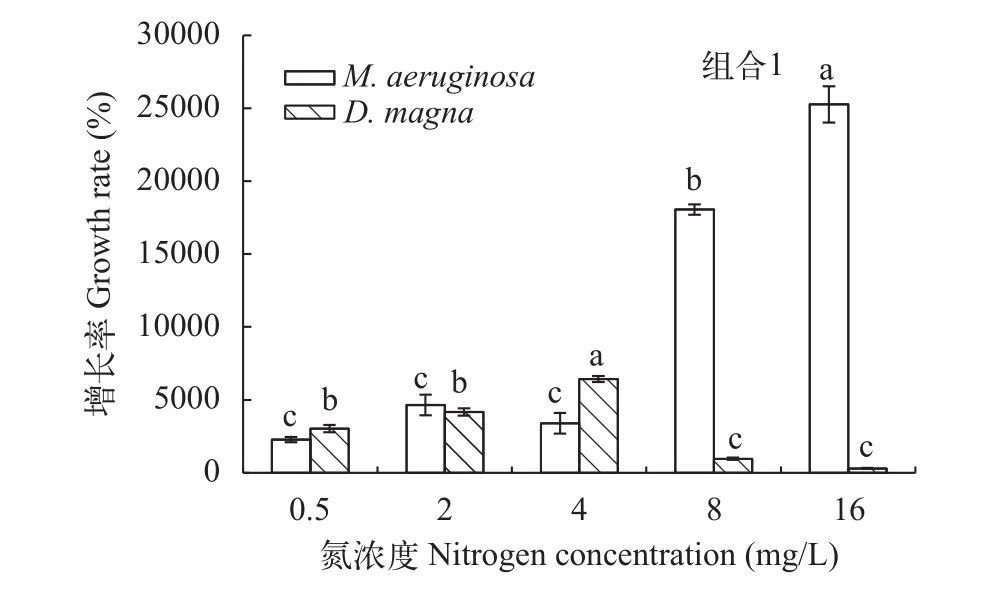
图 4 实验末期, 大型溞和铜绿微囊藻的增长率Fig. 4 Growth rate of M. aeruginosa and D. magna at the end of the experiment
2.3 铜绿微囊藻和金鱼藻的相互作用
在草-藻相互作用时, 铜绿微囊藻的生长曲线如图 5所示, 不论是草-藻共培养, 还是用草的种植水培养铜绿微囊藻, 与对照组相比, 各氮浓度处理组铜绿微囊藻的细胞密度均较低, 表明金鱼藻或金鱼藻种植水的加入可以抑制微囊藻的增长。
在草-藻共培养, 氮浓度为4—16 mg/L时, 铜绿微囊藻的增长率随氮浓度的增大而增大, 金鱼藻的增长率则随之减小(图 6, 组合2), 且高氮浓度(8—16 mg/L)处理组藻细胞密度持续增加(图 5, 组合2),抑藻效果差。在氮浓度为0.5—2 mg/L时, 铜绿微囊藻的增长率显著低于高氮浓度处理组(P<0.05), 金鱼藻的增长率显著高于高氮浓度处理组(P<0.05)(图 6, 组合2), 实验末期, 藻细胞密度开始下降(图 5,组合2), 培养液较清澈, 抑藻效果显著。实验末期,氮浓度为0.5和2 mg/L时, 草-藻共培养的藻细胞密度分别是溞-藻共培养的23.89%和21.51%, 表明处于有效控藻的氮浓度范围, 草-藻竞争的控藻效果好于溞-藻共培养。
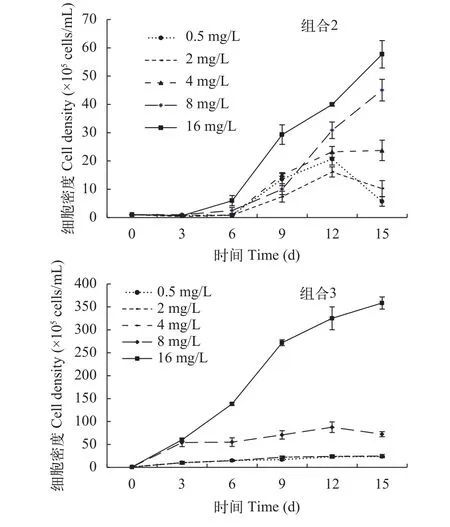
图 5 与金鱼藻相互作用时, 铜绿微囊藻的生长曲线Fig. 5 Growth curve of M. aeruginosa when co-cultured with C.demersum
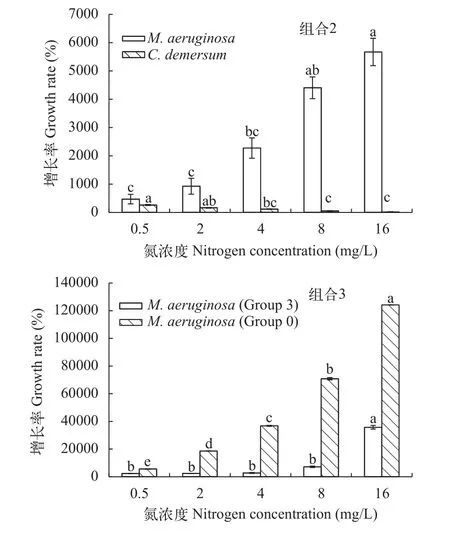
图 6 实验末期, 金鱼藻和铜绿微囊藻的增长率Fig. 6 Growth rate of C. demersum and M. aeruginosa at the end of the experiment
用草的种植水培养铜绿微囊藻时, 铜绿微囊藻的增长率随氮浓度的增大而增大(图 6, 组合3), 但远低于对照组。氮浓度为8—16 mg/L时, 实验末期藻细胞密度在7×106cells/mL以上, 控藻效果差; 氮浓度为0.5—4 mg/L时, 实验末期藻细胞密度不再增加(图 5, 组合3), 培养液较清澈, 抑藻效果较好, 氮浓度越低, 抑藻效果越好。实验末期, 氮浓度为0.5和2 mg/L时, 藻-草共培养的藻细胞密度分别是种植水培养方式下的23.89%和41.35%, 表明处于有效控藻的氮浓度范围, 草-藻竞争的控藻效果好于草的种植水。
2.4 溞-草-藻共培养
在溞-草-藻共培养时, 铜绿微囊藻的生长曲线如图 7所示, 与对照组相比, 各氮浓度处理组中铜绿微囊藻的细胞密度较低, 表明在大型溞和金鱼藻共同存在的情况下, 微囊藻的增殖均受到了抑制。铜绿微囊藻的增长率随氮浓度的增大而增大, 各氮浓度处理组, 铜绿微囊藻的增长率均小于大型溞, 控藻效果良好; 氮浓度为0.5—4 mg/L时, 大型溞、金鱼藻和铜绿微囊藻的增长率依次降低(P<0.05), 铜绿微囊藻的增长率均为负值(图 8), 实验末期, 藻细胞密度急剧下降至1.0×105cells/mL以下(图 7), 抑藻效果最佳。
2.5 不同组合培养液中的氮、磷削减率
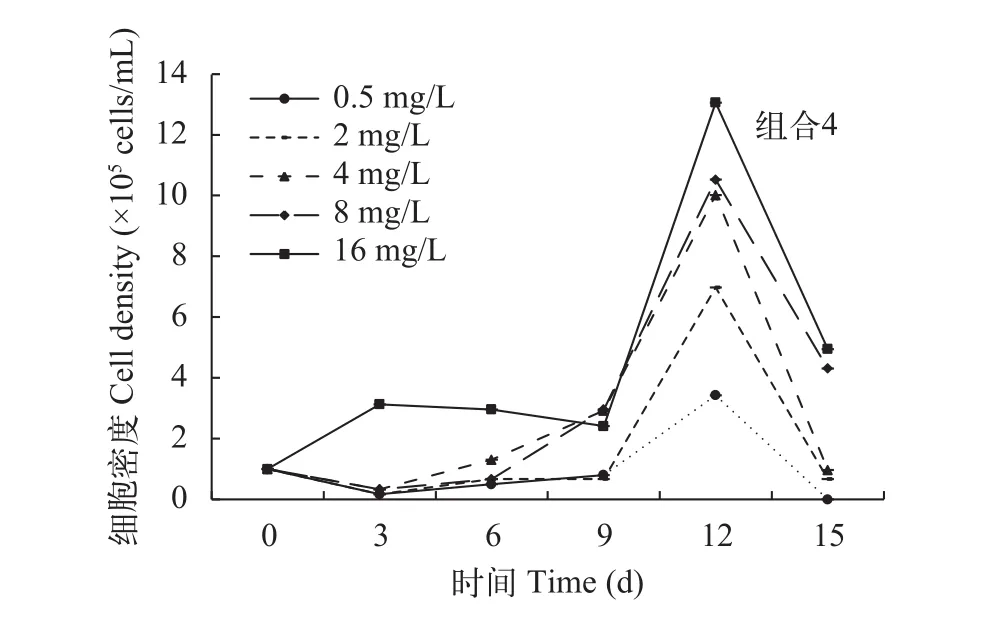
图 7 三者共培养时, 铜绿微囊藻的生长曲线Fig. 7 Growth curve of M. aeruginosa when three species were co-cultured together
如表 1和表 2所示, 氮浓度为16 mg/L时, 氮、磷营养盐充裕, 在各处理条件下氮磷削减率没有显著差异。铜绿微囊藻单独培养(组合0), 用金鱼藻种植水培养铜绿微囊藻(组合3)的氮、磷削减率低于其他实验组, 说明溞-藻, 草-藻和溞-草-藻的组合方式可以提高水中的氮磷削减率, 降低水中营养盐浓度。氮浓度为2—8 mg/L时, 草-藻(组合2)和溞-草-藻(组合4)共培养时, 对氮、磷的削减率最大, 说明氮和磷的削减率具有协同性, 且主要受水生植物的影响。
3 讨论
3.1 氮浓度对铜绿微囊藻生长的影响
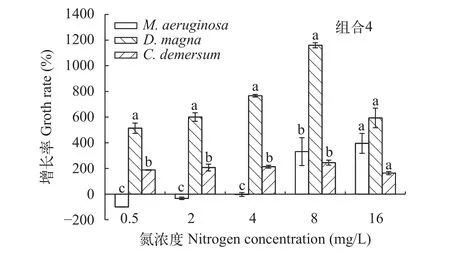
图 8 实验末期, 大型溞、金鱼藻和铜绿微囊藻的增长率Fig. 8 Growth rate of D. magna, C. demersum and M. aeruginosa at the end of the experiment
根据Redfield[31]值, 海洋浮游植物对碳、氮、磷的需求为C∶N∶P=106∶16∶1, 该比例被普遍应用于淡水浮游植物营养盐限制研究中; 当研究水体中的N∶P>20时, 常判定为磷限制; 当N∶P<10时, 常判定为氮限制; 在居于两者之间时, 则无法判定限制性因素[32]。在本实验中, 磷浓度设置为1.5 mg/L, 氮浓度梯度为0.5、2、4、8和16 mg/L, 对应N、P原子个数比分别是0.74、2.95、5.90、11.81和23.62。实验中, 铜绿微囊藻的增长率随氮浓度的升高而升高,表征为氮限制, 支持Redfield值的判定; 当氮磷营养过剩时, 藻细胞生理代谢所需营养物质的比例与水体内相应比例不相关, Redfield值不再适用[32]。当氮浓度进一步升高达到高氮浓度(8和16 mg/L), 随着氮浓度从不足到过量, 铜绿微囊藻生长速率趋于平缓(图 2), 氮限制作用越来越小, 验证了这一结果。
氮可以合成藻细胞的蛋白质、核酸、叶绿素等生物大分子, 影响着微藻的光合效率、光呼吸和暗反应的主要酶[33], 是限制浮游植物生长的重要因子之一[34]。研究发现, 以单一元素为限制底物时,氮浓度低于4 mg/L时, 铜绿微囊藻不能正常生长[25];也有学者提出应将氮浓度控制在1 mg/L以下, 可以有效降低水体浮游植物的繁殖[29]。本研究认为当培养液中磷浓度较高时, 将氮浓度降低到1.97 mg/L以下, 可以有效控制铜绿微囊藻的暴发性增殖, 该值处于前人研究区域之间, 结果更为精确。
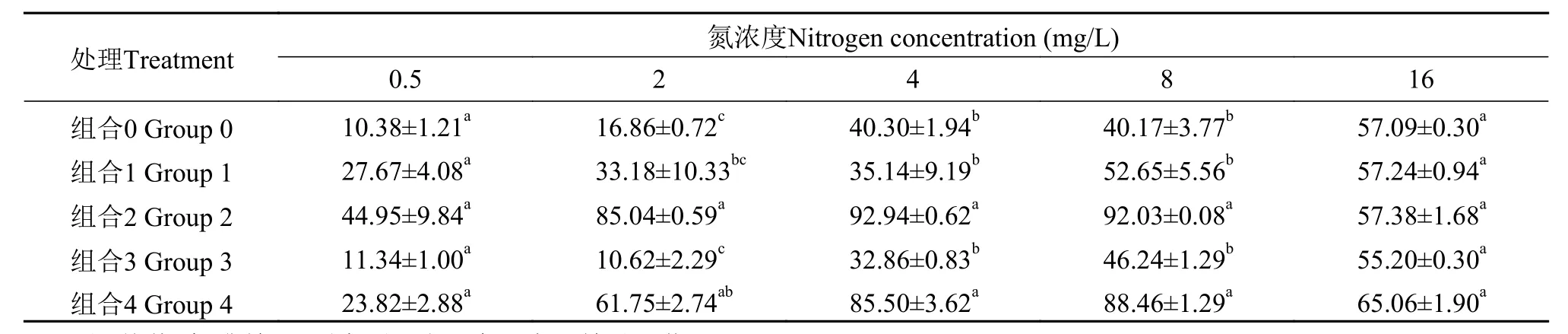
表 1 实验末期不同处理组的培养液中氮削减率分析Tab. 1 Nitrogen reduction rate (%) for different mediums from different treatment groups at the end of the experiment (%)
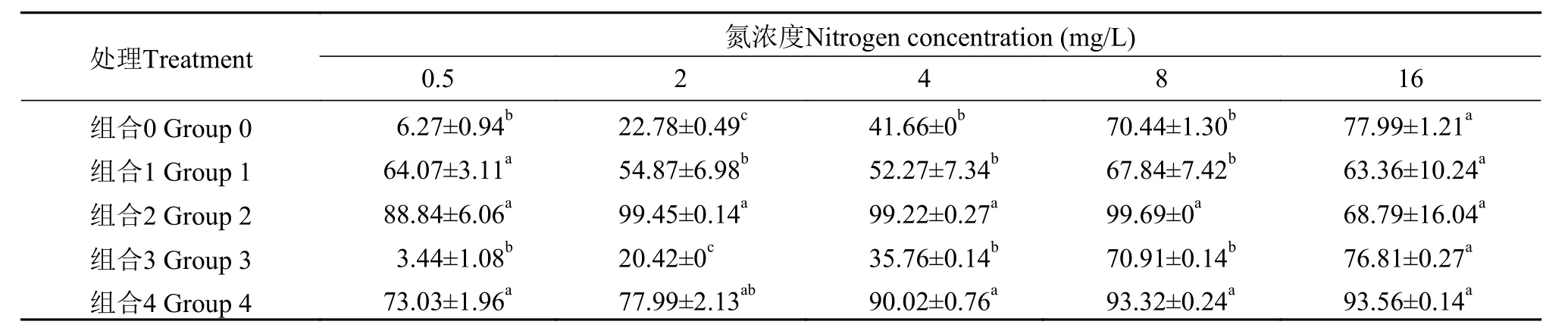
表 2 实验末期不同处理组的培养液中磷削减率分析Tab. 2 Phosphorus reduction rate (%) for different mediums from different treatment groups at the end of the experiment (%)
3.2 不同组合方式抑藻效果的差异
实验表明, 在大型溞、金鱼藻单独存在或二者同时存在的情况下, 都会抑制铜绿微囊藻的增长,培养液中氮、磷削减率均会提高。草-藻共培养的控藻效果比草的种植水更好。因为草-藻共培养时,金鱼藻会持续分泌活性物质[35], 而金鱼藻的种植水是一次添加而不是连续添加的, 随时间延长, 挥发油浓度降低, 抑藻效果减弱[36], 且前者还具有竞争作用。在同等氮浓度的实验条件下, 最终藻细胞密度对比为: 溞-藻>草-藻>溞-草-藻, 抑藻效果则为相反顺序; 需要说明的是, 对于溞-藻和草-藻组合二者的抑藻顺序, 这与用什么草、用什么藻有关, 但二者单独的抑藻能力一定小于溞-草-藻组合。大型溞主要通过摄食作用达到控制藻类增长的目的, 其作用效果的好坏由大型溞的牧食速度和藻的增长速度差决定; 金鱼藻主要依靠生存竞争和分泌化感物质(可破坏藻细胞的叶绿素a, 引起膜脂质过氧化,进而导致铜绿微囊藻死亡)而抑藻, 但是铜绿微囊藻也会对金鱼藻的生长起到一定的胁迫作用[37]。所以, 大型溞和金鱼藻的抑藻效果与它们各自的初始生物量密不可分。本实验室先前研究[22]表明, 最适宜大型溞繁殖的铜绿微囊藻细胞密度约为1.0×105cells/mL, 所以生物操纵初始生物量的选择是合适的, 同时辅以大型水生植物的重建(为浮游动物提供栖息地和氧气, 与藻类竞争营养、光照,分泌化感物质等), 两者同时控藻, 相辅相成, 构建健康的水生态系统, 可以将控藻效果发挥得更好。实验表明, 有金鱼藻存在的组合, 氮磷削减率显著高于其他实验组, 说明大型沉水植物有利于净化水中的氮磷污染, 减少浅水湖泊营养盐含量[38], 维持清水稳态[39]。藻细胞吸收吸附的氮磷、大型溞摄食藻细胞所固定的氮磷、以及大型沉水植物所吸收的氮磷均可以通过食物链流向更高营养级的生物。而生命周期较长的大型沉水植物和高营养级水生动物可以较长时间固定氮磷, 有效减少水中氮磷含量, 在一定程度上减少夏季高温时蓝藻水华暴发的机率。光照温度等气候条件不再适宜的时候,即使固定的氮磷被重新释放进入水体, 也不再会大面积暴发蓝藻水华。因此, 溞-草-藻系统对水中氮磷的削减也是反映系统净水能力的一项参考指标,对水体富营养化的治理具有一定的参考意义。
3.3 氮浓度对生物操纵和草-藻竞争的影响
在溞-藻共培养时, 实验条件下, 氮浓度为0.5—4 mg/L时, 大型溞增长率随氮浓度的升高而上升, 且显著高于其他氮浓度处理组, 铜绿微囊藻的增长率显著低于其他氮浓度处理组, 加上大型溞的迅速增殖对其摄食作用增强, 实验末期, 藻细胞密度不再增加, 说明大型溞可以有效控藻。氮浓度为0.5 mg/L时, 铜绿微囊藻的增长率最低, 且有大型溞的牧食压力, 藻细胞密度急剧下降。氮浓度为4 mg/L时, 大型溞的增长率最高, 这是因为在一定营养盐浓度下, 浮游动物的密度随总氮浓度的增加而增加[40]。但是, 在氮磷营养盐浓度过高时, 不利于生物操纵技术控藻, 在高氮浓度条件下, 由于营养盐充足, 生存条件合适, 铜绿微囊藻暴发性繁殖, 对大型溞增殖不利, 控藻效果差。本文设计溞-藻共培养, 旨在找出利用大型溞等浮游动物抑藻的有效氮浓度范围, 为实际水体水华的防治提供参考。在本实验条件下, 生物操纵的有效控藻氮浓度范围为低于4 mg/L, 在这个范围内, 可以通过直接向水体投加浮游动物或利用食物链关系控制并维持浮游动物的密度来达到控藻目的; 但当氮浓度超出4 mg/L时,生物操纵难以奏效。
在草-藻共培养时, 氮浓度为0.5—2 mg/L时, 金鱼藻增长率显著高于其他氮浓度处理组, 铜绿微囊藻的增长率显著低于其他氮浓度处理组, 金鱼藻在草-藻竞争中占优势。随着氮浓度进一步升高, 金鱼藻增长率随之下降, 甚至在高氮浓度组出现枝叶裂解现象, 其释放的营养会促进藻类生长。这是因为营养盐浓度过高时, 不利于金鱼藻的正常生理代谢, 使其抗逆性弱化[41]; 而高营养盐浓度却促进藻类生长, 对金鱼藻的生长起到一定的胁迫作用[37],使金鱼藻在与藻类竞争中处于劣势。
在溞-草-藻共培养时, 氮浓度为0.5—16 mg/L时, 铜绿微囊藻的增长率均小于大型溞, 因为金鱼藻和铜绿微囊藻的生长耗费很多氮磷等养分, 大型溞摄食铜绿微囊藻, 把营养转化为大型溞的生物量,减轻了高营养盐对金鱼藻的胁迫, 大型溞和金鱼藻共同抑藻, 效果显著。溞-草-藻三者结合有效控藻氮浓度范围的增大, 表征物种多样性和生物群落复杂性的加大, 有助于维持生态系统的稳定性, 加强生物操纵和草-藻竞争的抑藻效果。氮浓度为0.5—4 mg/L时, 大型溞的增长率最大, 铜绿微囊藻的增长率最小(均为负值), 铜绿微囊藻被显著抑制,大型溞和金鱼藻明显占优势, 控藻效果最好。这说明生物操纵和草-藻竞争的联合作用, 可以明显提高控藻效果。研究发现, 必须在实施生物操纵后恢复水生植被, 才能维持清洁型稳态水生态系统[42]。
上述结果是实验室条件下所得的氮浓度阈值,可以看成是理论值, 实际应用时, 该阈值应该会缩小, 尚需进一步验证。将研究结果应用于水体生态修复工程前, 建议首先了解水体营养盐浓度和水环境条件, 在营养盐条件不具备、或缺乏沉水植物的水域, 用单一的经典生物操纵技术来控藻, 难以达到长期的良好效果; 要尽量建立草-溞-藻共存的复杂生态系统, 以达到较好的控藻效果。
4 结论
生物操纵、草-藻竞争、以及溞-草-藻三者结合对藻类的抑制效果均与水体氮浓度有关; 在同一氮浓度条件下, 就抑藻效果来说, 溞-藻<草-藻<溞-草-藻。生物操纵有效控藻的氮浓度范围为0.5—4 mg/L; 草-藻竞争有效控藻的氮浓度为0.5—2 mg/L; 生物操纵和草-藻竞争相结合的有效控藻的氮浓度范围为0.5—16 mg/L, 氮浓度为0.5—4 mg/L时, 大型溞的增长率最大, 铜绿微囊藻的增长率最小(均为负值), 铜绿微囊藻被显著抑制。
