鄱阳湖子湖“堑秋湖”过程中水位变化对浮游动物群落结构的影响
2019-03-11胡旭仁刘观华金斌松秦海明
聂 雪 胡旭仁 刘观华 金斌松, 2, 秦海明, 2,
(1. 南昌大学生命科学研究院流域生态学研究所,南昌 330031; 2. 南昌大学江西省流域生态演变与生物多样性重点实验室南昌 330031; 3. 江西鄱阳湖湿地生态系统国家定位观测研究站,南昌 330038)
湖泊的水文过程, 如水位的时空变动、水流及水温分层等[1], 对湖泊生态系统的结构和功能具有重要影响, 其中水位波动会改变湖泊营养动态, 调节水生生物群落结构, 是影响湖泊生态系统状态变化的主要因素[2]。湖泊的水位变动具有明显的时空分布特征, 在不同的水文分区内, 水位变化具有明显差异。在自然条件相似的水域内, 水位变化具有一定的规律[3], 在受人工调控的湖泊和水库, 水位变化很大程度上受人为活动的控制[4, 5]。浮游动物在湖泊生态系统的初级生产力转化、信息传递和能量流动中发挥着重要作用[6, 7], 对于湖泊水生生态系统结构的稳定具有重要意义[8]。然而, 浮游动物的游泳能力很弱, 对水环境变化非常敏感, 水位、水温、水体营养等环境因子的变化都会对浮游动物的多样性、密度和分布产生直接或间接的影响[9]。近年来, 国际上陆续有研究关注水位变动对浮游动物多样性、分布和动态的影响, 但是研究大多聚焦于河口、水库或封闭湖泊[10—12]。
鄱阳湖是我国最大的淡水湖, 水位季节变化显著[13]。江西鄱阳湖国家级自然保护区(115°55′—116°03′E, 29°05′—29°15′N)位于鄱阳湖西北部赣江与修河交汇处。保护区管辖范围包括9个子湖[14],丰水期各个子湖与主湖连通, 水位变化特征与主湖保持一致, 枯水期子湖与主湖断开, 形成独立的浅水碟形湖, 水位变化取决于降水、蒸发、下渗以及人为活动[15]。当地渔民通过在子湖周边围筑矮堤,利用鄱阳湖水位的涨退规律进行鱼类捕捞的模式被称为“堑秋湖”[16, 17]。在“堑秋湖”捕鱼过程中子湖的水位通过人为控制闸门开闭排放, 每天的水位变化非常有规律, 到堑湖末期子湖的水位被放到非常低的水平, 仅湖心地势低平区域保留0.5 m左右的水面。在“堑秋湖”捕鱼过程中子湖水位的人为干扰, 不但对其中的鱼类产生了直接影响, 同时必然会对水情变化敏感的浮游动物产生直接影响。在“堑秋湖”过程中随着渔民控制水位排水捕鱼, 子湖中的水容量和鱼类都逐渐减少, 在这个过程中浮游动物的群落结构如何变化, 浮游动物的密度会上升、下降抑或是出现波动? 这种人为干扰的水位变动过程中浮游动物群落结构的变化特征目前仍不得而知。为了解“堑秋湖”过程中人为控制的水位变化是否对浮游动物群落产生了影响, 浮游动物群落随水位的下降发生何种显著变化, 此种变化是否有其他因素影响。本研究在“堑秋湖”捕鱼过程中连续8周, 对浮游动物群落结构特征进行了研究, 着重分析浮游动物群落随水位的变化特征, 并探讨影响浮游动物群落结构变化的环境因子, 以期为合理管控鄱阳湖区“堑秋湖”渔业活动提供科学依据。
1 材料与方法
1.1 研究地点
本研究选取江西鄱阳湖国家级自然保护区内的子湖——大湖池作为研究地点。大湖池属于保护区的核心子湖, 是典型的浅水碟形湖泊, 湖底平坦, 面积约为30 km2[18]。丰水期大湖池通过修河与鄱阳湖主湖连成一体, 枯水期11月前后, 鄱阳湖水位整体下降, 当地渔民控制闸门放水捕鱼, 到次年1月份湖水基本被放干, 放水后湖泊水面骤减, 水深只有0.3—0.5 m。
1.2 样品采集和处理
2014年11月9日至2015年1月4日, 在大湖池“堑秋湖”捕鱼过程中, 每隔1周采集浮游动物样品一次,采样8次。根据大湖池的形状, 在敞水区依次等距离设置7个采样点(S1—S7, 图 1)作为每次的采样重复, 在每个采样点采集表层下50 cm处的水样10 L,使用25#(孔径64 μm)浮游生物网过滤, 用50 mL的塑料瓶收集浮游动物样品, 现场用4%的福尔马林溶液固定保存, 带回实验室内在显微镜下进行物种鉴定。在采集样品的同时, 使用DZB-718便携式多参数水质分析仪测定各采样点的水温(WT)、pH、电导率(Cond)和溶解氧(DO), 使用SGZ-200BS浊度计测定浊度(Turb)。使用标杆尺测量各采样点的水深, 根据大湖池湖底高程换算水位。另外, 在每个采样点采集一瓶250 mL的水样带回实验室测定营养盐含量, 分别采用重铬酸钾消解分光光度法测定总氮含量, 钼酸铵分光光度法测定总磷含量, 纳氏试剂光度法测定氨氮, 紫外分光光度法测定硝氮。2014年12月1日因水样丢失, 未能测定营养盐含量。

图 1 鄱阳湖国家级自然保护区地理位置及大湖池浮游动物采样点示意图(水深分布图根据2016年10月水位绘制)Fig. 1 Sampling points of zooplankton in Poyang Lake National Nature Reserve
浮游动物鉴定到物种水平, 其中桡足类无节幼体数量较大, 未鉴定到物种水平, 在进行统计分析时, 记为1个物种。物种鉴定参考《中国动物志·淡水桡足类》(中国科学院动物研究所甲壳动物研究组, 1979)、《中国动物志·淡水枝角类》(蒋燮治和堵南山, 1979)、《中国淡水轮虫志》(王家楫,1961)、《中国淡水微型生物图谱》(周凤霞和陈剑虹, 2005)[19—22]。浮游动物的生物量采用体积法和体长-体重回归方程式进行估算, 无节幼体按每个为0.003 mg计算生物量[23]。
1.3 数据分析
浮游动物的优势度计算公式如下:

式中,Y表示物种优势度,ni为第i种的个体数,N为所有个体总数的和,fi为该种出现的频度, 当某一物种Y(优势度)≥0.02时, 可视为优势种类。
采用Shannon-Wiener多样性指数(H′)反映湖泊中浮游动物个体出现的紊乱和不确定性。Margalef指数(D)反映浮游动物的物种丰富度。Pielou’s均匀度指数(J)反映浮游动物的均匀度。计算公式分别如下:

式中,N为浮游动物总个体数;S为浮游动物总种数;Pi为第i物种的个体数与样品总个体数的比值(ni/N),ni为i物种的个体数[14]。
在Statistica7.0统计分析软件中对浮游动物密度、水深、水温数据进行了多项式拟合(Polynomial fitting), 分析其变化趋势。在Canoco for Windows 4.5统计分析软件中, 对浮游动物的物种做去趋势对应分析(Detrended correspondence analysis, DCA),发现最大梯度值(2.88)小于3。根据这一结果, 选择线性模型冗余分析(Redundancy analysis, RDA)来确定浮游动物和环境因子之间的关系。分析前对数据进行lg (x+1)转换, 使数据符合正态分布, 根据蒙特卡洛检验(Monte Carlo Test)的结果, 进行RDA排序图绘制时, 剔除了对浮游动物群落影响不显著的因子。
2 结果
2.1 理化因子及营养盐变化
研究期间大湖池的水位逐渐下降, 从第1次采样时的16.47 m降至最后1次采样时的15.18 m, 水位变幅1.29 m, 相邻两次采样间水位变化约0.16 m (图2a)。水温整体呈现下降趋势, 最高水温出现在2014年11月22日, 为13.74℃, 最低水温出现在2014年12月23日, 为4.59℃(图 2b)。pH的变化范围在7.31—8.25, 呈弱碱性(图 2c)。浊度随水位的逐渐降低而逐渐上升, 前3次采样时浊度较低, 均在100 NTU以下; 进入12月浊度出现大幅度的增加,到2015年1月4日达到最大值677 NTU (图 2d)。溶解氧具有明显分段现象, 11月的3次采样时溶解氧较低, 变化范围6.6—7.5 mg/L; 12月之后的5次采样溶解氧较高, 变化范围是9.8—11.2 mg/L (图 2e)。电导率的变幅较小, 前3次采样时电导率较高(77.64—96.33 μs/cm), 后5次采样时电导率较低(72.34—73.87 μs/cm, 图 2f)。
在“堑秋湖”过程中水体氨氮的浓度呈先增加后降低的变化, 2014年12月8日测得最高值为0.56 mg/L, 2014年11月9日测得最低值为0.13 mg/L (图 2g)。水体中总氮、总磷和硝氮的浓度均呈逐渐增加趋势, 在11月份前3次采样时具有较低值, 进入12月份以后, 这3种营养盐的浓度显著增加(图 2g—j)。
2.2 浮游动物种类组成及优势物种
研究共采集到浮游动物77种, 其中轮虫有53种,桡足类14种, 枝角类10种。浮游动物的总物种数、轮虫的物种数和枝角类的物种数随“堑秋湖”水位降低逐渐减少, 桡足类的物种数出现减少增加的波动(图 3)。浮游动物的总物种数及各类群的物种数最多均在2014年11月9日第1次采样时, 最小值均出现在2015年1月4日最后1次采样时。枝角类的物种数较少, 随着采样时间的推移最后趋近于无。
通过计算物种优势度, 确定“堑秋湖”过程中浮游动物的优势物种8种, 其中轮虫3种, 枝角类1种,桡足类4种。分别是前节晶囊轮虫Asplanchna priodonta、针簇多肢轮虫Polyarthra trigla、广布多肢轮虫Polyarthra vulgaris、长额象鼻溞Bosmina longirostris、中华窄腹剑水蚤Limnoithona sinensis、跨立小剑水蚤Microcyclops varicans、广布中剑水蚤Mesocyclops leuckarti和无节幼体Copepod nauplii。
2.3 浮游动物多样性指数
浮游动物Margalef丰富度指数(D)的波动范围为2.19—6.83, 2014年11月9日到2014年11月22日前3次采样期间的丰富度较高, 之后逐渐降低, 2014年12月23日略有上升。Pielou’s index均匀度指数(J)变化范围在0.45—0.76, 除2014年12月23日的样品均匀度较低外, 其他7次样品的均匀度变化很小, 物种分布较为均匀。Shannon-Weiner多样性指数(H′)逐渐降低, 最高值出现在2014年11月9日第1次采样时, 为2.69; 最低值出现在2014年12月23日和2015年1月4日最后2次采样, 均为1.40(图 4)。
2.4 浮游动物的密度与生物量
研究发现在“堑秋湖”过程中浮游动物的密度呈现先上升后下降趋势, 最大密度254.21 ind./L出现在2014年12月16日第6次采样时; 最小密度为64.69 ind./L, 出现在2015年1月4日最后1次采样时。轮虫的密度在2014年11月9日到2014年12月16日前6次采样期间呈逐渐增加趋势, 最高达到153.33 ind./L, 随后逐渐下降, 最后1次采样降低至35.43 ind./L, 在2015年1月4日最后1次采样时急剧减少到35.43 ind./L。枝角类种类少, 密度小, 最高密度(26.02 ind./L)低于轮虫的最低密度, 密度最低至2.00 ind./L。桡足类在2014年11月16日第2次采样时密度(99.31 ind./L)最高, 与轮虫和枝角类一致,在2015年1月4日发现最低密度, 为27.26 ind./L (表 1)。

图 2 “堑秋湖”过程中水体理化参数变化Fig. 2 The physicochemical parameters during the “Plate-shaped Lake Enclosed in Autumn”
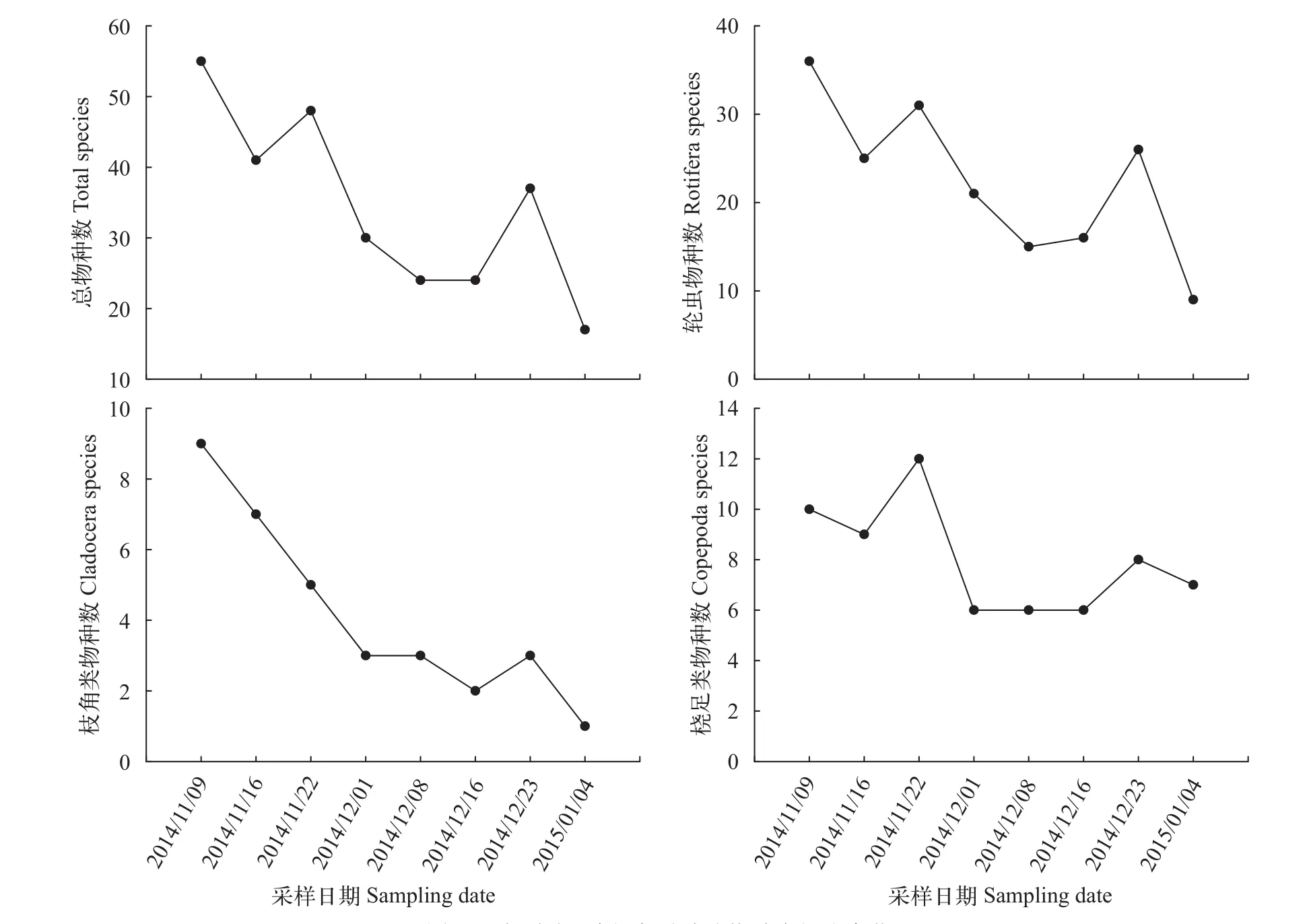
图 3 “堑秋湖”过程中浮游动物种类组成变化Fig. 3 The richness of zooplankton species during the “Plate-shaped Lake Enclosed in Autumn”
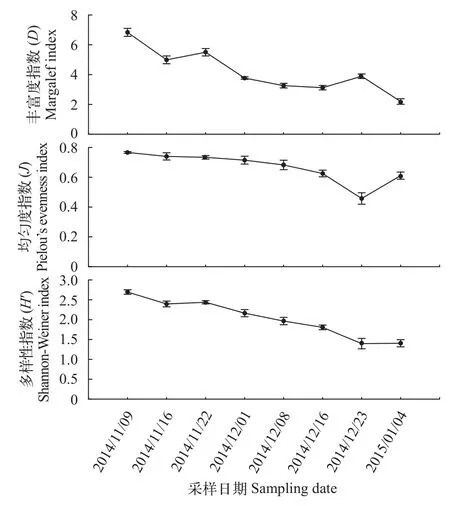
图 4 “堑秋湖”过程中浮游动物多样性指数变化Fig. 4 The zooplankton biodiversity index during the “Plateshaped Lake Enclosed in Autumn”
浮游动物生物量变化与密度变化的趋势基本一致, 最大值与最小值出现的时期与最大和最小密度均在同一天, 分别为(3.05±0.35)和(0.87±0.10) mg/L。2014年11月9日第1次采样时轮虫生物量最低,之后逐渐上升, 到2014年12月23日达最高生物量(1.67±0.21) mg/L, 最后1次采样时生物量出现下降。研究期间枝角类生物量持续降低, 最大生物量不超过于1 mg/L, 最小生物量低至0.01 mg/L。桡足类生物量差异较小, 整体呈现先上升后下降的趋势,最大值出现在2014年12月16日第6次采样, 为(1.34±0.2) mg/L, 最小值出现在2015年1月4日最后1次采样, 为(0.39±0.04) mg/L (表 2)。
2.5 浮游动物密度、水位、水温及鱼类数量的变化趋势
在“堑秋湖”过程中浮游动物的总密度、轮虫的密度和桡足类的密度均呈现先增加后减少的趋势, 枝角类的密度较低且在整个过程中持续下降。水温整体呈下降趋势, 但是由于短时天气影响,2014年11月12日和2015年1月4日的水温略有升高。水位下降, 水深逐渐变浅的同时, 鱼类被渔民捕获, 数量也逐渐减少(图 5)。
2.6 浮游动物优势种密度变化
优势物种前节晶囊轮虫、针簇多肢轮虫和中华窄腹剑水蚤的密度变化趋势一致, 均呈逐渐上升的趋势(图 6)。跨立小剑水蚤、广布多肢轮虫、广布中剑水蚤、长额象鼻溞及无节幼体的密度呈逐渐下降趋势。
2.7 浮游动物与环境因子的关系
对实验中测定的10个环境因子与浮游动物物种进行冗余分析(RDA), 第一轴和第二轴的特征值分别为0.302和0.105, 共解释了影响浮游动物群落变异的40.7%。蒙特卡罗检验显示6个环境因子(水位、浊度、溶解氧、电导率、氨氮和硝氮)与浮游动物群落结构相关性较强(P<0.05)。其中对浮游动物影响最强的环境因子是溶解氧, 其次是氨氮和水位(P=0.002)(图 7)。不同浮游动物优势种受各环境因子影响的差异较大, 广布中剑水蚤、长额象鼻溞和无节幼体主要受水位和电导率的影响, 而前节晶囊轮虫和中华窄腹剑水蚤的主要影响因子是溶解氧。
对研究期间采集到的49个浮游动物样品和10个环境因子进行冗余分析(RDA), 第一轴和第二轴的特征值分别是0.388和0.114, 两轴的解释率为50.2%。从分析结果可以发现前三次采样(11月9日到11月22日)浮游动物主要受水位和电导率的影响(图 8)。后四次采样(12月8日至1月4日)浮游动物主要受浊度、溶氧、氨氮和硝氮的影响。氨氮对12月8日和12月16日的浮游动物影响显著, 硝氮对1月4日的浮游动物影响显著。
3 讨论
3.1 水位对浮游动物群落结构的影响
水位变动是影响湖泊生态系统状态变化的主要因素, 通过影响湖泊的水动力过程而影响湖泊的生态过程[24, 25], 有研究发现水动力作用可通过增加水体中的悬浮质、降低透明度、改变水下光照条件等间接影响浮游动物的组成和数量[26]。最近的研究发现湖泊水位变动对捕食性浮游动物(桡足类)的丰度具有直接影响[12]。因此, 可以认为水位波动是影响湖泊浮游动物群落结构的重要因素之一。Rennella等[27]在南美浅水湖泊中的研究发现水文变化对浮游动物群落的调控比其他生物因素具有更大的影响。浮游动物的不同物种对水位变化的敏感程度具有明显差异, 其中轮虫发育时间短,适应环境的能力强, 可以在水体中快速恢复繁殖,小型甲壳类生长周期长, 恢复缓慢, 受水位波动的影响较大[28, 29]。我们的研究发现“堑秋湖”过程中大湖池开闸放水, 水位从16.47 m下降至15.18 m的过程中, 轮虫和桡足类的密度先升高, 后逐渐降低,而枝角类的密度一直呈现下降趋势(图 5), 推测可能的原因是“堑秋湖”过程中轮虫适应水位的变化而发生快速繁殖恢复了种群数量, 而枝角类由于生长周期长和水温降低等原因, 种群难以恢复导致密度逐渐下降。桡足类的生长周期最长, 要经历多个无节幼体期[30], 因此桡足类在水位变化过程中的密度逐渐降低, 且无节幼体占据优势。另外, 桡足类除了取食细菌、藻类, 还取食轮虫等小型浮游动物[19], 调查前期轮虫和枝角类的密度均较低,食源的缺乏也可能是导致桡足类密度下降的一个原因。
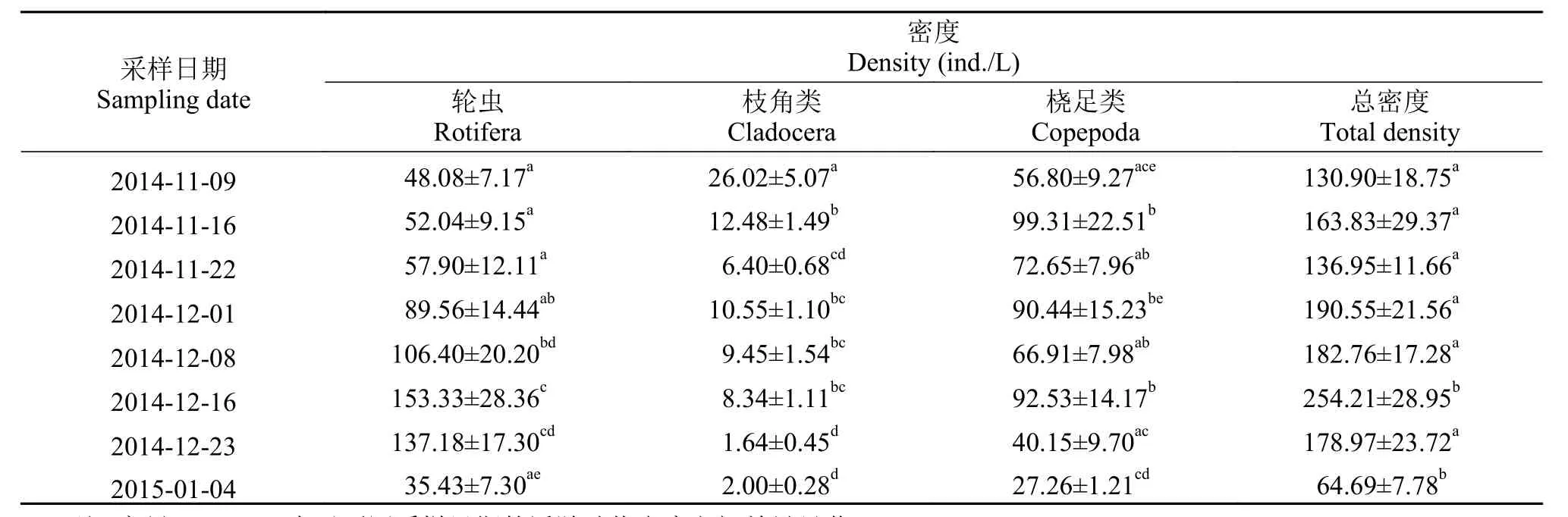
表 1 “堑秋湖”过程中浮游动物的密度Tab. 1 Density of zooplankton during the “Plate-shaped Lake Enclosed in Autumn”
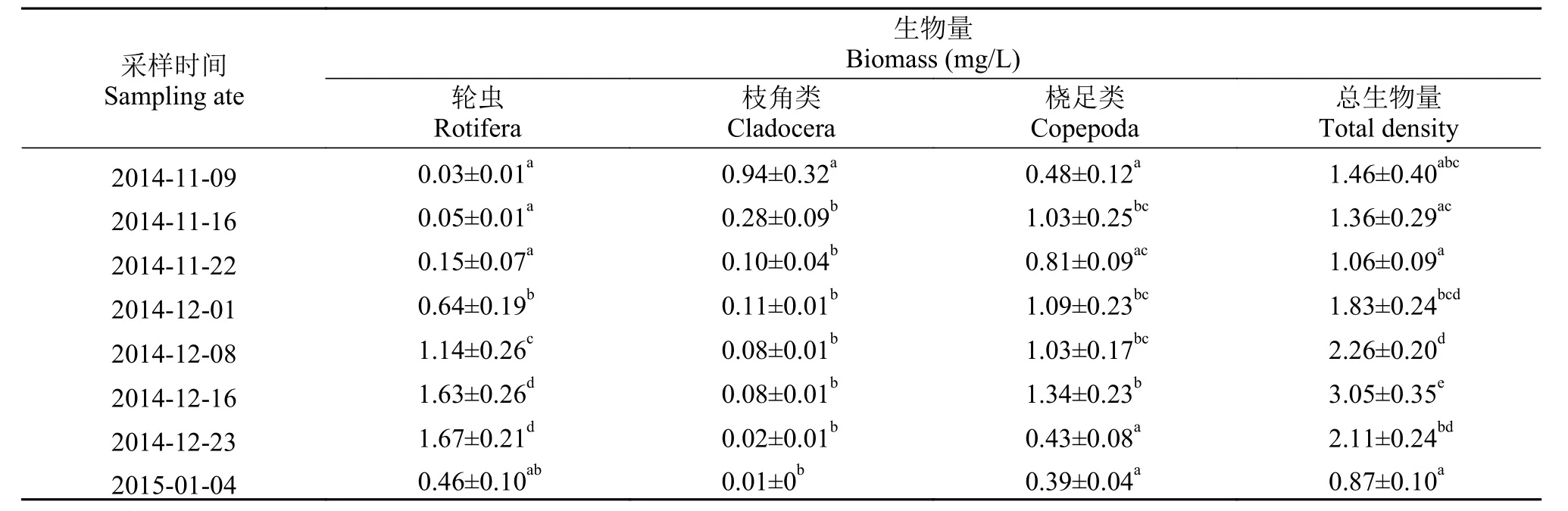
表 2 “堑秋湖”过程中浮游动物的生物量Tab. 2 Biomass of zooplankton during the “Plate-shaped Lake Enclosed in Autumn”
3.2 非生物因素对浮游动物群落结构的影响
在泛滥平原的浅水湖泊中, 环境因素对浮游动物群落结构的影响可能要大于生物因素的影响[30]。我们的实验结果表明: 温度、溶氧、透明度以及营养盐等也是影响浮游动物群落结构的主要因子。在适宜的水温下浮游动物生长繁殖更快, 但在低温下繁殖的浮游动物个体更大, 寿命更长[31]。温度过高或过低时浮游动物会产生休眠卵来抵抗不良环境, 当条件适宜时休眠卵孵化生长[32]。已有研究证明, 温度小于15℃会大大降低浮游动物的存活率和休眠卵的萌发率[33, 34]。另外, 不同浮游动物类群休眠卵形成时间和孵化周期有所差异, 轮虫等小型浮游动物孵化周期短, 种群增长快; 枝角类和桡足类等大型浮游动物孵化周期长, 种群恢复缓慢[33, 35]。温度还可以通过调节鱼类捕食和浮游植物密度, 间接改变浮游动物的种群增长状况[36]。整个调查期间温度较低, 导致浮游动物密度整体较低, 且随着温度的持续下降, 枝角类几乎消失。溶解氧是水生生物生存的必要条件, 水体中溶解氧含量的高低可以直观表征生物的生活环境状况[37], 大湖池溶解氧的升高为浮游动物等水生生物提供了充足的氧气,有益于浮游动物密度增加。“堑秋湖”水位的下降以及下雨、大风等天气导致水体中的沉积物质再悬浮, 增大了水体浊度。亚热带浅水湖泊中悬浮物浓度上升会破坏鱼鳃结构, 影响鱼类视觉, 干扰食浮游动物鱼类对大型浮游动物的捕食, 减小鱼类捕食压力, 增加浮游动物密度[38]。营养盐对浮游动物群落结构的调控是通过影响浮游植物间接实现的,营养盐浓度的变化会改变浮游动物食性, 影响浮游动物的种类组成和密度变化[39]。营养盐浓度的升高, 会导致浮游植物密度增加, 为浮游动物提供充足的食物资源[40]。大湖池后四次采样时的营养盐明显高于前三次, 为浮游动物密度的增加提供了有利条件。

图 5 “堑秋湖”过程中浮游动物密度、水深、水温及鱼类数量变化趋势Fig. 5 The variation of zooplankton density, water depth, water temperature and fish population during the “Plate-shaped Lake Enclosed in Autumn”
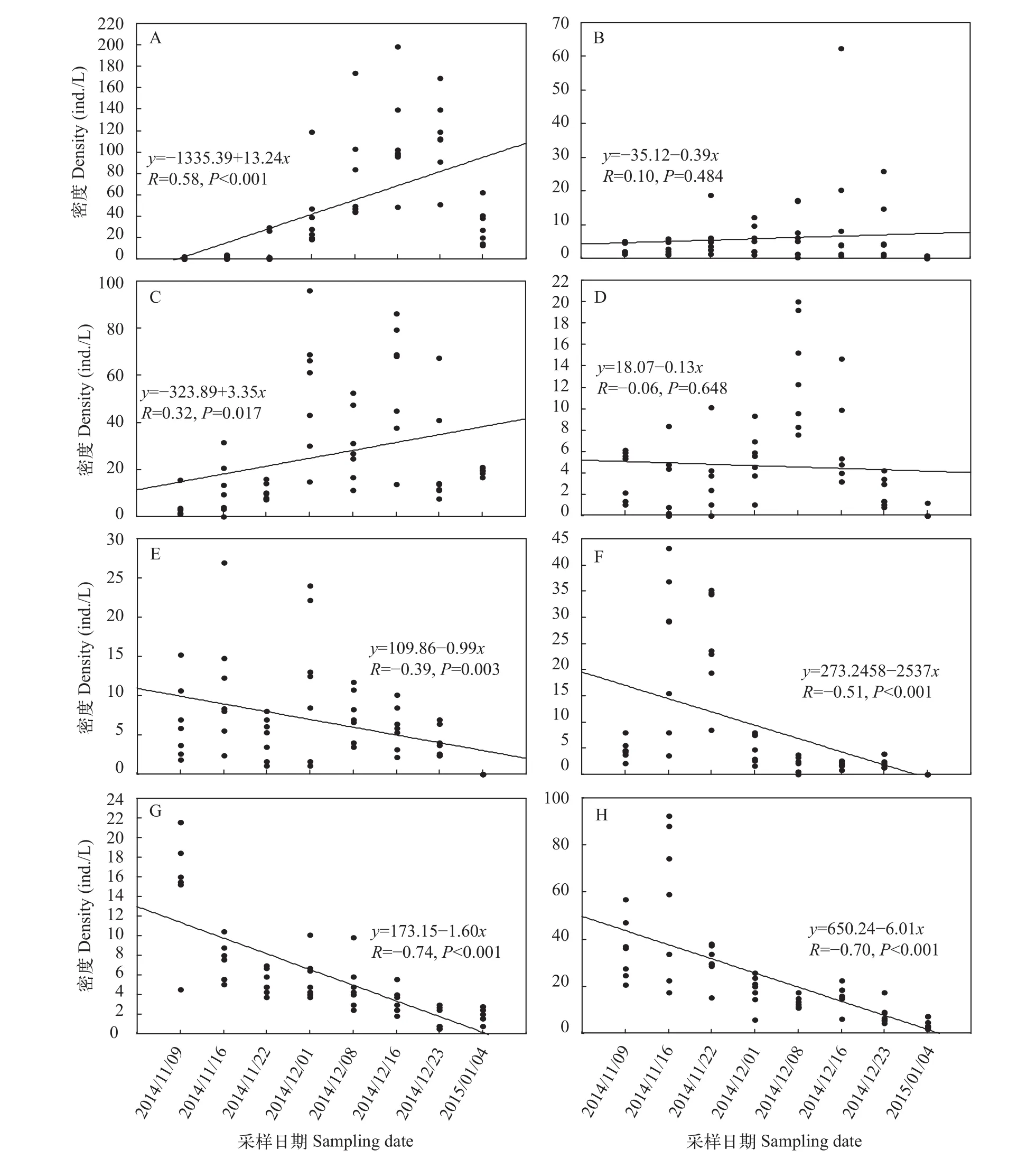
图 6 “堑秋湖”过程中浮游动物优势种密度变化Fig. 6 The variation of zooplankton dominant species density during the “Plate-shaped Lake Enclosed in Autumn”
3.3 生物因素对浮游动物群落结构的影响
浮游动物群落结构同时受到众多其他因素的影响, 除非生物因素中的水位、溶氧、浊度和营养盐等环境因素外, 还有生物因素中的竞争和捕食等影响因素[41]。先前研究表明, 位于湖泊食物网重要级联上的浮游动物群落结构变化受上行与下行效应的共同调控, 浮游植物和浮游食性鱼类都是控制浮游动物的重要因子[42]。浮游植物作为浮游动物的饵料, 其密度下降会导致浮游动物的食物资源减少, 加剧种内竞争。鱼类捕食常常会导致浮游动物群落结构中的个体大小发生变化[30]。在渔民的“堑秋湖”活动开始后, 每天捕获大量鱼类使得大湖池鱼类密度持续下降[43]。我们在“堑秋湖”过程中对渔民进行现场调研获知, 开闸放水初始几天内捕获的鱼类以小型上层鱼类(如䱗、油䱗、似鳊等)为主, 且数量较少, 随后较大数量的滤食性鱼类(鲢和鳙)和小型鱼类被捕获, 而后期的渔获物主要是肉食性鱼类和杂食性鱼类为主。滤食性鱼类的被捕获大大降低了对浮游动物的捕食压力, 从而导致“堑秋湖”初期阶段(11月9日至12月1日)浮游动物的密度有一个短时间内的上升。此外, 鄱阳湖国家级自然保护区内的各个小型子湖泊是许多越冬候鸟的栖息地和觅食地, 渔民的围湖筑堤和开闸放水等“堑湖”活动在一定时期内为越冬候鸟提供了适宜的水深栖息生境和丰富的食物资源, 使得候鸟种群数量有阶段性的大幅增加[16, 44]。肉食性鸟类对鱼类和底栖动物的捕食直接降低了浮游动物的捕食压力, 而植食性鸟类对植物块茎和冬芽的挖掘取食可能会扰动水体, 使得沉积物悬浮并引起水体浊度升高, 进而对浮游动物群落造成间接影响。
4 结论与建议
(1)在“堑秋湖”过程中随着水位的持续下降, 水体理化因子发生不同变化: 浊度、溶解氧和营养盐逐渐升高, pH和电导率较为平缓的波动。
(2)在“堑秋湖”过程中随着水位的持续下降, 浮游动物的种类和多样性指数逐渐降低, 浮游动物的密度呈现先升高后降低的变化趋势。轮虫和桡足类的密度先升高后降低, 枝角类密度持续降低。
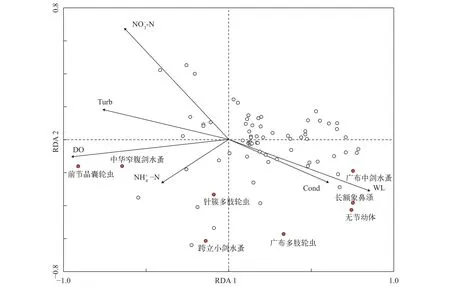
图 7 浮游动物和环境因子间的RDA排序图Fig. 7 RDA biplot of species and environment al factors of zooplankton

图 8 浮游动物样品与环境因子间的RDA排序图Fig. 8 RDA biplot of sample and environmental factors of zooplankton
(3)浮游动物的群落结构受理化因子水位、电导率、浊度、溶解氧以及营养盐氨氮和硝氮的影响, 其中溶解氧对浮游动物群落结构的影响最大,其次是氨氮和水位。捕鱼活动导致的浮游食性鱼类减少也对浮游动物的密度变化产生了影响。
鄱阳湖是白鹤等鸟类的重要栖息地和越冬地,碟形子湖延展的洲滩、泥滩和浅水生境为越冬候鸟提供了丰富的食物资源和栖息环境, 对于维护全球鸟类多样性具有重要作用。科学合理的管理方式将会使得碟形子湖的生态功能得到更加充分的发挥, 为越冬候鸟提供更加优良的栖息生境。本研究发现在“堑秋湖”过程中水位的变化直接或间接导致了浮游动物多样性的降低, 使得以浮游动物为食的鱼类等水生生物的食物资源减少。建议保护区和政府管理部门针对越冬候鸟的栖息习性和觅食需要, 对保护区内的“堑秋湖”活动进行科学管理调控, 合理的调控保护区内不同碟形湖的开闸放水时间, 在尽量不影响渔民经济利益的前提下, 为越冬候鸟提供更多更优良的栖息生境。同时可以保证碟形子湖在枯水期能够裸露湖底接受太阳暴晒,加快植物残体等各种有机物的分解进而改善土壤结构, 保持碟形子湖湿地生态系统的健康与活力。
致谢:
感谢南昌大学余文生和詹文荣同学协助进行野外样品采集, 感谢江西鄱阳湖国家级自然保护区郝能祖主任和余定坤在野外工作中提供的帮助, 感谢中国科学院水生生物研究所王海军副研究员在论文撰写过程中给予的指导。
