西江鲤仔稚鱼生长及消化酶活性变化
2019-03-11刘亚秋李新辉李跃飞
刘亚秋 李新辉 李跃飞 李 策
(1. 中国水产科学研究院珠江水产研究所, 广州 510380; 2. 农业部珠江中下游渔业资源环境科学观测实验站, 广州 510380;3. 上海海洋大学海洋科学学院, 上海 201306)
鱼类在早期发育阶段的生长规律及生理特性的变化特点对于研究其早期生活史发生机理具有的作用。饥饿在鱼类早期发育阶段是导致其仔鱼死亡的重要原因之一[1]。在早期发育阶段仔鱼的生理生化变化特点是反映仔鱼的生长及形态变化的指标[2, 3]。鲤(Cyprinus carpio)隶属于鲤形目, 鲤科,是中国重要的经济鱼类之一, 在长江、珠江等流域均有分布。在渔业生产中, 鲤作为西江流域的渔获物之一占有重要地位[4]。近年来, 航道整治、采砂等人为活动影响, 鲤在西江的资源量明显下降。目前关于鲤基础生物学特性已有较多研究报道[4—6]。本实验室已在西江郁南、高要、肇庆等江段开展了人工鱼巢增殖鲤鱼相关工作, 并对人工鱼巢增殖效果进行了评估[7]。但有关西江鲤的早期发育中消化酶活性变化目前尚未见报道。在仔稚鱼早期发育过程, 消化酶比活力已作为评价仔稚鱼发育健康状况的重要的指标之一[8, 9]。为此, 作者探究了鲤仔稚鱼的生长过程中主要消化酶活性变化特征, 揭示其早期消化酶变化的规律, 以期丰富该江段鲤早期生活史资料, 也为鲤早期资源保护及苗种培育提供理论支撑。
1 材料与方法
1.1 实验鱼培育
2017年3月30日从西江肇庆江段人工鱼巢抽取芦苇, 约5.0 kg(附着有鲤胚胎约15000个), 放置于水桶中充氧, 带回实验室进行人工培育。实验仔鱼均来自同一批受精卵, 并于4月2日全部出膜。鱼苗分6个组饲养于容积100 L的水族缸内, 每个水族缸内饲养约2000尾, 饲养40d, 于5月12日结束。其中3个试验组, 3—5日龄仔鱼开始投喂蛋黄, 5—10日龄投喂丰年虫; 10日龄后投喂颗粒饲料, 投喂之前清除缸内剩余残渣。饲养期间每天饱食投喂2次, 投喂时间为9:00和19:00。另外3个组不进行投喂, 实验过程中发现未投喂组至15日龄鲤仔稚鱼几乎全部死亡。饲养期间, 水温: 21—24℃, 溶氧: 7.2—7.9 mg/L,pH: 7.1—7.8。
1.2 样品采集
分别在0、1、2、3、4、5、7、9、10、12、15、20、25、30和40日龄(孵化当日记为0日龄)对鲤仔稚鱼全长与体重进行测量, 在1、2、3、5、7、9、12、15、18、20、25、30和40日龄对其消化酶活性测定。实验取样在早上9:00投喂完1h以后进行, 从3个水族缸中随机捞取鱼苗分别放入装有清水的不同烧杯中, 0.5h后捞出, 取材过程中样品均置于冰上, 以免消化酶失活。取完样品后立即置于-40℃超低温冰箱保存, 用于消化酶测定。
1.3 特定生长率的测定
特定生长率的计算公式:SGR=100×(lnFBW-lnIBW)/T, 其中FBW为个体终末体量(g),IBW为个体初始体重(g),T为时间(d)。
1.4 可溶性蛋白含量和消化酶活性的测定
快速从超低温冰箱中取出待测样品, 放置于冰盒上解冻。在解冻完成后, 按质量: 体积为1∶4加入匀浆稀释液, 进行匀浆。所得匀浆液用低温超速离心机4℃, 3000 r/min转速离心20min后取上清液用于消化酶活力测定。实验中的可溶性蛋白含量以及消化酶比活力均使用南京建成公司生产的试剂盒进行检测。实验使用仪器为多功能高端酶标仪(Infinite M200 PRO)。
1.5 数据分析
对不同发育时期鲤仔稚鱼的可溶性蛋白含量和各消化酶活性差异的显著性, 采用单因子方差分析(ANOVA)检验。显著性水平为0.05。采用Excel(2007)以及SPSS19.0软件对实验数据进行统计分析。所测得实验数据均以平均值±标准差(Means±SD)表示。
2 结果
2.1 生长情况
经过40d饲养后(图 1), 非饥饿组鲤体重由1.12 mg增至412.31 mg, 全长由5.77 mm增至34.65 mm, 特定生长率为14.81%。在发育过程中, 拟合全长和体重增长方程, 分别为:y=0.765x+4.002 (R2= 0.958)和y=0.218x2+1.488x-1.403 (R2=0.996)。饥饿组全长以及体重则没有明显增长。
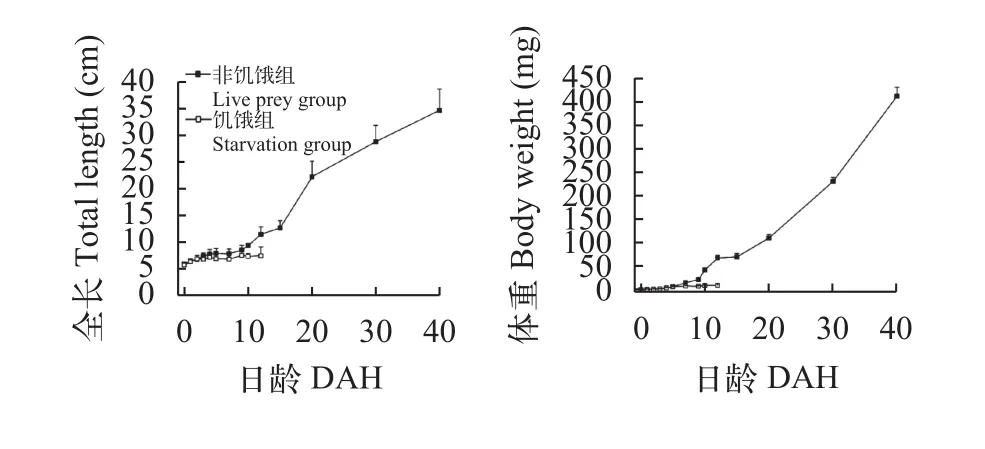
图 1 鲤仔稚鱼发育过程中全长和体重随日龄变化Fig. 1 Total length and body weight of C. carpio during the development of larvae and juvenile
2.2 可溶性蛋白含量
鲤仔稚鱼在其生长的过程中(图 2), 在1—3日龄, 非饥饿组可溶性蛋白含量下降, 并第3日龄时到达最小值。7日龄后, 可溶性蛋白质含量上升, 25日龄后, 上升趋于平缓, 40日龄时达到(2.01±0.23) g/L。5日龄, 饥饿组可溶性蛋白含量逐渐降低, 15日龄时降至(0.43±0.05) g/L。
2.3 消化酶活性变化
如图 3所示, 非饥饿组仔鱼淀粉酶的比活力从1日龄到3日龄迅速增加(P<0.05)。开口摄食后淀粉酶的比活力下降, 5日龄时降至最低, 随后经过短暂的波动在15日龄到达峰值。随后小幅下降, 逐渐趋于稳定。饥饿组淀粉酶比活力在3日龄到达最大,随后淀粉酶比活力快速下降。非饥饿组脂肪酶比活力在1—5日龄显著上升, 而在9日龄后脂肪酶比活力迅速下降(P<0.05), 15日龄后又开始逐渐上升,至18日龄后趋于稳定, 其后消化酶比活力保持在相对稳定的水平。饥饿组脂肪酶在5日龄前变化趋势与非饥饿组类似, 后迅速下降。非饥饿组胰蛋白酶比活力3日龄后快速升高, 在9日龄时达到峰值, 随后显著下降至15日龄后显著上升(P<0.05), 到25日龄后出逐渐下降。饥饿组7日龄达到峰值, 后迅速下降(P<0.05)。在鲤仔稚鱼发育过程中, 非饥饿组糜乳蛋白酶比活力在9日龄时达到峰值。在20日龄后, 糜乳蛋白酶比活力逐渐下降。饥饿组的糜乳蛋白酶比活力在3日龄后显著下降(P<0.05)。在9日龄后, 饥饿组糜乳蛋白酶比活力无显著变化(P>0.05)。非饥饿组碱性磷酸酶比活力从2日龄后, 开始显著上升(P<0.05), 在 3日龄和20日龄, 分别达到峰值,18日龄后碱性磷酸酶比活力显著升高(P<0.05), 到25日龄, 比活力趋于稳定状态。饥饿组碱性磷酸酶比活力在7日龄后显著下降, 12日龄后趋于稳定, 活性相对较低。非饥饿组氨基肽酶在出膜后迅速升高, 在3日龄和7日龄时, 达到峰值后逐渐下降至15日龄, 随后逐渐缓慢上升。饥饿组5日龄后, 氨基肽酶比活力处于相对较低的水平。
3 讨论
3.1 可溶性蛋白的变化
仔鱼发育到出膜后3日龄可溶性蛋白含量降至最低。1—3日龄, 仔鱼尚未开口, 生长发育所需的营养物质主要由卵黄提供, 卵黄蛋白不断减少导致蛋白含量快速下降。开口摄食后仔鱼蛋白含量显著上升。这与胭脂鱼(Myxocyprinus asiaticus)、泥鳅(Misgurnus anguillicaudatus)的研究结果类似[10, 11]。而瓦氏黄颡鱼(Pelteobagrus vachelli)的研究中发现, 可溶性蛋白含量没有显著的下降[12]。推测鲤可溶性蛋白含量变化过程可能与仔稚鱼发育过程中营养方式转换相关。
3.2 消化酶活性的变化
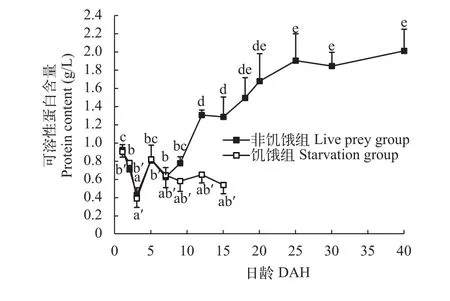
图 2 鲤仔稚鱼发育过程中可溶性蛋白含量变化Fig. 2 Soluble protein content of C. carpio during th development of larvae and juvenile
在本研究中我们发现鲤淀粉酶、脂肪酶、胰蛋白酶、碱性磷酸酶、糜乳蛋白酶以及氨基肽酶的比活力在开口摄食前均能检测到活性。Chen等[13]在对黄 鱼(Seriola lalandi)消化系统发育研究中, 也有类似结果。Gawlicka等[14]研究发现消化酶的发育决定了仔鱼开始摄取以及消化外源食物的时间。有研究表明, 消化酶在仔鱼初孵时就已存在,因此, 在开始外源营养之前消化酶的发育不是被食物诱导的, 而是被其内部遗传机制所调控[15, 16]。鲤仔鱼在开口摄食之前, 淀粉酶已具有较高的活性可能由于提供营养物质的卵黄囊中含有丰富的糖原。也有研究表明仔鱼消化酶活性会在外源营养开始之前达到相对高的水平, 以适应消化外源食物的需要[17]。在3日龄, 淀粉酶活性显著下降, 仔鱼对蛋白质和脂肪的利用能力增强, 而对糖类的利用能力减弱。也有学者认为仔鱼在消化系统的发育过程中, 其淀粉酶分泌功能会出现一定的减弱[17, 18]。脂肪酶活性在5日龄达到峰值, 这可能与卵黄囊的吸收有关。但是在10—15日龄其活性降到很低的水平。Oozeki等[19]在对狭鳕(Theragra chalcogramma)的脂肪酶研究中也发现同样的结果。对塞内加尔鳎(Sole asenegalensis)的研究发现, 早期仔鱼体内存在两种不同类型的脂肪酶分别为与卵黄囊中脂肪的消化相关的脂酶以及与外源营养物质中脂肪的消化相关的磷脂酶[20]。这2种脂肪酶相互转变引起的仔鱼初次摄食后脂肪酶活性的显著下降。15日龄后逐渐上升, 恢复到稳定的水平, 这是由于胰腺结构完善以及分泌功能增强所致。胰蛋白酶和糜乳蛋白酶比活力在5日龄后显著上升, 并在9日龄达到峰值。这说明外源食物对于胰蛋白酶分泌起到了一定刺激作用。12日龄后胰蛋白酶活性显著上升, 表明了在这一时期鲤仔稚鱼消化体系发育完善, 对蛋白质消化能力逐渐增强, 而随后的下降可能是由于鲤体内的可溶性蛋白的累积。碱性磷酸酶和氨基肽酶, 主要存在于鱼类肠道上皮刷状缘膜[18, 21]。有学者提出将其活性变化作为仔鱼肠道功能发育程度以及其营养物质吸收状况的评价指标[22, 23]。本研究发现鲤仔鱼在1—3日龄, 碱性磷酸酶以及氨基肽酶活性显著上升, 肠道消化吸收功能的增强, 也标志着细胞外消化的开始。7日龄时, 鲤仔鱼碱性磷酸酶以及氨基肽酶达到峰值, 表明了肠道消化功能在这个阶段的快速发育。18—25日龄碱性磷酸酶活性显著性上升, 标志鲤仔稚鱼肠道组织结构完善, 肠细胞消化吸收功能逐渐完善。
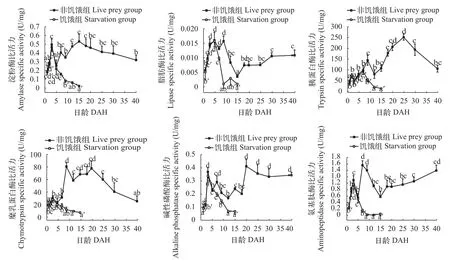
图 3 鲤仔稚鱼发育过程中不同消化酶比活力变化Fig. 3 The activities of different digestive enzymes in C. carpio during the development of larvae and juvenile
3.3 饥饿对消化酶活性影响
鲤仔鱼在3日龄时开口摄食, 在饥饿组仔鱼的生长过程中, 并没有投喂任何食物, 饥饿组仔鱼的消化酶仍具有一定活性, 这可能说明消化酶的发生是主要受到了基因调控而并非受外源食物的诱导。但是由于外源食物严重缺乏, 此后的发育过程中, 鲤的消化酶活性逐渐下降。仔鱼阶段是一个细胞分化增殖非常集中的时期, 饥饿可以导致细胞的分化和增殖停止, 破坏细胞结构和致使其功能的丧失, 从而引起消化酶活性的显著下降[23]。
3.4 开口需求及人工鱼巢设置
研究发现, 鲤作为一种杂食性的鱼类, 在发育早期对糖类物质消化能较强, 随着消化系统不断发育, 对于蛋白质, 脂肪等营养物质利用率会逐渐提高。在其苗种开口阶段可选择糖类物质含量相对较高食物作为饵料, 来提高其成活率。人工鱼巢最早使用于鲤的人工繁殖生产[24]。目前西江设置的人工鱼巢主要是在鲤繁殖季节为其提供产卵场所以达到资源增殖的目的。其材料主要采用芦苇, 当人工鱼巢放置区域出现食物源不足情况时, 可考虑在已有普通材料上结合有机可腐化的材料制备人工鱼巢, 其成分配方可根据不同发育时期鲤消化酶活性的变化来进行相应调整, 降低饥饿对仔稚鱼成活率的影响, 从而提高人工鱼巢的生态修复功能。
