苦荞转录因子基因FtMYC的克隆及其表达与花青素积累的相关性分析
2019-03-11姚攀锋吕兵兵董玘鑫王安虎
姚攀锋,吕兵兵,李 琪,董玘鑫,王安虎,吴 琦*
(1.四川农业大学生命科学学院,四川 雅安625014;2.西昌学院,四川 西昌615000)
苦荞(Fagopyrum tataricum)属于蓼科荞麦属一年生草本植物,由于其富含芦丁、花青素等黄酮类化合物,因此,对人体具有降“三高”等多种保健功能[1]。与此同时,黄酮类化合物也有助于提高植物对逆境的耐受力,植物会通过调控黄酮化合物合成相关基因的表达对环境刺激迫作出响应,由此形成一种自我保护机制[2]。研究表明,苦荞黄酮中的花青素含量上升常常伴随着逆境的出现,参与抵抗紫外辐射、抗寒和抗旱等多个生理过程。Li S.等[3]对芽期苦荞子叶和胚轴分别进行了低温胁迫后发现,处理后苦荞子叶和胚轴中花青素含量均显著提高。此外,苦荞冷处理后的转录组和代谢组分析显示,4℃胁迫之后苦荞的矢车菊素3-0-葡萄糖苷和矢车菊素3-0-芸香糖苷相比正常条件下分别提高了6.3和11.3倍[4]。因此,花青素作为苦荞体内一类重要的黄酮类化合物,在苦荞的抗逆机制中起着重要的作用。
花青素生物合成途径是类黄酮物质合成途径的一个分支,参与其生物合成相关的基因主要包括结构基因和转录因子这两大类,二者共同调控植物花青素的代谢合成[5]。参与花青素支路调控的转录因子众多,主要包括MYB、bHLH和WD40等,它们单独或者形成复合物发挥生物学作用[5]。其中,bHLH转录因子是植物中仅次于MYB转录因子的第二大转录因子超家族广泛存在于植物中,在植物的生长发育与形态建成、次级代谢产物的合成及对外界环境胁迫应答中起着重要的调控作用[5-6]。例如,在番茄中持续表达ZmLc、Delila和MYC-RP/GP等bHLH类蛋白,能使花青素在地上部分(包括果实)和根中大量积累[7]。过表达Delila(bHLH)基因,在果实中特异的启动子E8的控制下,能导致花青素在果肉和果皮中强烈的增加,果实呈暗紫色[5]。可见,bHLH转基因能激活花青素代谢途径中一系列结构基因,促进花青素等黄酮物质在植物中的大量积累,较单个结构基因的转基因具有更为广泛的作用。
本实验根据获得的苦荞花期转录组数据,采用RT-PCR技术克隆出一条与花青素调控相关的bHLH转录因子MYC亚家族的基因FtMYC,并采用UV-B、4℃冷胁迫处理二叶期苦荞,探究FtMYC基因在非生物胁迫条件下的表达量变化与花青素含量的相关性,并分析了FtMYC基因启动子上的主要顺式作用元件,初步明晰FtMYC的结构及其在苦荞逆境胁迫中的作用。
1 材料和方法
1.1 材料及主要试剂
苦荞“西荞2号”由西昌学院王安虎教授惠赠,栽培在四川农业大学生命科学学院人工气候室;植物RNAout(Trizol法)试剂盒、TaqDNA聚合酶、PrimeSTAR Max DNA Polymerase、SYBR Premix ExTaqTMII(Perfect Real Time)购自TaKaRa公司,其他试剂为国产分析纯。
1.2 试验方法
1.2.1 苦荞FtMYC基因的克隆
采用SDS法提取苦荞叶片总DNA,采用植物RNAout试剂盒参照说明书提取苦荞总RNA,并反转录制备cDNA第一条链。根据本实验室的苦荞花期转录组数据,设计一对特异引物分别以苦荞总DNA和cDNA第一链为模板扩增FtMYCDNA和cDNA序列,引物序列:FtMYCf(5'-ATGCAGGCAAATCTC AGAGAAC-3')和FtMYCr(5'-TCACCCACATTTCG TTATAGCT-3')。将PCR产物亚克隆至T载体,送擎科生物技术有限公司测序。
1.2.2 苦荞FtMYC基因的生物信息学分析
通过NCBI在线工具Blast对FtMYC氨基酸序列进行同源比对;通过DNAMAN软件FtMYC及其它同源蛋白进行多重序列比对,分析它的保守结构域;通过MEGA 5.0软件,根据邻接法(neighbor-joining,NJ)构建FtMYC的系统发育进化树。
1.2.3 二叶期苦荞的胁迫处理
UV-B处理:使用10W UV-B(308 nm)LED灯照射二叶期苦荞,光照距离30 cm;4℃冷处理:在光照条件为16 h/8 h(光照/黑暗)、4℃的培养箱对子叶期的苦荞进行冷处理。以上处理均在处理前0 h、处理后1、3、6、12、24和48 h分别取样品的胚轴和子叶液氮速冻后放在-80℃超低温冰箱保存。
1.2.4 苦荞FtMYC基因表达量的检测
根据FtMYC基因序列,设计一对荧光定量PCR引物:qFtMYCf(5'-AAT GCG AAT CAG GCG GAC A-3')和qFtMYCr(5'-GGC ACC CAA CTC GACA ACA C-3')。以苦荞FtH3基因为内参基因,其引物为:qFtH3f(5'-GAA ATT CGC AAG TAC CAG AAG AG-3')和qFtH3r(5'-CCA ACA AGG TAT GCC TCA GC-3')。以cDNA为模板,采用SYBR Premix ExTaqTMII(Perfect Real Time)试剂盒检测FtMYC基因在不同条件处理下的表达水平,通过2-ΔΔCt方法来计算它的相对表达量。
1.2.5 苦荞花青素的提取及定量测定
准确称取0.2 g新鲜样品用液氮研磨后加入1 mL 1%盐酸的甲醇提取液在25℃、100 r/min条件下震荡浸提18 h;3 080 r/min离心15 min后取500μL上清,并加入等体积的双蒸水和300μL氯仿混匀;2 268 r/min离心5 min后取上清,即为花青素提取液。最后通过紫外分光光度计检测530 nm和657 nm处的吸光值。采用如下公式计算花青素的量:花青素(mg/g)=(A530-0.25×A657)/鲜质量。
1.2.6 苦荞FtMYC基因启动子克隆及的生物信息学分析
根据苦荞基因组数据(http://gsa.big.ac.cn/index.jsp),设计一对特异引物PFtMYCf(5'-CGG GAA TAT AAT GAT TCG AGA CAA-3')和PFtMYCr(5'-CAT TAT GCT TTG ACA AGC AAG C-3'),以苦荞DNA为模板扩增FtMYC基因启动子序列,PCR产物亚克隆至T载体后,送擎科生物技术有限公司测序。通过Plant CARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)和PLACE(http://www.dna.affrc.go.jp/PLACE/)数据库对基因5’侧翼序列所含元件进行分析预测,利用启动子核心分析数据库BDGP(http://www.fruitfly.org/seq-tools/promoter.html)对FtMYC基因启动子的核心元件进行预测。
1.3 数据的分析和处理
采用IBM SPASS Statistics 20.0统计软件对苦荞FtMYC基因的表达量与各样本花青素的量进行相关性分析。
2 结果与分析
2.1 FtMYC基因cDNA序列的克隆
分别以苦荞cDNA和总DNA为模版扩增得到2条大小约为1 300 bp的特异条带,见图1。测序结果显示该基因的cDNA和DNA片段分别为1 287和1 309 bp。根据已获得的苦荞FtMYC基因的cDNA和DNA序列,利用DNAMAN软件比对确定其全长DNA序列为1 309 bp,有1个外显子和1个内含子构成(见图2),符合标准的GT-AG剪切原则。Blastp比对结果表明,苦荞FtMYC基因属于bHLH-MYC亚家族。选取bHLH家族中拟南芥AtGL3、葡萄VvMYCA1、紫苏PfMYC-RP和金鱼草AmDELILA进行多重序列比对,发现苦荞FtMYC在N-端包含一个由191个氨基酸组成的bHLH-MYC-N结构域,该结构域属于bHLH转录因子家族中MYC蛋白的特殊结构域[8],见图3。在C-端的bHLH结构域处也具有较高的保守性。以上结果表明,本文获得的FtMYC基因属于bHLH转录因子中的MYC亚家族,其在GenBank中的登录号为:KU162971。
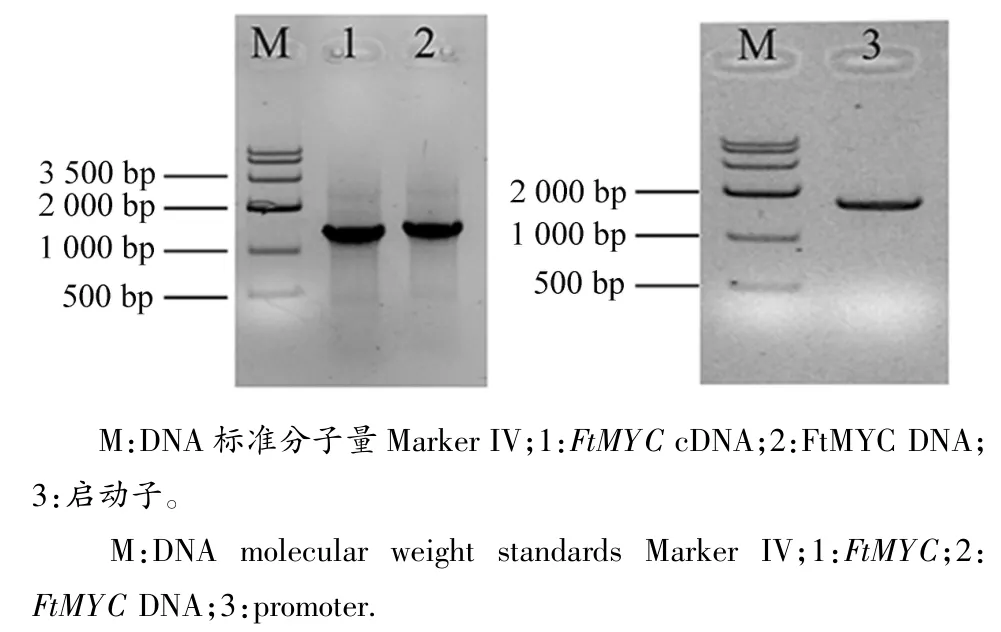
图1 苦荞FtMYC基因cDNA和启动子的扩增Figure 1 Amplification of FtMYC and promoter from tartary buckwheat

图2 苦荞FtMYC基因结构示意图Figure 2 Structure diagram of FtMYC

图3 不同植物bHLH氨基酸序列比对Figure 3 Alignment of amino acid sequences of bHLH from different plants
2.2 苦荞FtMYC系统进化分析
采用MEGA 5.0邻接法构建基于FtMYC氨基酸序列的系统发育进化树(见图4)。选择均已有功能相关性研究的植物MYC蛋白序列,结合M.Heim等[9]根据bHLH保守域氨基酸组成特点对拟南芥133个bHLH蛋白的结构解析及分类,初步分析苦荞该FtMYC可能具有的功能。图4中的进化树分析表明,这些MYC蛋白可明显分为4个大簇,由于这4簇之间氨基酸序列间差异较大,推测其具有不同的进化模式,表现出功能分化。苦荞(Fagopyrum tataricum)FtMYC与拟南芥(Arabidopsis thaliana)AtGL3、葡萄(Vitis vinifera)VvMYCA1、紫苏(Perilla frutescens)PfMYC-RP和金鱼草(Antirrhinum majus)AmDELILA归于一簇,而这些蛋白均参与花青素代谢的有关调控,推测苦荞FtMYC具有相似的功能。
2.3 非生物逆境胁迫下苦荞FtMYC的表达与花青素含量分析
2.3.1 UV-B对苦荞FtMYC表达和花青素含量的影响
使用荧光定量PCR分析FtMYC在UV-B处理下芽期苦荞的转录水平,结果表明:在胚轴中,FtMYC的表达量从处理1 h开始上升,每隔3 h呈现明显的上升趋势,处理2 h后显著上升(P<0.05),为处理前(0 h)的1.83倍(见图5);子叶中,FtMYC在的表达量变化则更为明显,处理6 h后极显著上升(P<0.01),为对照组的13.29倍,随后下降,48 h后接近处理前水平(见图6)。同时,花青素含量分析结果表明:胚轴中的花青素含量随着处理时间不断升高,12 h后为对照组的1.88倍并趋于稳定(见图5);子叶中花青素含量的变化更为明显,处理6 h后显著性提高(P<0.05),对照组的1.44倍(见图6)。
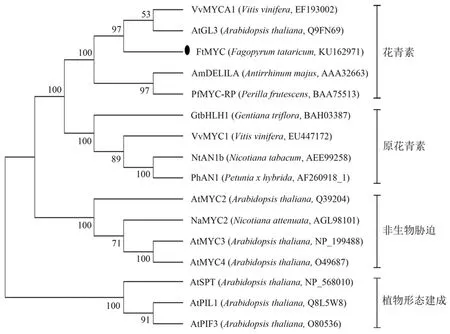
图4 苦荞FtMYC与其他植物来源MYC蛋白序列的系统进化树Figure 4 Phylogenetic tree based on amino acids equences of FtMYC and other plants

图5 UV-B对苦荞胚轴FtMYC表达量和花青素含量的影响Figure 5 Expression levels FtMYC gene and anthocyanins content in hypocotyl under UV-B treatment condition
2.3.2 冷胁迫对苦荞FtMYC表达和花青素含量的影响
使用荧光定量PCR分析FtMYC在冷处理下芽期苦荞的转录水平,结果表明:FtMYC在胚轴中的表达量从处理1 h开始上升,但上升趋势不明显,12 h后达到最大为对照组的1.67倍,之后下降接近对照水平(见图7);而FtMYC在子叶中的表达量变化却很明显,1 h后就发生极显著性变化(P<0.01),12 h后达到对照组的15.3倍,之后降低为对照组的1.83倍(见图8)。花青素含量测定结果显示:在该条件下苦荞胚轴、子叶中花青素含量的变化趋势基本一致,均在12 h后极显著提高(P<0.01),分别为对照组的2.29倍和1.94倍。

图6 UV-B对苦荞子叶FtMYC表达量和花青素含量的影响Figure 6 Expression levels FtMYC gene and anthocyanins content in cotyledon under UV-B treatment condition
2.3.3 苦荞FtMYC基因表达与花青素含量的相关性分析
使用IBM SPSS Statistics 20统计软件分析不同胁迫条件下苦荞胚轴和子叶中FtMYC基因的相对表达量与花青素含量的相关性(见表1)。以相关系数(r)绝对值大于0.75位阈值时,UV-B处理下FtMYC表达量与苦荞胚轴中花青素含量变化显著性相关(r=0.798,P<0.05),与子叶中花青素含量变化极显著相关(r=0.887,P<0.01)。4℃冷处理下FtMYC表达量与苦荞胚轴中花青素含量变化没有明显的相关性(r=0.744),但与子叶中花青素含量变化显著性相关(r=0.814,P<0.05)。结果表明,苦荞FtMYC基因表达量与花青素含量具有较强的正相关。

图7 冷胁迫对苦荞胚轴FtMYC表达量和花青素含量的影响Figure 7 Expression levels FtMYC gene and anthocyanins content in hypocotyl under cold treatment condition
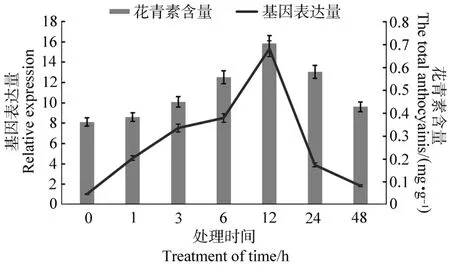
图8 冷胁迫对苦荞子叶FtMYC表达量和花青素含量的影响Figure 8 Expression levels FtMYC gene and anthocyanins content in cotyledon under cold treatment condition

表1 苦荞子叶和胚轴中花青素含量与FtMYC基因表达量的相关性Table 1 Correlation coefficients between FtMYC expression levels and total anthocyanins contents in cotyledons and hypocotyl of Tartary buckwheat
2.4 FtMYC基因启动子元件分析
以苦荞DNA为模版,PCR扩增得到一条1684bp的特异条带,见图1。测序结果与苦荞基因组数据完全一致,表明获得了FtMYC基因的启动子序列,将其命名为pFtMYC。本研究进一步采用DNAMAN软件对pFtMYC的序列进行了生物信息学分析,结果显示:pFtMYC序列包含了63.7%的A/T碱基,符合植物启动子的基本特征。通过在线网站对该启动子序列的分析结果显示,pFtMYC中包含有大量的顺式作用元件,比如启动子核心元件、环境和激素类响应元件等(见表2)。其中,与环境响应相关的元件所占比例较大,例如低温应答元件、光响应元件、真菌诱导调节元件、热胁迫响应元件等等。此外,pFtMYC中还存在一些其他类型的元件,如激素应答元件、蛋白结合位点以及分生组织表达相关应答元件。以上表明,多种环境因子均可调控苦荞FtMYC基因的表达。
3 讨论与结论
MYC蛋白属于bHLH家族的转录因子,该类转录因子在动植物体内具有多种生物学功能。MYC蛋白的N-端含有一个bHLH-MYC-N结构域,C-端含有一个结合目的基因启动子中E-box的bHLH型DNA结合域,MYC蛋白主要通过结合靶标基因启动子序列中E-box元件的保守序列CAC(G/A)TG来调节基因的表达[8]。本研究利用苦荞转录组数据成功克隆得到1个bHLH家族的转录因子基因FtMYC,因其编码的氨基酸序列N-端和C-端区域分别包含有MYC转录因子典型的保守结构域,这表明FtMYC属于bHLH转录因子中MYC家族的一个成员。
植物bHLH转录因子能够参与调控多种生理途径,如花器官发育、光形态建成、植物抗逆等,其中调节类黄酮和花青素合成是植物bHLH转录因子最重要功能之一[10]。系统进化树分析显示(见图4),FtMYC和VvMYCA1等参与花青素调控的转录因子共聚一簇,推测FtMYC可能具有类似的调控功能。在UV-B和4℃冷胁迫处理条件下,FtMYC在苦荞二叶期胚轴和子叶中的表达量均表现出一定程度上调趋势,相比之下在子叶中变化趋势更为显著,这种结果表明FtMYC在苦荞二叶期更倾向于在子叶中发挥调控作用。与此同时,当FtMYC在两个组织中的表达量达到最大值后在都出现了不同程度下降的趋势,可能是因为植物本身存在自我修复机制,在遭到外界胁迫一定时间后通过该机制来维持机体的代谢平衡[11]。众所周知,花青素对UV-B波段存在特定吸收波长,能有效降低UV-B辐射在表皮层的透过率,从而减轻UV-B对植物器官与组织的伤害[12]。而当植物处于极端温度逆境下,主要通过影响细胞的膜结构从而产生氧化胁迫[13],由于花青素本身具有较强的抗氧化作用,因此花青素在植物组织中的积累可以增强其对于极端环境的耐受性[14]。例如,苹果MdbHLH3转录因子能在低温条件下会特异性结合MdDFR和MdUFGT基因启动子序列,通过上调花青素支路的关键基因的表达促进苹果中花青素的积累[15]。本研究中除了4℃冷处理下FtMYC表达量与苦荞胚轴中花青素含量变化没有明显的相关性(r=0.744)外,其他条件下均显著性相关。由此可知,FtMYC也可能通过类似的调控机制实现了苦荞体内花青素的积累,以此来应对外界的非生物逆境胁迫。
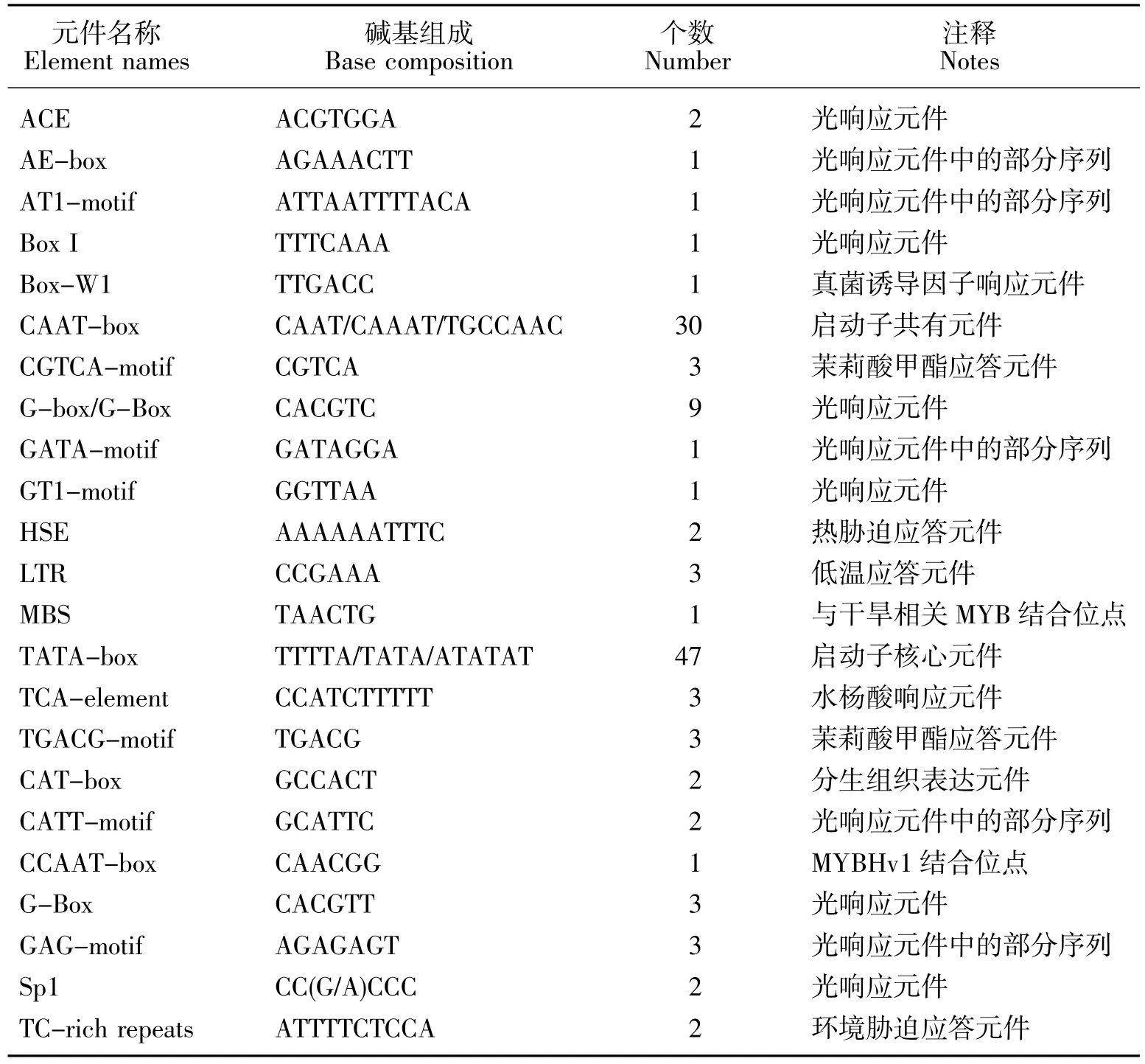
表2 pFtMYC所含主要元件分析Table 2 Component analysis of pFtMYC
转录水平的调控是植物基因表达调控的一种重要方式,而启动子作为执行转录水平调控的主要顺式作用元件,能应答多种环境的变化[16]。转录因子对环境刺激的响应主要是通过其启动子上各类响应元件实现的[17],Yao P.F.等[18]对pFtbHLH3研究结果显示,干旱胁迫处理会提高pFtbHLH3下游报告基因的表达量。本研究在对FtMYC启动子的分析中发现,pFtMYC中除了含有基本的启动子转录元件外,还包含有多个与光、低温胁迫应答相关的元件,我们推测FtMYC的表达可能通过这些元件响应外界环境的刺激。本课题组后续也将对FtMYC的功能展开进一步研究,以期明晰FtMYC转录因子在苦荞花青素合成的调控机制,为提高苦荞黄酮含量的研究奠定一定的理论基础。
