木槿花生物活性物质及其抗氧化活性分析
2019-03-08黄采姣李安平李建周王晓红
黄采姣,李安平,*,李建周,王晓红
(1.中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2.特医食品加工湖南省重点实验室,湖南 长沙 410004)
木槿(Hibiscus syriacus Linn.)属锦葵科木槿属落叶灌木,又名木锦、篱障花,因其易栽培、品种多、花色漂亮,我国大部分地区均有种植。木槿花有清热、利湿、凉血等功能,且色泽艳丽、肉质肥厚、口感清香、顺滑爽口、无异味,在广东和福建等地均有食用的习俗[1-2]。有研究表明,木槿花具有较高的营养价值,不仅含有丰富的蛋白质、VC、粗纤维、矿物质等,还含有丰富的多酚类物质[3-5]。
近年来国内外对木槿的研究主要集中在其品种选育、病虫害防治和花卉的营养成分含量等方面[6-8],而关于木槿花的生物活性少见文献报道。多酚和黄酮类化合物广泛存在于植物花卉中,是一种天然抗氧化剂,是目前的研究热点之一。张福娣等[9]的研究表明扶桑花色素具有较强的抗氧化活性,且其抗氧化活性随浓度的增大而增强;李晓英等[10]比较了蓝莓花、茎、叶酚类物质含量及抗氧化活性,结果表明蓝莓叶和花的抗氧化物质分别主要是绿原酸和芦丁。本研究对不同品种木槿花的抗氧化活性和生物活性物质含量进行测定,并考察其相关性,鉴定木槿花的活性物质成分,为木槿花的深加工和开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
紫玉(Hibiscus syriacus. cv. Shigyoku)、薰衣草薄绸(Hibiscus syriacus. cv. Lavandula Chiffon)采自中南林业科技大学苗圃;木槿原种(Hibiscus syriacus L.)、雅致木槿(Hibiscus syriacus f. elegantissimus)采自益阳木槿基地;粉紫重瓣木槿(Hibiscus syriacus f.paeonif l orus)采自长沙跳马镇木槿基地。
没食子酸、水溶性VE(Trolox)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、芦丁、三吡啶三吖嗪(2,4,6-tris(2-pyridyl)-S-triazine,TPTZ)、2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)(分析纯) 美国Sigma公司;福林-酚试剂北京鼎国昌盛生物技术有限公司;硫酸亚铁、乙醇、正丁醇、乙酸乙酯、石油醚、三氯甲烷(均为分析纯)、乙腈、甲酸(均为色谱纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
QE100型高速万能粉碎机 浙江屹立工贸有限公司;YRE-5299旋转蒸发仪 巩义市予华仪器有限责任公司;UV-1800型紫外-可见光分光光度计 日本岛津公司;LGJ10型真空冷冻干燥机 北京松源华兴科技发展有限公司;JY98-IIIN型超声波破碎仪 宁波新芝生物科技有限公司;TGL-16型医用离心机 长沙平凡仪器仪表有限公司;高效液相色谱仪(high performance liquid chromatography,HPLC)、G2-XSQ-TOF型质谱(mass spectrometry,MS)仪 美国沃特世公司。
1.3 方法
1.3.1 木槿花提取液的制备
将新鲜木槿花置于55 ℃干燥箱中干燥18 h,冷却后粉碎过60 目筛,得木槿花样品。准确称取木槿花样品1.00 g,按料液比1∶36加入体积分数70%乙醇溶液混合,避光浸泡20 min,然后用21 kHz超声波辅助提取49 min,离心15 min,取上清液,残渣按相同条件重复提取2 次,合并上清液,用溶剂定容至250 mL,测定各成分含量及其抗氧化活性。
1.3.2 不同溶剂萃取液的制备
称取25.00 g木槿花样品,按1.3.1节方法制取木槿花提取液,经旋转蒸发浓缩去除乙醇,得粗提液。用X-5大孔树脂纯化,向纯化液中加入等体积石油醚,充分振荡后于分液漏斗中静置萃取,得石油醚相和水相;在水相中再加入等体积的三氯甲烷,振荡摇匀后分层,得三氯甲烷相和水相;按相同步骤,再在水相中依次加入乙酸乙酯和正丁醇,分别得到乙酸乙酯相、正丁醇相和水相。每种溶剂重复萃取5 次。将相同溶剂萃取相合并,真空浓缩,水相冷冻干燥,得到不同溶剂木槿花萃取物。各组萃取相分离流程见图1。

图1 木槿花各组分萃取相分离流程Fig.1 Flow chart of sequential solvent fractionation extract from hibiscus fl ower
1.3.3 总酚、总黄酮、花青素含量的测定
总酚含量测定参照Marialeonoralotisd等[11]的方法并略作调整。以没食子酸为标准品(0~12 μg/mL)绘制标准曲线,得到样品总酚含量回归方程y=107.66x+0.064 2(R2=0.996)。总酚含量表示为每毫克样品中相当的没食子酸质量,以干物质计。
采用硝酸铝比色法[12]测定样品中总黄酮含量。以芦丁为标准品(0~0.1 mg/mL)绘制标准曲线,得到样品总黄酮含量回归方程y=12 057x+0.003(R2=0.999 7)。总黄酮含量表示为每毫克样品中相当的芦丁质量,以干物质计。
采用pH示差法[13]测定样品中花青素含量。取待测液1 mL,分别用pH 1.0和pH 4.5的缓冲液定容至10 mL,分别测定两种溶液在700 nm和510 nm波长处的吸光度。以矢车菊素-3-葡萄糖苷为标准品,花青素含量表示为每毫克样品相当于矢车菊素-3-葡萄糖苷的质量,以干物质计,按公式(1)计算。
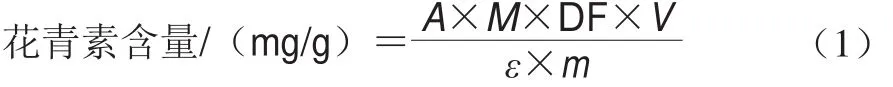
式中:A=(A510nm-A700nm)pH1.0-(A510nm-A700nm)pH4.5;M为矢车菊-3-葡萄糖苷的摩尔质量(449.2 g/mol);DF为稀释倍数(10);V为样品提取液总体积/mL;ε为样品中矢车菊-3-葡萄糖苷的摩尔吸光系数(26 900 L/(molgcm));m为样品质量/g。
1.3.4 DPPH自由基清除能力的测定
参照郑时莲[14]、Moon[15]等的方法并稍作修改。取1.0 mL样品提取液与3.0 mL DPPH溶液(0.1 mmol/L)混匀,避光反应30 min后,以无水乙醇为空白对照,于517 nm波长处测定样品的吸光度。根据Trolox对DPPH自由基清除能力的标准曲线,样品的DPPH自由基清除能力以每克样品提取液具有相同抗氧化能力所需Trolox的质量表示。DPPH自由基清除率计算如式(2)所示。
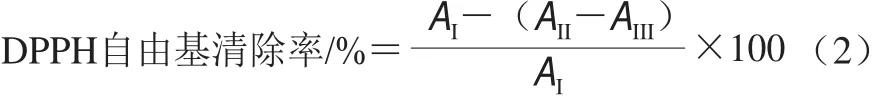
式中:AI为1 mL提取溶剂与3 mL DPPH溶液混合后在517 nm波长处的吸光度;AII为1 mL样品提取液与3 mL DPPH溶液混合后在517 nm波长处的吸光度;AIII为1 mL样品提取液与3 mL无水乙醇在517 nm波长处的吸光度。
1.3.5 总还原能力的测定
参照Benzie等[16]的方法并稍作调整。总还原能力(ferric ion reducing antioxidant power,FRAP)测定的溶液现用现配,将15 mL 300 mmol/L pH 3.6的醋酸盐缓冲液、1.5 mL 10 mmol/L TPTZ溶液、1.5 mL 20 mmol/L FeCl3溶液混合,用前预热至37 ℃。根据不同浓度FeSO4溶液做FRAP标准曲线,样品的FRAP以达到同样吸光度变化(△A)所需的FeSO4溶液的物质的量表示。取30 μL样品,加入90 μL双蒸水和0.9 mL FRAP溶液,混匀后在37 ℃反应10 min,立即测定593 nm波长处吸光度。每个样品平行测定3 次,△A越大说明FRAP越强。
1.3.6 ABTS自由基清除能力的测定
ABTS自由基清除能力参考Re等[17]的方法并稍作修改。ABTS母液的配制:准确称取0.038 4 g ABTS,用双蒸水配制成10 mL浓度为7 mmol/L的溶液,并加入0.176 mL 140 mmol/L过硫酸钾溶液,在37 ℃下避光反应12~16 h制得ABTS母液,置于4 ℃保存。使用前将其用无水乙醇稀释,使其在732 nm波长处的吸光度为0.70±0.02。将0.2 mL样品加到3.5 mL ABTS母液中反应6 min后立即测定吸光度As,每个样品重复3 次。取0.2 mL 70%乙醇溶液与3.5 mL ABTS母液混匀,作为空白对照组,测定其在732 nm波长处的吸光度,记为Ac。取0.2 mL待测样品与3.5 mL无水乙醇混匀,相同条件下,测定其吸光度A0;ABTS自由基清除率计算如式(3)所示。
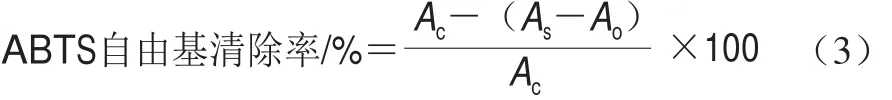
根据Trolox对ABTS自由基清除率做标准曲线,样品的ABTS自由基清除能力以每克样品提取液具有相同抗氧化能力所需Trolox的质量表示。
1.3.7 活性物质成分分析
称取干燥的正丁醇萃取物,用超纯水配成14 mg/mL溶液,0.45 μm微孔滤膜过滤后用于HPLC-MS/MS分析。
HPLC条件:C18色谱柱(250 mmh4.6 mm,0.5 μm);流动相B:乙腈,流动相A:体积分数0.1%甲酸溶液。梯度洗脱条件为:0~4 min,10%流动相B;4~7 min,10%~15%流动相B;7~15 min,15%~35%流动相B;15~17 min,35%~100%流动相B;17~18 min,100%~10%流动相B;流速0.4 mL/min,检测波长308 nm,进样量5 μL,柱温40 ℃。
MS条件:采用正离子模式;电喷雾离子源;干燥器温度400 ℃;离子源温度120 ℃;干燥气流速10 L/min;喷雾气压力344 kPa;毛细管裂解电压3.5 kV;锥孔电压40 V;扫描范围:m/z 100~1 200。根据各峰的保留时间、分子质量以及特征结构碎片,与文献中的研究结果及标准品对照进行比对鉴定。
1.4 数据统计分析
每组实验重复测定3 次,结果用 ±s表示。采用Origin 9.0软件作图,SPSS 22.0软件进行数据分析,Pearson法进行相关性分析,单因素方差分析法进行显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 不同品种木槿花提取液中生物活性物质含量
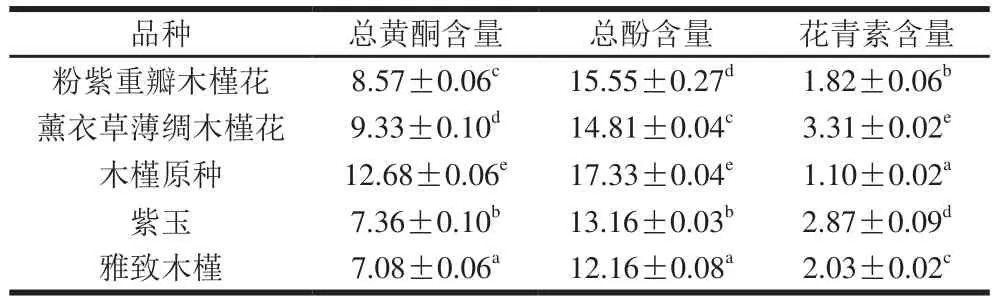
表1 不同品种木槿花提取液中总酚、总黄酮和花青素含量Table1 Contents of polyphenols, fl avonoids and anthocyanins extracted from different varieties of hibiscus fl owers mg/g
由表1可知,不同品种木槿花提取液的总酚、总黄酮和花青素含量具有显著性差异(P<0.05)。5 个品种木槿花提取液的总酚含量从高到低依次为木槿原种、粉紫重瓣木槿花、薰衣草薄绸木槿花、紫玉和雅致木槿,总黄酮含量从高到低依次为木槿原种、薰衣草薄绸木槿花、粉紫重瓣木槿花、紫玉和雅致木槿。5 个品种木槿花提取液中的总酚含量和总黄酮含量变化趋势基本一致。木槿原种的总酚和总黄酮含量明显高于其他4 个品种,分别达到了17.33 mg/g和12.68 mg/g,分别是雅致木槿(总酚和总黄酮含量分别为12.16、7.08 mg/g)的1.4 倍和1.8 倍。5 个品种木槿花提取液的花青素含量与木槿花的颜色深浅一致,颜色越深花青素含量越高[18]。5 个品种中薰衣草薄绸木槿花的颜色最深,花青素含量(3.31 mg/g)最高,木槿原种的颜色最浅,花青素含量只有1.10 mg/g,仅为薰衣草薄绸木槿花的1/3。
2.2 不同品种木槿花提取液抗氧化活性比较

表2 不同品种木槿花提取液抗氧化活性比较Table2 Antioxidant activity of hibiscus fl ower extracts from different varieties
从表2可以看出,5 种木槿花提取液的FRAP、DPPH自由基清除能力和ABTS自由基清除能力均存在显著性差异(P<0.05),且3 种方法测定的抗氧化活性变化规律具有一致性。5 种木槿花提取液抗氧化活性从高到低依次为木槿原种、薰衣草薄绸木槿花、粉紫重瓣木槿花、紫玉和雅致木槿。木槿花的抗氧化活性排序与表1显示的总酚和总黄酮含量变化规律基本相同。此结果与徐颖等[19]对不同品种苹果籽抗氧化活性的研究和白周亚等[20]对不同品种豇豆抗氧化活性研究结果一致,即总酚含量和总黄酮含量越高,相应的抗氧化活性越强。
2.3 木槿花生物活性物质含量与其体外抗氧化活性的相关性分析
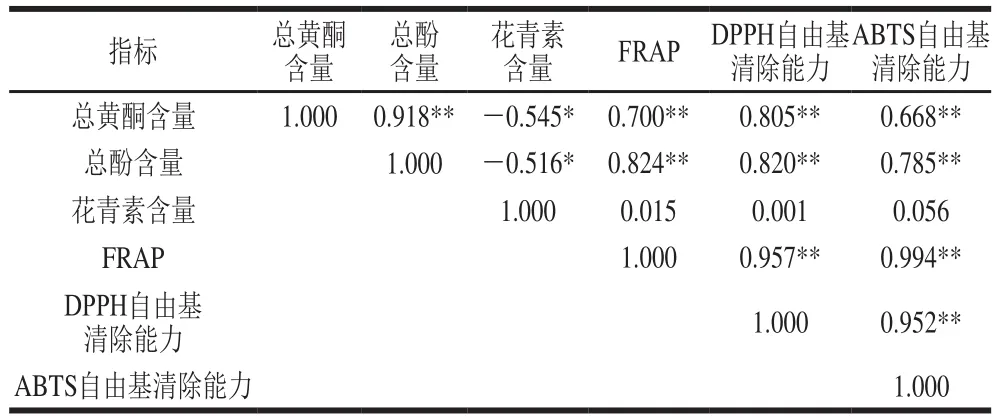
表3 木槿花生物活性物质含量与其体外抗氧化活性的相关性分析Table3 Correlations between bioactive contents and in vitro antioxidant activity of hibiscus fl ower extracts
大量研究表明,植物提取液的抗氧化活性与其生物活性物质含量之间存在一定的相关性[21-22]。FRAP、ABTS自由基清除能力和DPPH自由基清除能力是常用的几种抗氧化活性检测方法。从表3可以看出,FRAP、DPPH自由基清除能力和ABTS自由基清除能力间呈极显著的相关性(P<0.01),说明这3 种方法能基本能够一致地反映不同品种木槿花提取液的抗氧化活性。总黄酮含量、总酚含量与FRAP、DPPH自由基清除能力、ABTS自由基清除能力之间存在着极显著的相关性(P<0.01),相关系数(R2)分别为0.700、0.805、0.668和0.824、0.820、0.785。花青素含量与FRAP、DPPH自由基清除能力、ABTS自由基清除能力间的相关性不显著(P>0.05)。由此表明总黄酮和总酚在木槿花的抗氧化中起主要作用,而不是花青素。此结论与石雪萍等[23]将食用辛香料中的主要抗氧化作用归因于黄酮类物质和邵佩兰等[24]将红枣色素的抗氧化作用归因于多酚和黄酮的结论类似。因此,总黄酮和总酚含量高的木槿原种具有较强的FRAP、DPPH自由基清除能力和ABTS自由基清除能力。
2.4 不同极性溶剂木槿花萃取物抗氧化活性比较
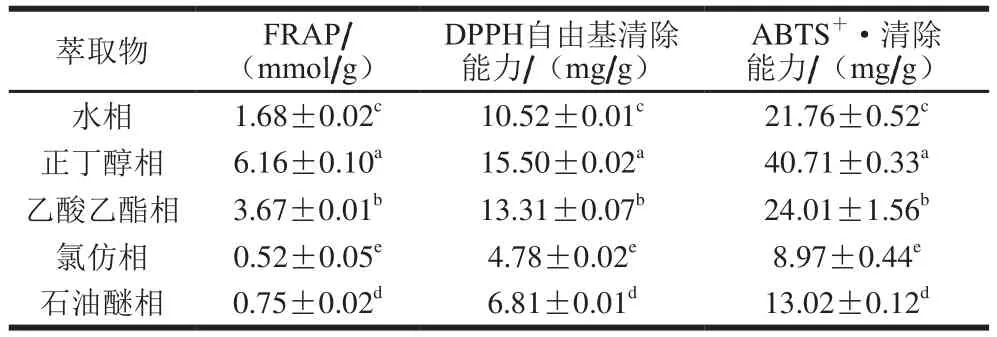
表4 不同极性溶剂木槿花萃取物的抗氧化活性比较Table4 Antioxidant activity of fraction extracted with different polar solvents extract from hibiscus fl ower
按照图1的流程,用不同极性溶剂对抗氧化活性最强的木槿原种提取液进行萃取。由表4可知,各溶剂萃取相均具有一定的抗氧化活性,且FRAP、DPPH自由基清除能力和ABTS自由基清除能力检测结果具有一致性,均表明正丁醇萃取相的抗氧化活性最强,分别达到6.16mmol/g、15.50 mg/g和40.71 mg/g,其次是乙酸乙酯萃取相和水萃取相,最弱的是氯仿萃取相。根据相似相溶原理,石油醚和氯仿极性较小,与多酚和黄酮类化合物的极性差异较大,因此萃取物较少,乙酸乙酯和正丁醇极性较大,萃取物中总酚和黄酮类化合物含量较高,相应的抗氧化活性较强。张东京等[25]在研究梨的不同极性溶剂萃取物的抗氧化活性时发现高极性溶剂萃取物的抗氧化活性更强,与本研究结果相似。
2.5 活性物质成分分析结果
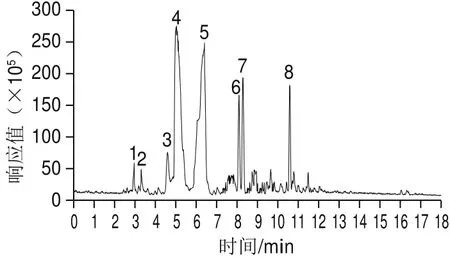
图2 木槿花正丁醇萃取物的总离子流图Fig.2 Total ion current chromatogram of the n-butanol extract from hibiscus fl ower
如图2所示,在波长308 nm处各峰基本上得到了分离,主要含有8 个色谱峰。
由表5可知,木槿原种正丁醇萃取液中含有8 种化合物:山柰酚-O-六碳糖-C-六碳糖苷、芹菜素、山柰酚-O-六碳糖-C-六碳糖苷同分异构体、芹菜素-C-二糖苷、芹菜素-葡萄糖芹糖苷、山柰酚-3-O-芸香糖苷、芹菜素-7-O-芸香糖苷、矢车菊素-3-丙二酰葡萄糖苷。

表5 各质谱峰鉴定结果Table5 Identif i cation of all mass spectral peaks
1号峰的保留时间为2.937 min,其分子离子峰[M+H]+为m/z 611.16。在其二级质谱中出现了m/z 449.11、413.00、353.07、329.06、299.06的碎片离子:其中m/z 449.11的碎片离子峰是分子离子峰m/z 611.16失去1 分子六碳糖;m/z 329.06为[M+H-162-120]+,即失去一个六碳糖基;m/z 287为[329-CH2-CO]+,即为山柰酚的母环。参照文献[26]推断1号峰可能是山柰酚-O-六碳糖-C-六碳糖苷。通过与标准品对照,证实为山柰酚-O-六碳糖-C-六碳糖苷。
2号峰的保留时间为3.330 min,其分子离子峰[M+H]+为m/z 271.05。参考文献[27]猜测其有可能是芹菜素。通过与标准品对照,证实其为芹菜素。
3号峰的保留时间为4.590 min,其分子离子峰[M+H]+为m/z 611.16。其二级质谱出现的m/z 449.11、413.00、353.07、329.06、299.06的碎片离子峰与1号峰几乎一样,因此推测3号峰可能是1号峰山柰酚-O-六碳糖-C-六碳糖苷的同分异构体[26]。
4号峰的保留时间为5.042 min,其分子离子峰[M+H]+为m/z 595.17。在其二级质谱中产生了m/z 433.00、367.07、337.07、313.07、283.05的碎片离子峰,其中m/z 433.00为[M+H-162]+的碎片离子峰有可能是其分子离子峰丢失了一个六碳糖所致,m/z 313.07可能是m/z 433.00失去一个以碳苷键连接的六碳糖而产生,依此推断母核离子应为芹菜素m/z 271.05即[313-CH2-CO]+,参考文献[26]推测该物质可能是芹菜素-C-二糖苷。通过与标准品对照,证实其为芹菜素-C-二糖苷。
5号峰的保留时间为6.379 min,其分子离子峰[M+H]+为m/z 565.16。在二级质谱中碎片离子峰m/z 295.00为分子离子峰m/z 565.16失去m/z 270.16的碎片所得,参照文献[28]推测该碎片离子峰可能是芹菜素,因此推断5号峰可能是芹菜素-葡萄糖芹糖苷。
6号峰的保留时间为8.094 min,其分子离子峰[M+H]+为m/z 595.16。在其二级质谱中有m/z 287.05的碎片离子峰,此峰为山柰酚母环;m/z 433.11为分子离子峰m/z 595.16失去一个中性片段葡萄糖苷所致,参照文献[29]推测其可能是山柰酚-3-O-芸香糖苷。
7号峰的保留时间为8.289 min,其分子离子峰[M+H]+为m/z 579.17。二级质谱中产生了m/z 433.11、337.07、313.07、283.05的碎片离子峰,m/z 433.11的碎片离子峰有可能是分子离子峰丢失了m/z 146.06的中性片段鼠李糖苷所得,而[313-CH2-CO]+即为芹菜素的母离子m/z 271.05,参考文献[26]推测该物质可能为芹菜素-7-O-芸香糖苷。
8号峰的保留时间为10.576 min,其分子离子峰[M+H]+为m/z 535.10,二级质谱中有m/z 287.05的碎片离子峰,该碎片离子峰有可能是分子离子峰丢失了m/z 248.05的丙二酰葡萄糖苷后剩下的矢车菊素的母离子,参考文献[30]推测该物质可能为矢车菊素-3-丙二酰葡萄糖苷。
以上8 种黄酮类化合物是木槿花正丁醇萃取液的主要成分,因此猜测黄酮类化合物是木槿花抗氧化活性的主要因子。
3 结 论
5 种木槿花均含有较多的多酚和黄酮类物质,具有较强的抗氧化活性。不同木槿花品种的生物活性物质含量与其抗氧化活性之间存在极显著差异(P<0.01)。5 种木槿花提取液抗氧化活性从高到低依次为木槿原种、薰衣草薄绸木槿花、粉紫重瓣木槿花、紫玉和雅致木槿。木槿原种是抗氧化活性最强的品种,也是目前国内种植最广泛的品种,这对木槿花的品种选育以及产品开发具有一定的指导意义。
通过相关性分析表明总酚含量、总黄酮含量与FRAP、DPPH自由基清除能力以及ABTS自由基清除能力间呈极显著正相关(P<0.01)。乙酸乙酯和正丁醇极性较大,萃取物中多酚和黄酮类化合物较多,相应的抗氧化活性较高;石油醚和氯仿极性较小,与多酚和黄酮类化合物的极性差异较大,因此萃取出的多酚和黄酮类化合物较少。
通过HPLC-MS/MS对正丁醇萃取液进行综合分析,初步鉴定出木槿原种花卉提取物正丁醇萃取物中抗氧化物质包括:山柰酚-O-六碳糖-C-六碳糖苷、芹菜素、山柰酚-O-六碳糖-C-六碳糖苷同分异构体、芹菜素-C-二糖苷、芹菜素-葡萄糖芹糖苷、山柰酚-3-O-芸香糖苷、芹菜素-7-O-芸香糖苷、矢车菊素-3-丙二酰葡萄糖苷,均为黄酮苷类化合物。
