叶菜根系分泌物成分鉴定及对2种结合态农药的活化差异
2019-03-03李勇龙玲余向阳
李勇 龙玲 余向阳


摘要:研究首先基于GC-TOF/MS(气相色谱飞行时间质谱联用仪)对叶菜根系分泌物成分进行定性分析,然后选取单一根系分泌物成分如有机酸、氨基酸、糖类对土壤中结合态苯醚甲环唑和吡虫啉的活化规律进行研究。试验结果表明,基于GC-TOF/MS分析叶菜根系分泌物样品共检测出535个特征质谱峰,基于FiehnBinbase数据库共定性出的75个化合物,包括糖醇类20个、氨基酸类6个、有机酸类31个、脂肪酸类10个、其他类8个。不同根系分泌物对土壤中2种结合态农药的活化差异存在显著差异,其中对结合态苯醚甲环唑的活化效果为草酸>柠檬酸>丙氨酸>甘氨酸>葡萄糖>果糖,而对结合态吡虫啉的活化效果为柠檬酸>草酸>果糖>葡萄糖>甘氨酸>丙氨酸。另外,同一根系分泌物对结合态苯醚甲环唑的活化效果要高于吡虫啉,这可能与农药的物理化学性质相关,如辛醇比分配系数(lgKow)等。研究结果对农产品安全生产以及有效地评价土壤残留农药的危害风险具有重要的理论指导意义。
关键词:根系分泌物;结合态农药;吡虫啉;苯醚甲环唑;有机酸
中图分类号: S481+.8 文献标志码: A 文章编号:1002-1302(2019)23-0222-05
我国是农业大国,农药是保障农业丰收的重要手段。然而,农业生产中高毒性、高残留、难降解农药的长期使用,致使农药大量残留于土壤、地下水和大气中,造成严重的环境污染[1-4]。农药长期残留于土壤中会与其中的有机质形成结合态残留,可以降低农药毒性,使其生物有效性低,且农药结合态残留不能被植物和微生物直接吸收降解[5-8]。农药结合态残留会受土壤环境影响转化为可提取态,其生物有效性较高,具有高毒性,会对环境再次造成危害[9-12]。Gao等研究发现,土壤种植作物根系可以向土壤中释放多种可溶性低分子活性有机物质,其与土壤中有机污染物的亲和力一般大于有机污染物与土壤有机质的亲和能力,所以可以促进土壤中结合形态农药残留的解吸,即起到了活化的作用[13]。Nardi等发现,植物根系分泌的有机酸能够活化土壤中的有机质,试验通过外加有机酸证明,低分子量有机酸能够通过螯合无机离子来部分瓦解土壤结构,从而促使结合态的有机污染物解析,提高其生物有效性[14]。Luo等通过外加有机酸试验证实,植物根系分泌物以及草酸盐都可以促进土壤中DDT(滴滴涕)结合态残留的解吸[15]。本研究拟首先基于GC-TOF/MS(气相色谱飞行时间质谱联用仪)对叶菜蔬菜根系分泌物成分进行定性分析,然后选取单一根系分泌物成分如有机酸、氨基酸、糖类对土壤中结合态苯醚甲环唑和吡虫啉的活化规律进行研究。
1 材料与方法
1.1 材料与仪器
供试蔬菜为高梗白白菜,购自福州农播王种苗有限公司。供试农药包括:吡虫啉标准品,分析纯,购买于德国Dr. Ehrenstorfer公司;苯醚甲环唑标准品,分析纯,购买于德国Dr. Ehrenstorfer公司。
主要仪器包括高效液相色谱质谱联用仪(HPLC-MS/MS),Agilent 1290-6470,USA;气相色谱飞行时间质谱联用仪(GC-TOF/MS),Agilent 7890B-LECO Chroma TOF PEGASUS HT,USA;高速离心机,TG16-WS型,长沙湘智离心机仪器有限公司;微型旋涡混合仪,WH-3,上海沪西分析仪器厂有限公司;电子天平,AP2500-0型,瑞士Ohaus;超纯水仪,Direct-R公司;ALPHA 1-2 LD plus型冷冻干燥机,德国Christ;高通量样品振荡仪,Thmorgan。
主要试剂包括:氯化钠,分析纯,西陇化工股份有限公司;乙腈,HPLC,德国Merck公司;无水硫酸镁(分析纯,成都市科龙化工试剂厂);乙二胺-N-丙基硅烷(PSA)(德国CNW Technologies);石墨化炭黑(GCB)(德国CNW Technologies);双(三甲基硅基)三氟乙酰胺(BSTFA)[含体积分数为1%的三甲基氯硅烷(TMCS)](美国REGIS Technologies);甲氧胺盐试剂(分析纯,日本TCI)。
1.2 叶菜根系分泌物的提取及定性分析
1.2.1 叶菜根系分泌物的提取 根系分泌物收集试验在江苏省农业科学院实验室中进行,供试的叶菜类蔬菜为高梗白白菜,种子经50~60 ℃的温水浸泡1 h,将浮在水面的种子挑出,剩余的种子均匀铺在上下贴有湿润滤纸的培养皿中,放于阴凉处24 h后查看长势,待出芽后,将种子播在装有营养液的塑料盒中,培养过程中按需补充营养液。水培营养液使用的营养液配方参照文献[16]。待蔬菜生长至8张叶片后,选取长势较好的1株植株,用二级蒸馏水冲洗干净,移入含 50 mL 超纯水的棕色广口瓶中,将瓶盖用锡箔纸裹住,尽量减少水分蒸发,置于光照培养箱光照24 h。将植株取出,并利用超纯水对叶菜根系进行冲洗,将冲洗液与棕色广口中剩余溶液混合,并装于50 mL试管中,冷冻于-20 ℃冰箱中,待使用。
1.2.2 根系分泌物样品的预处理 将冷冻后的根系分泌物置于冻干机中冻干,然后用2.5 mL乙腈复溶。取样本2 mL于进样瓶(已甲烷硅基化的)中,置于真空浓缩器中将提取物干燥;再加入20 μL甲氧胺盐试剂,混匀后,放入温度为80 ℃的烘箱中 30 min;再加入BSTFA 30 μL,于温度为70 ℃的烘箱中1.5 h;混匀,上机检测。取样本2 mL于进样瓶(已甲烷硅基化的)中,置于真空浓缩器中将提取物干燥;再加入 20 μL 甲氧胺盐试剂,混匀后,放入温度为80 ℃的烘箱中 30 min;再加入BSTFA 30 μL,于温度为 70 ℃ 的烘箱中 1.5 h;混匀,上机检测。
1.2.3 根系分泌物的檢测 利用GC-TOF/MS仪器对根系分泌物样品进行检测,具体仪器条件如下:色谱柱为Agilent DB-5MS毛细管柱(30 m×250 μm×0.25 μm,J & W Scientific,Folsom,CA,USA);进样量为1 μL,不分流模式;载气为氦气;前进样口吹扫流速为3 mL/min;柱流速为 1 mL/min;柱温为50 ℃保持1 min,以10 ℃/min上升至 310 ℃,保持8 min;前进样口温度为280 ℃;传输线温度为270 ℃;离子源温度为220 ℃;电离电压为70 eV;扫描方式为50~500 m/z;扫描速率为20 spectra/s;溶剂延迟为 6.1 min。
1.2.4 根系分泌物的定性分析 利用MS-DIAL软件对质谱数据进行峰提取、基线矫正、解卷积、峰积分、峰对齐等分析,然后利用FiehnBinbase数据库对质谱峰进行定性分析,包括质谱匹配及保留时间指数匹配,具体步骤参照文献[17-18]。
1.3 不同根系分泌物对土壤中结合态农药的活化
1.3.1 含结合态农药的土壤制备 土壤样品取自江苏省农业科学院大田未施药地块,将采回的土壤样品置于阴凉、通风的房间内。当土壤样品达到干燥状态时,用木锤粉碎成沫,然后过60目筛。将土置于密封的玻璃罐中,分别加入用丙酮溶解的高浓度吡虫啉或苯醚甲环唑,混匀后加入超纯水使土壤含水量为30%,置于阴凉处密封保存60 d,即得到老化后的土壤。分别称取苯醚甲环唑老化土和吡虫啉老化土10.00 g,分别置于50 mL塑料试管中,加入丙酮和二氯甲烷(体积比=1 ∶ 1),共10 mL,振荡30 min,5 000 r/min离心10 min,倒掉其提取液,再加入相同的提取液,再同上操作1遍。将提取过后的土壤晾干,磨碎,过60目筛,最终制备成含结合态农药的试验土。
1.3.2 不同根系分泌物对土壤中结合态农药的活化试验 称取试验土1.0 g置于50 mL塑料试管中,2种药剂分别称取185个样品,各加入30 mL不同浓度的草酸、柠檬酸、丙氨酸、甘氨酸、葡萄糖、果糖,浓度梯度为0.001、0.01、0.1、1.0、3.0、5.0 mg/L,对照组加入30 mL超纯水,每个样品首先涡旋2 min,置于控温摇床(250 r/min,25 ℃)振荡24 h后,离心 10 min,取上层清液和甲醇(体积比=1 ∶ 1)涡旋2 min,取 1 mL 过0.45 μm有机滤膜,待上机分析。
1.3.3 农药检测方法 本试验用LC-MS对苯醚甲环唑和吡虫啉进行检测,具体仪器参数如下:色谱柱为ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm,1.7 μm);柱温为 28 ℃;进样量为5.0 μL;流动相A为水,B为乙腈(测定吡虫啉)/甲醇(测定苯醚甲环唑)。梯度洗脱条件为0~0.8 min,90% A;0.8~1.0 min,90%~10% A;1.0~3.5 min,10% A;3.5~3.8 min,10%~90% A,3.8~5.0 min,90% A。流速为 0.3 mL/min;离子源为电喷雾离子源ESI(+);扫描模式为多反应离子监测模式(MRM);离子源温度为150 ℃;脱溶剂气温为400 ℃;电喷雾电压为3.0 kV;脱溶剂气体流速为 800 L/h。吡虫啉和苯醚甲环唑的定性及定量离子对信息见表1。
1.3.4 标准曲线的建立 精确称取吡虫啉、苯醚甲环唑标准品(精确至0.000 1 g),用甲醇溶剂配制成100 mg/L的标准液,存于4 ℃待用。然后用乙腈稀释标准母液配得5.0、2.0、1.0、0.5、0.2、0.1、0.05、0.02 mg/L系列标准溶液,以标准溶液浓度为横坐标、峰面积为纵坐标绘制标准曲线。
2 结果与分析
2.1 叶菜根系分泌物的定性分析
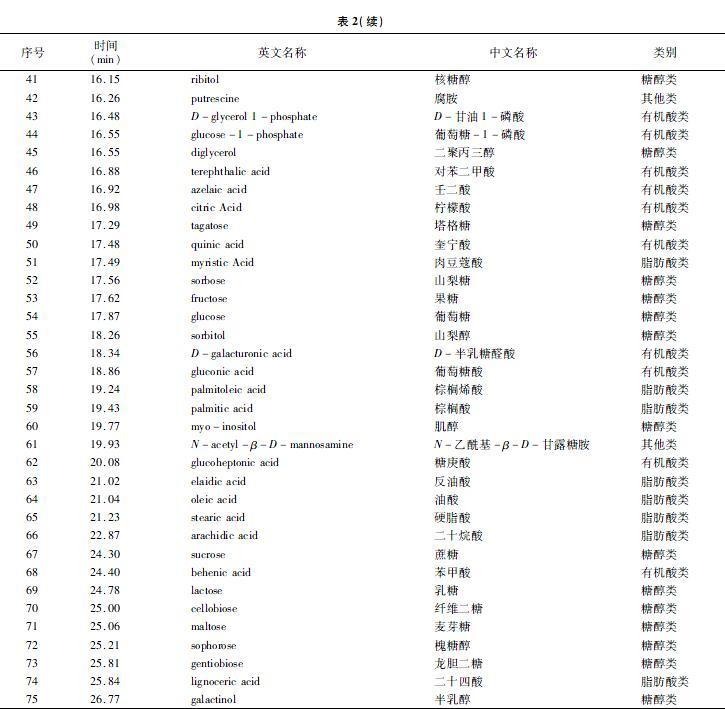
根系分泌物是指在植物生长过程中根系不同部位向根际环境中分泌或释放的各种化合物,包括低分子量的初级代谢产物和次级代谢产物,它是植物与土壤进行物质交换和信息传递的重要载体物质[8]。GC-TOF/MS测定叶菜根系分泌物的TIC(总离子流)见图1。利用MS-DIAL软件对质谱数据进行分析,共检测出535个化合物,然后基于FiehnBinbase数据库共定性出75个化合物(表2)。定性出的糖醇类化合物(20个)包括苏阿糖醇、木糖、核糖、6-脱氧-D-葡萄糖、核糖醇、二聚丙三醇、塔格糖、山梨糖、果糖、葡萄糖、山梨醇、肌醇、蔗糖、乳糖、纤维二糖、麦芽糖、槐糖醇、甘油、龙胆二糖、半乳醇;定性出的氨基酸类化合物(6个)包括缬氨酸、焦谷氨酸、苏氨酸、异亮氨酸、甘氨酸、丙氨酸;定性出的有机酸类化合物(31个)包括丙酮酸、乳酸、乙醇酸、草酸、3-羟基丁酸、丙二酸、2-羟基戊酸、甲基丙二酸、4-羟基丁酸、2-酮己二酸、磷酸、苯乙酸、琥珀酸、D-甘油酸、氢化肉桂酸、3,4-二羟基丁酸、苹果酸、水杨酸、4-氨基丁酸、苏糖酸、邻苯二甲酸、D-甘油1-磷酸、葡萄糖-1-磷酸、对苯二甲酸、壬二酸、柠檬酸、奎宁酸、D-半乳糖醛酸、葡萄糖酸、糖庚酸、苯甲酸;定性出的脂肪酸类化合物(10个)包括辛酸、癸酸、肉豆蔻酸、棕榈烯酸、棕榈酸、反油酸、油酸、硬脂酸、二十烷酸、二十四酸;定性出的其他类化合物(8个)包括2-羟基吡啶、羟胺、3-羟基吡啶、乙醇胺、尿嘧啶、胸腺嘧啶、腐胺、N-乙酰基-β-D-甘露糖胺。另外,已定性出的糖醇类、氨基酸类、有机酸类、脂肪酸类、其他类化合物分别占定性出化合物总量的26.7%、8.0%、41.3%、13.3%、10.7%,可见定性出的有机酸类化合物占比最高,这与检测仪器以及数据库容量有关系。
2.2 不同根系分泌物对土壤中2种结合态农药的活化差异
根据已鉴定出的叶菜根系分泌物,选取单一有机酸(柠檬酸、草酸)、氨基酸(丙氨酸、甘氨酸)、糖类(葡萄糖、果糖)对土壤中2种结合态农药的活化规律进行研究。试验中通过测定土壤中可提取态农药残留来判断不同根系分泌物对土壤中结合态农药的活化效果,即可提取态含量越高,表明该根系分泌物成分对土壤中结合态农药的活化效果越好。含结合态农药土壤中添加不同浓度根系分泌物后可提取态农药含量见图2,可以发现不同根系分泌物对土壤中结合态农药的活化效果差异很大。根据不同根系分泌物对土壤中结合态苯醚甲环唑的活化结果(图2-a),可知柠檬酸、草酸、丙氨酸、甘氨酸、葡萄糖5个根系分泌物成分均对土壤中结合态苯醚甲环唑存在活化效果。柠檬酸、草酸、甘氨酸的活化效果随其浓度增加而增强。6个根系分泌物中,草酸的活化效果最强,在其浓度为5.0 g/kg时,苯醚甲环唑可提取态的浓度达到了 7.80 mg/kg。在浓度为0~0.1 g/kg时,甘氨酸对结合态苯醚甲环唑的活化效果要大于柠檬酸,而二者浓度在 1.0~5.0 g/kg 时,柠檬酸对结合态苯醚甲环唑的活化效果要大于甘氨酸。丙氨酸和葡萄糖均在1.0 g/kg濃度时对土壤中结合态苯醚甲环唑的活化效果最强,此时,苯醚甲环唑可提取态的浓度分别是2.35 mg/kg和1.97 mg/kg,而后随着其浓度的增加,土壤中结合态苯醚甲环唑活化效果基本没有变化。在含结合态苯醚甲环唑的土壤中添加不同浓度果糖后,可提取态苯醚甲环唑含量无显著差异,表明果糖对结合态苯醚甲环唑没有活化效果。添加柠檬酸、草酸、丙氨酸、甘氨酸、葡萄糖后,土壤中可提取态苯醚甲环唑的平均浓度分别是2.59、347、2.27、2.12、1.97 mg/kg,其可提取态浓度分别是对照组的1.82、2.45、1.60、1.49、1.21倍。由此可以判断6个根系分泌物的活化效果为草酸>柠檬酸>丙氨酸>甘氨酸>葡萄糖>果糖。
不同根系分泌物對土壤中结合态吡虫啉的活化结果见图 2-b,可以发现6个根系分泌物成分均对土壤中结合态吡虫啉存在活化效果。柠檬酸、草酸在0~1.0 g/kg浓度时,对结合态吡虫啉的活化效果随其浓度增加而增强,而在1.0~5.0 g/kg 浓度时,对土壤中结合态吡虫啉的活化效果变化不大。葡萄糖和果糖在最高浓度时对结合态吡虫啉的活化效果最强,此时,可提取态吡虫啉浓度分别为2.56、2.64 mg/kg。甘氨酸浓度为0.1 g/kg时对土壤中结合态吡虫啉的活化效果最强,而后可提取态吡虫啉的浓度存在下降趋势。与甘氨酸类似,丙氨酸在浓度为1.0 g/kg时对土壤中结合态吡虫啉的活化效果最强。添加柠檬酸、草酸、丙氨酸、甘氨酸、葡萄糖、果糖后可提取态的苯醚甲环唑的平均浓度分别是2.58、2.50、2.30、2.32、2.41、2.47 mg/kg,其可提取态浓度分别是对照组的 1.14、1.10、1.01、1.02、1.07、1.09倍。由此可以判断6个根系分泌物成分的活化效果为柠檬酸>草酸>果糖>葡萄糖>甘氨酸>丙氨酸。
从图2还可以看出,不同根系分泌物成分对土壤中2种结合态农药的活化效果差异很大,其中,对结合态苯醚甲环唑的活化效果为有机酸>氨基酸>糖类,而对结合态吡虫啉的活化效果为有机酸>糖类>氨基酸。总体可以看出,有机酸对结合态农药的活化效果要高于糖类和氨基酸。但就柠檬酸和草酸而言,其对土壤中结合态苯醚甲环唑的平均活化效果分别是对照组的1.82倍和2.45倍,明显高于对结合态吡虫啉的活化效果的1.14倍和1.10倍。这可能与农药本身的理化性质相关,相关研究表明,辛醇比分配系数越高,土壤中结合态农药占总量的比例越高[2]。苯醚甲环唑和吡虫啉的辛醇比分配系数(lgKOW)分别为4.4和0.57,表明相比于吡虫啉,苯醚甲环唑在土壤中更易形成结合态。因此,土壤中结合态苯醚甲环唑占总量的比例高于吡虫啉。这可能导致同一根系分泌物对结合态苯醚甲环唑的活化效果要高于吡虫啉。
3 结论
本研究首先基于GC-TOF/MS对高梗白根系分泌物成分进行定性分析,共定性出75个化合物,其中包括糖醇类20个、氨基酸类6个、有机酸类31个、脂肪酸类10个、其他类8个,从其中选取柠檬酸、草酸、甘氨酸、草酸、葡萄糖和果糖对土壤中2种结合态农药的活化规律进行研究,研究结果表明,不同根系分泌物对土壤中2种结合态农药的活化效果存在显著差异,其中对结合态苯醚甲环唑的活化效果为草酸>柠檬酸>丙氨酸>甘氨酸>葡萄糖>果糖,而对结合态吡虫啉的活化效果为柠檬酸>草酸>果糖>葡萄糖>甘氨酸>丙氨酸。另外,同一根系分泌物对结合态苯醚甲环唑的活化效果要高于吡虫啉,这可能与农药的物理化学性质相关,如辛醇比分配系数(lgKow)等。
参考文献:
[1]Gevao B,Semple K T,Jones K C. Bound pesticide residues in soils:a review[J]. Environmental Pollution,2000,108(1):3-14.
[2]郜红建,蒋 新. 土壤中结合残留态农药的生态环境效应[J]. 生态环境,2004,13(3):399-402.
[3]Wang X J,Piao X Y,Chen J,et al. Organochlorine pesticides in soil profiles from Tianjin,China[J]. Chemosphere,2006,64(9):1514-1520.
[4]曾跃春,高彦征,凌婉婷,等. 土壤中有机污染物的形态及植物可利用性[J]. 土壤通报,2009,40(6):1479-1484.
[5]Kelsey J W,Alexander M. Declining bioavailability and inappropriate estimation of risk of persistent compounds[J]. Environmental Toxicology and Chemistry,1997,32(3):892-902.
[6]王海珍,陈建明,谢正苗,等. 土壤中14C-甲磺隆存在形态的动态研究[J]. 土壤学报,2001,38(4):547-557.
[7]Feth Z H,Catherine S,Thierry H,et al. Root exudates mediated interactions belowground[J]. Soil Biology & Biochemistry,2014,77:69-80.
[8]Lori A P,Charles W G,Richard E F,et al. Plant root exudates impact the hydrocarbon degradation potential of a weathered-hydrocarbon contaminated soil[J]. Applied Soil Ecology,2012,52:56-64.
[9]Rogier F D,Leendert C,Peter A H. Impact of root exudates and plant defense signaling on bacterial communities in the rhizosphere:a review[J]. Agronomy for Sustainable Development,2012,32(1):227-243.
[10]Valerie V,Klement R,Keith S,et al. Methods of collection of plant root exudates in relation to plant metabolism and purpose:a review[J]. Journal of Plant Nutrition and Soil Science,176(2):175-199.
[11]Ulrike B,Enrico M. Root exudates:the hidden part of plant defense
[J]. Trends in Plant Science,2014,19(2):90-98.
[12]White J C. Differential bioavailability of field-weathered p,p′-DDE to plants of the Cucurbita and Cucumis genera[J]. Chemosphere,2002,49(20):143-152.
[13]Gao Y,Ren L,Ling W,et al.Desorption of phenanthrene and pyrene in soils by root exudates[J]. Bioresource Technology,2010,101(4):1159-1165.
[14]Nardi S,Reniero F,Concheri G. Soil organic matter mobilization by root exudates of three maize hybrids[J]. Chemosphere,1997,35(10):2237-2244.
[15]Luo L,Zhang S Z,Shan X Q,et al. Oxalate and root exudates enhance the desorption of p,p′-DDT from soils[J]. Chemosphere,2006,63(8):1273-1279.
[16]Li Y,Yang L,Yan H,et al. Uptake,translocation and accumulation of imidacloprid in six leafy vegetables at three growth stages[J]. Ecotoxicology and Environmental Safety,2018,164:690-695.
[17]Tsugawa H,Cajka T,Kind T,et al. MS-DIAL:data-independent MS/MS deconvolution for comprehensive metabolome analysis[J]. Nature Methods,2015,12(6):523-526.
[18]Li Y,Long L,Ge J,et al. Effect of imidacloprid uptake from contaminated soils on vegetable growth[J]. Journal of Agricultural and Food Chemistry,2019,67(26):7232-7242.
收稿日期:2019-09-17
基金項目:国家重点研发计划(编号:2016YFD0200203);江苏省自然科学基金(编号:BK20160576);国家自然科学基金(编号:31601665)。
作者简介:李 勇(1987—),男,黑龙江鹤岗人,博士,副研究员,主要从事农产品质量安全研究。E-mail:liyong_213@163.com。
通信作者:余向阳,博士,研究员,主要从事农产品质量安全研究。E-mail:yuxy@jaas.ac.cn。
