苦皮藤愈伤组织诱导体系建立
2019-03-03王鹏郭文英王文静
王鹏 郭文英 王文静


摘要:以苦皮藤嫩茎、腋芽、幼嫩叶、成熟叶为材料,开展苦皮藤愈伤组织诱导体系建立研究。结果表明:(1)2,4-二氯苯氧乙酸(2,4-D)有利于嫩茎、腋芽和幼嫩叶愈伤组织的诱导,且随着浓度的升高(0.5 mg/L→2.0 mg/L)诱导率逐渐增大,浓度为MS+2.0 mg/L 2,4-D的激素组合能使嫩茎、腋芽和幼嫩叶产生最大的愈伤组织诱导率,分别为46.5%、66.6%、20.5%。(2)一定浓度水平的萘乙酸(NAA)和激动素(KT)组合,有利于腋芽和幼嫩叶愈伤组织的形成,诱导腋芽产生愈伤组织的最佳激素组合为MS+0.5 mg/L NAA+0.5 mg/L KT,诱导率为15.5%;诱导幼嫩叶产生愈伤组织的最佳激素组合为MS+1.0 mg/L NAA+0.2 mg/L KT,诱导率为18.5%。(3)幼嫩的外植体(嫩茎、嫩叶)较成熟的外植体(嫩茎下端枝条、成熟叶)容易产生愈伤组织。(4)在嫩茎和腋芽作为外植体时,a培养较b培养对外植体的诱导率要高;当叶片作为外植体时,b培养的愈伤组织诱导率要大于a培养。
关键词:苦皮藤;愈伤组织诱导;激素组合;诱导率
中图分类号: Q943.1 文献标志码: A 文章编号:1002-1302(2019)23-0092-04
苦皮藤(Celastrus angulatus Max.)是卫矛科(Celastraceae)南蛇藤属(Celastrus)植物,主要分布在我国黄河流域和长江流域[1]。据笔者调查,苦皮藤在河南伏牛山区海拔800 m左右的灌木丛中广泛分布,在海拔超过2 000 m的深山也有分布。苦皮藤自古以来在我国民间就已被使用,利用其根皮经阴干磨制成粉末,用少许施于蔬菜叶面或菜心防治蔬菜害虫,效果明显。据吴文君研究,苦皮藤根皮和叶中含有杀虫的活性物质,其活性成分主要是一大类具有β-二氢沉香呋喃骨架的倍半萜多元醇酯类化合物[2]。这种活性成分对昆虫具有拒食、麻醉、毒杀的作用。由于这种活性成分来源于植物苦皮藤,能够快速降解,对人畜低毒[3],不污染环境,是无公害蔬菜理想的杀虫药物。但是,传统的使用方法要采挖大量的苦皮藤树根,未免造成植被破坏、水土流失,破坏生态环境。利用植物组织培养的方法,从愈伤组织合成的次生代谢产物中进行提取和应用,国内外皆有成功的案例报道[4-12],但从苦皮藤植物组织培养的愈伤组织中提取β-二氢沉香呋喃骨架的倍半萜多元醇酯类化合物鲜有报道。因此,利用苦皮藤植物组织培养的方法,开展对苦皮藤愈伤组织诱导研究,为苦皮藤活性成分提取的工厂化生产奠定基础,对开发利用苦皮藤植物资源具有现实和深远的意义[12]。
1 材料与方法
1.1 试验材料
苦皮藤嫩茎、腋芽、幼嫩叶、成熟叶(枝条下部叶片)。
1.2 试验方法
1.2.1 培养基制作 以MS为基础培养基,加入不同浓度的萘乙酸(NAA)、2,4-二氯苯氧乙酸(2,4-D)、激动素(KT)和6-苄氨基嘌呤(6-BA),作为不同的处理:
A1-1:MS+0.2 mg/L NAA,A1-2:MS+0.5 mg/L NAA,A1-3:MS+1.0 mg/L NAA;
B1-1:MS+0.5 mg/L 2,4-D,B1-2:MS+1.0 mg/L 2,4-D,B1-3:MS+2.0 mg/L 2,4-D;
C1-1:MS+0.2 mg/L KT, C1-2:MS+0.5 mg/L KT,C1-3:MS+1.0 mg/L KT;
D1-1:MS+0.5 mg/L 6-BA,D1-2:MS+1.0 mg/L 6-BA,D1-3:MS+2.0 mg/L 6-BA;
E1-1:MS+0.2 mg/L NAA+1.0 mg/L KT,E1-2:MS+0.5 mg/L NAA+0.5 mg/L KT,E1-3:MS+1.0 mg/L NAA+0.2 mg/L KT。
1.2.2 材料处理 5月中旬从大田取回正在生长中的1年生枝条,用湿毛巾包裹带回实验室。将带叶片的枝条用流水冲洗干净,做以下处理:(1)将嫩茎部分剪切成5 cm长的茎段,放入装有少量蒸馏水的烧杯中待用(编号为Ⅰ号烧杯);(2)将枝条的腋芽用锋利的小刀取下,放入盛有少量蒸馏水的烧杯中待用(编号为Ⅱ号烧杯);(3)将枝条顶部的幼嫩叶带叶柄剪下,放入盛有少量蒸馏水的烧杯中待用(编号为Ⅲ号烧杯);(4)将枝条下部的叶(成熟叶)带叶柄剪下,放入盛有少量蒸餾水的烧杯中待用(编号为Ⅳ号烧杯)。
1.2.3 材料灭菌 在超净工作台中将Ⅰ号烧杯中的茎段放入装有70%乙醇的烧杯中,灭菌10 s,取出用无菌水冲洗3次,每次20~30 s;再将茎段放入装有0.1% HgCl2的烧杯中浸泡 10 min,每2 min用玻璃棒搅拌1次;0.1% HgCl2灭菌后,用无菌水冲洗3次,每次20~30 s;冲洗后用无菌滤纸吸干水分,放入无菌培养皿中待用。
Ⅱ号烧杯中的腋芽灭菌与上述方法相同;Ⅲ号烧杯中的幼嫩叶和Ⅳ号烧杯中的成熟叶用70%乙醇灭菌5 s,其他均按照上述方法灭菌处理。
1.2.4 接种 嫩茎接种:在无菌培养皿中,将灭菌的嫩茎段用手术刀切去两端长1~2 mm部分(切去因灭菌造成伤害的部分),剩余部分切成长4~5 mm的茎段(均不带腋芽,腋芽另做处理)。用镊子将切好的茎段轻轻插入培养基(A1-1、A1-2、…、E1-2、E1-3)中,深约2 mm,盖好瓶盖。每个处理接种20瓶。
腋芽接种:用镊子将灭菌的腋芽轻轻剥去芽鳞,去掉带有的少量木质部,芽眼朝上接种于培养基(A1-1、A1-2、…、E1-2、E1-3)的表面。每个处理接种20瓶。
幼嫩叶的接种:将消过毒的嫩叶在培养皿中用剪刀剪成0.5 cm×0.5 cm左右的小叶片,接种于培养基(A1-1、A1-2、…、E1-2、E1-3)的表面;每个处理接种20瓶。
成熟叶片接种:在培养皿中将灭菌的叶片用剪刀剪成 0.5 cm×0.5 cm左右的小叶片,接种于培养基(A1-1、A1-2、…、E1-2、E1-3)的表面。每个处理接种20瓶。
1.2.5 培养 采用a培养和b培养2种培养方法。a培养:按种后,将幼嫩茎、腋芽、幼嫩叶、成熟叶4种器官的不同处理各拿出10瓶,放入人工智能气候培养箱中,1 d内设置不同时段的培养时间、光照度、温度、湿度进行培养:2 h、500 lx、18 ℃、85%;2 h、1 000 lx、20 ℃、85%;8 h、1 500 lx、25 ℃、85%;2 h、1 000 lx、20 ℃、85%;2 h、500 lx、18 ℃、85%;8 h、0 lx、15 ℃、85%。每天如此循环。
b培养:将各处理剩下的10瓶直接放在培养架上,采用自然气候培养。待有愈伤组织生成后再放入培养箱中培养,1 d 内设置不同时段的培养时间、光照度、温度、湿度:2 h、500 lx、18 ℃、85%;2 h、1 000 lx、20 ℃、85%;8 h、1 500 lx、25 ℃、85%;2 h、1 000 lx、20 ℃、85%;2 h、500 lx、18 ℃、85%;8 h、0 lx、15 ℃、85%。每天如此循环。
2 结果与分析
2.1 苦皮藤嫩茎愈伤组织诱导
在培养7 d后调查a培养时发现,有3/10的茎段出现不同程度的褐化现象,为了避免褐化程度加重,将所有处理的茎段转接到与之相同处理的新培养基中。经过15 d的培养,还有3/10的茎段有褐化现象产生,为防止褐化的发展,再次将所有茎段转接到与之相同处理的新的培养基中,以后个别发生褐化,按照同样的方法转接。经30、45、60 d诱导培养后,调查结果如表1所示。
b培养在前7 d没有发现褐化,15 d时有2/10瓶产生褐化,为防止褐化的发展,按上述方法进行转接。经30、45、60 d诱导培养后,调查结果如表1所示。
由表1可以看出,A1-1、C1-1、C1-2、C1-3、D1-1、D1-2、D1-3、E1-1 8种处理在30~60 d的a、b 2种培养中都没有愈伤组织生成。A1-2、A1-3、E1-2、E1-3 4种处理在a培养 60 d 时才有少部分茎段生成愈伤组织,诱导率分别为1.2%、12%、2.5%、4.8%,生成愈伤组织的部位均在茎的顶端;在b培养中,A1-2、A1-3、E1-2、E1-3 4种处理只有E1-3在培养 60 d 后有少量愈伤组织生成,诱导率为1.4%,A1-2、A1-3、E1-2 3种处理均无愈伤组织产生。
从表1还可以看出,产生愈伤组织效果比较明显的是B1-1、B1-2、B1-3处理。处理B1-1在a培养45 d时有少量愈伤组织生成,60 d时诱导率达到4.8%,但在b培养中60 d时诱导率只有2.2%;B1-2、B1-3处理在a培养的15 d就有少量愈伤组织生成,30 d时分别达到2.2%、6.4%,45 d时诱导率分别达到8.6%、14.5%,60 d时诱导率分别达24.5%、46.5%;但在b培养中,B1-1处理在60 d时诱导率只有2.2%,B1-2、B1-3处理45 d时诱导率分别达到4.4%、5.2%,60 d时分别达 7.6%、12.5%。
注:诱导率为生成愈伤组织器官个数占该处理接种器官个数的百分比;处理A1-1、C1-1、C1-2、C1-3、D1-1、D1-2、D1-3、E1-1因60 d内a培养、b培养2种培养方法均没有诱导出愈伤组织而在表中省略。以下凡是在60 d调查时无愈伤组织生成的均省略。
综上所述,可得出如下结论:(1)低浓度的NAA不能诱导嫩茎愈伤组织产生,随着NAA浓度的升高有少量愈伤组织被诱导;0.2~1.0 mg/L KT、0.5~2.0 mg/L 6-BA和 0.2 mg/L NAA+1.0 mg/L KT组合均不能诱导嫩茎愈伤组织生成;2,4-D有利于嫩茎愈伤组织的诱导,且随着浓度的升高诱导率逐渐增大;(2)产生愈伤组织的部位均在嫩茎的顶端,发生褐化的嫩茎则无愈伤组织生成;(3)a培养较b培养容易产生愈伤组织。
2.2 苦皮藤腋芽愈伤组织诱导
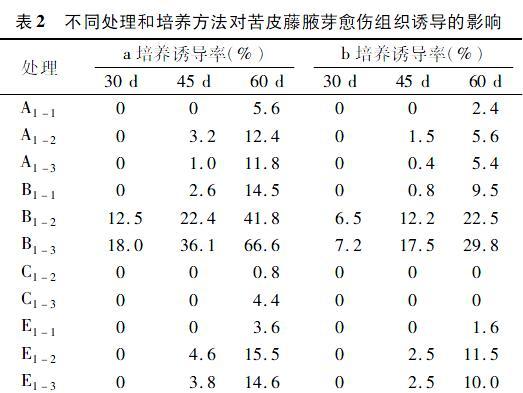
腋芽培养7 d时进行观察,少部分带有皮层的腋芽的周围培养基有变褐的现象,为了防止褐化的蔓延,及时进行转接,并切除皮层部分。经过30、45、60 d的培养,结果如表2所示。
从表2可以看出,a培养在培养30 d时,B1-2和B1-3处理有愈伤组织生成,诱导率分别为12.5%、18.0%;培養45 d时,处理A1-2、A1-3、B1-1、B1-2、B1-3、E1-2、E1-3均有愈伤组织生成,B1-2、B1-3处理诱导率较高,分别为22.4%、36.1%;当培养到60 d时,除C1-1、D1-1、D1-2、D1-3处理仍没有愈伤组织产生外,其他处理均有愈伤组织产生,以处理B1-3诱导率最高,为66.6%,处理B1-2次之,为41.8%,其次是E1-2、E1-3、B1-1、A1-2、A1-3,诱导率分别为15.5%、14.6%、14.5%、12.4%、11.8%。结果表明,a培养中,B1-3激素水平MS+2.0 mg/L 2,4-D最有利于愈伤组织形成,其次是B1-2的 MS+1.0 mg/L 2,4-D的激素水平。
在b培养中,除了C1-1、C1-2、C1-3、D1-1、D1-2、D1-3处理在培养60 d时仍没有愈伤组织生成外, 其他处理均有愈伤组织生成,其中B1-2、B1-3处理效果较佳,在诱导30 d时就分别有6.5%、7.2%的愈伤组织生成,60 d时愈伤组织的诱导率分别达22.5%、29.8%。其次是A1-2、A1-3、B1-1、E1-2、E1-3处理,在培养45 d时都有不同比例的愈伤组织生成,在培养60 d时以E1-2、E1-3、B1-1处理的诱导率较高,分别为 11.5%、10.0%、9.5%。结果表明,b培养中,B1-2、B1-3处理的激素组合有利于腋芽愈伤组织的产生,但诱导率低于a培养。
通过对没有产生愈伤组织的腋芽的观察发现,大部分腋芽都有膨大的现象。对膨大的芽和产生愈伤组织的芽的解剖来看,膨大的芽芽鳞光亮、圆浑,芽内的幼叶发生皱褶和肥厚,生长点增厚;产生愈伤组织的芽起初也是芽鳞先膨大,愈伤组织产生的位置是幼叶的边缘,生长点处只是出现不规则的增厚。
2.3 苦皮藤幼嫩叶片愈伤组织诱导
当把嫩叶接入培养基后,a培养3 d就有叶片开始发褐,7 d 已经有2/10的叶片边缘发生浅褐色,部分叶片周围的培养基变为褐色。将有培养基变为褐色的叶片转接到同样处理的新培养基中,以防褐化继续蔓延。b培养中,到培养15 d时有1/10的叶片逐渐变褐,也将有叶片周围培养基变为褐色的叶片转接到同样处理的新的培养基中。以后遇到同样的情况,均照此方法处理,减少褐化的发生。经过30、45、60 d的观察,结果如表3所示。
所有叶片在培养到30 d时,均没有愈伤组织生成。30 d后只有个别处理才陆续生成愈伤组织,且产生愈伤组织的部位少部分在皱缩增厚的叶片边缘,大部分在叶片的主脉位置。从表3可以看出,在培养到45 d时,2种培养方法的B1-2、B1-3、E1-2、E1-3 4个处理均有愈伤组织生成,a培养的B1-2、B1-3、E1-2、E1-3处理的诱导率分别为5.2%、8.8%、4.5%、8.4%,相比之下,B1-3处理和E1-3处理的诱导率高于其他2个处理;b培养在45 d观察时,B1-2、B1-3、E1-2、E1-3处理的诱导率分别为12.6%、18.9%、12.5%、13.8%,相比之下B1-3处理的诱导率最高。在培养到60 d时,a培养的B1-2、B1-3、E1-2、E1-3处理的诱导率分别为8.4%、12.2%、5.6%、10.4%,4种处理在b培养的条件下诱导率分别为14.2%、20.5%、16.2%、18.5%,相比之下b培养的B1-3处理诱导率最高。综上所述,B1-3的激素组合(2.0 mg/L 2,4-D)与E1-3的激素组合(1.0 mg/L NAA+0.2 mg/L KT)均有利于嫩叶愈伤组织的形成;在相同的培养时间内,b培养的诱导率总是大于a培养的诱导率,可能原因是a培养的光照度大于b培养,在培养前期光照度越大,越不利于愈伤组织的生成;即使最佳激素组合愈伤组织的诱导率也不高(最高为20.5%),这可能与大部分叶片愈伤组织形成的部位只在中脉处有关。
2.4 苦皮藤成熟叶愈伤组织诱导
当把成熟叶接入培养基后发现,培养3 d就开始有叶片变褐,由叶片的边缘逐渐向内部延伸,采用转接的方法尽量减缓褐化的进度。经30、45、60 d培养,不同处理和不同的培养方法对成熟叶愈伤组织的影响情况如表4所示。
由表4可以看出,对愈伤组织的诱导只有B1-2、B1-3、E1-2、E1-3 4个处理才有,且在30 d前没有任何愈伤组织产生。在45 d观察时,不同处理在a、b 2种培养条件下的诱导率明显不同,B1-2处理的诱导率分别为2.5%、4.3%,B1-3处理的诱导率分别为3.2%、6.6%,E1-2和E1-3处理的诱导率分别为1.2%、2.5%和2.6%、4.8%,显而易见,b培养的诱导率要大于a培养。在60 d观察时,不同处理在a、b 2种培养条件下的诱导率也不同,b培养的诱导率大于a培养。结果表明:(1)对成熟叶的诱导,前期培养光照度和温度的不同,会影响到诱导率,光照度过大、温度过高会降低叶片愈伤组织的诱导率;(2)愈伤组织产生的时间都在30 d后,产生的部位为叶的中脉位置,开始时生成白色的愈伤组织颗粒,后逐渐加大;(3)成熟叶片的愈伤组织诱导率小于幼嫩叶片的愈伤组织诱导率。
观察中发现,30 d时,有的叶片从外观上看已经呈现褐色,但到45 d观察时又在叶脉处产生了愈伤组织,45 d观察时依然没有产生愈伤组织的变褐叶片,在60 d观察时居然又在叶脉处生成了愈伤组织,说明叶片呈现褐色不代表叶片中脉的细胞死亡,因此要耐心等待。
3 讨论与结论
外植体不同,产生愈伤组织的能力和部位不同。幼嫩的外植体(嫩茎、嫩叶)较成熟的外植体(嫩茎下端枝条、成熟叶)容易产生愈伤组织。腋芽(最高66.6%)较嫩茎(最高46.5%)对愈伤组织的诱导率要高。叶片产生愈伤组织的部位大部分在叶的中脉和中脉两侧位置,嫩茎产生愈伤组织的部位在茎的顶端。这种现象除了与外植体内外激素有关外,还可能与器官的内部组织结构有关。根据植物茎器官的结构,在木質部和韧皮部之间的形成层细胞具有较强的细胞分裂能力[13],因此靠近嫩茎顶端的组织因分化程度低极易产生愈伤组织。叶脉的主脉结构也是由木质部和韧皮部组成[14],形成层细胞也具有较强的活力,也是容易生成愈伤组织的部位。芽是由幼叶、叶原基和生长点组成,从结构组成来看还处于原生结构和初生结构阶段,其细胞也具有较强的分裂能力[15],也是易形成愈伤组织的部位。对于成熟的器官来说,活细胞在激素的诱导下才能脱分化恢复分裂能力,因此要形成愈伤组织需要经过诱导期、分裂期这样一个过程[16]。
培养条件不同,产生愈伤组织的能力不同。在嫩茎和腋芽作为外植体时,a培养较b培养对外植体的诱导率要高。当叶片作为外植体时,b培养的愈伤组织诱导率要大于a培养。培养条件除了激素水平外,还有温度、光照度、湿度等因素[17]。a培养是在培养箱中进行,温度、光照度、湿度的大小和时间是人工设置的,有固定的规律性变化,这种条件使组织结构比较完整、保护组织比较发达的嫩茎和腋芽容易产生愈伤组织。b培养前期的培养温度、光照度、湿度没有相对规律性的变化,尤其是室内光照度在0~550 lx之间,湿度更低。从比较分析来看,强光照比弱光照容易使组织褐化,不利于愈伤组织的诱导[18]。叶的组织结构简单,保护组织不够发达,对光照敏感,较强的光照易使其褐化[18]。因此,a培养较b培养容易使嫩茎和腋芽产生愈伤组织;b培养较a培养容易使叶片产生愈伤组织。
不同的激素水平,对愈伤组织的诱导差异明显[19-20]。研究表明,生长素2,4-D在多数情况下都能成功地诱导愈伤组织[21],在本试验中,2,4-D有利于嫩茎和腋芽愈伤组织的诱导,且随着浓度的升高诱导率逐渐增大,最大诱导率浓度为MS+2.0 mg/L 2,4-D;如果2,4-D的浓度大于2.0 mg/L,是否还能增大诱导率,有待于下一步的研究。NAA作为常用的生长素,如果像2,4-D一样单独使用,不能诱导出叶的愈伤组织,在嫩茎和腋芽作为外植体时,只有部分能够诱导出愈伤组织,这与对小麦胚的愈伤组织诱导的研究结果[22]相吻合。KT和6-BA都是常用的細胞分裂素,但两者单独使用也不能诱导出愈伤组织(处理C:MS+0.2→1.0 mg/L KT,处理D:MS+0.5→2.0 mg/L 6-BA),无论是嫩茎、腋芽还是叶都是这样。试验表明,一定浓度水平的NAA和KT组合,有利于腋芽愈伤组织的形成,本试验的最佳激素组合和水平是MS+0.5 mg/L NAA+0.5 mg/L KT。有利于诱导叶产生愈伤组织的最佳激素组合和水平是MS+2.0 mg/L 2,4-D和 MS+1.0 mg/L NAA+0.2 mg/L KT。参考文献:
[1]中国科学院《中国植物志》编辑委员会.中国植物志[M]. 北京:科学出版社,2004.
[2]吴文君. 植物杀虫剂苦皮藤素研究与应用[M]. 北京:化学工业出版社,2011.
[3]Yin W P,Zhao T Z,Fu J G. Chinese bittersweet alkaloid Ⅲ,a new compound from Celastrus angulatus[J]. Journal of Asian Natural Products Research,2001,3(3):183-189.
[4]李 琰,冯俊涛,王永宏,等. 培养基及培养条件对雷公藤愈伤组织生长和次生代谢产物含量的影响[J]. 林业科学,2010,46(5):64-69.
[5]唐建军,项田夫,张禄源,等. 植物次生代谢、离体培养条件下次生代谢物积累及其调控研究进展[J]. 中国野生植物资源,1998,17(4):1-6.
[6]孔祥海. 植物次生代谢物的细胞培养技术研究进展[J]. 龙岩学院学报,2005,23(6):60-63,76.
[7]吕春茂,范海延,姜 河,等. 植物细胞培养技术合成次生代谢物质研究进展[J]. 云南农业大学学报,2007,22(1):1-7.
[8]谷荣辉,洪利亚,龙春林. 植物细胞培养生产次生代谢物的途径[J]. 植物生理学报,2013,49(9):869-881.
[9]刘进平,吴佳静,黄艳丽,等. 海南粗榧外植体灭菌与愈伤组织诱导[J]. 热带农业科技,2010,33(1):39-41.
[10]谢植干. 杀虫植物鸦胆子组织培养和生物活性的初步研究[D]. 南宁:广西大学,2008.
[11]白雪芳,王靖楣,卜宗式,等. 三尖杉悬浮细胞的培养及抗癌生物碱的产生[J]. 中国生化药物杂志,1999,20(3):139-142.
[12]王 鹏,王文静,黄 杰. 苦皮藤植物组织培养研究现状与前景展望[J]. 现代牧业,2017,1(4):33-38.
[13]钱 雪. 2种丁香属植物营养器官解剖结构及生理指标研究[D]. 长春:吉林农业大学,2017.
[14]谢兆森,杜鸿儒,李建宝,等. 组织透明法观察葡萄叶片生长过程中气孔与叶脉形态结构特征变化[J]. 植物生理学报,2018,54(2):237-246.
[15]张俊苗,李文胜,史 进. 短枝条红型“红富士”苹果芽变的叶片解剖结构及其抗旱性研究[J]. 北方园艺,2016(18):22-25.
[16]吴丽芳,魏晓梅,应倩倩,等. 不同生长调节剂对白刺花叶片愈伤组织诱导质量分析[J]. 北方园艺,2018,409(10):63-69.
[17]过 聪,张庆华,向发云,等. 非洲菊嫩叶愈伤组织诱导和增殖因素研究[J]. 湖北农业科学,2017,56(23):4545-4548.
[18]吕永平,陈 志,李坤峰,等. 光照环境对大花月季组织培养的影响[J]. 浙江农业学报,2017,29(8):1297-1304.
[19]贾 茸,朱永平,江 周,等. 洋桔梗小孢子培养胚性愈伤组织诱导[J]. 江苏农业科学,2017,45(14):39-42.
[20]刘义存,黄天启,林顺权. 枇杷属若干野生种叶片愈伤组织诱导和再分化[J]. 江苏农业科学,2018,46(5):32-35.
[21]李俊明,朱登云. 植物组织培养教程[M]. 北京:中国农业大学出版社,2005.
[22]王晶晶. 小麦幼胚及成熟胚愈伤组织分化和继代分化的影响因素研究[D]. 杨凌:西北农林科技大学,2016.
收稿日期:2018-09-08
基金项目:河南省科技攻关项目(编号:172102110040)。
作者简介:王 鹏(1967—),男,河南南召人,硕士,副教授,主要从事园林植物栽培与养护、植物与植物生理教学与科研工作。E-mail:zzmz_w@126.com。
通信作者:王文静,硕士,教授,主要从事生物化学、植物生理的教学与科研工作。E-mail:wwj70@126.com。
