马铃薯StPR-1b蛋白的原核表达及抑菌活性
2019-03-03卢美欢李利军马英辉
卢美欢 李利军 马英辉


摘要:为探索马铃薯病害生物防治和抗病育种的有效途径,构建马铃薯病程相关蛋白StPR-1b的pET30A原核表达体系,用镍柱分离纯化该融合蛋白,结果表明,经0.5 mmol/L 异丙基硫代-β-D-半乳糖苷诱导后,StPR-1b蛋白在大肠杆菌中得到了高效表达;纯化得到预期大小(约15 ku)的融合蛋白;StPR-1b蛋白对马铃薯软腐病病原菌胡萝卜软腐果胶杆菌有一定的抑制作用,蛋白浓度越大,抑制效果越强。
关键词:StPR-1b蛋白;原核表达;马铃薯;抑菌作用;胡萝卜软腐果胶杆菌
中图分类号: S435.32 文献标志码: A 文章编号:1002-1302(2019)23-0085-03
病程相关蛋白(pathogenesis-related proteins,简称PRP或PRs)是指植物在病理或病理相关的环境下诱导产生的,普遍存在的具有广谱抗性的诱导的可溶性蛋白质,是植物产生诱导抗病性的一种生化机制。PRP相对分子质量为10~40 ku,积累于病原侵染寄主植物部位和未侵染部位的细胞内和细胞间,主要通过固化寄主细胞壁、提高抗菌活性和参与细胞信号转化等方式参与植物的诱导抗病性[1-2],能够抵抗蛋白酶、糖苷酶、重金属、尿素、低pH值和高温(60 ℃)等逆境环境,具有较强的稳定性[3-6]。大多数PRP具有几丁质酶和β-1,3-葡聚糖酶活性,在植物体内和体外显示出抗真菌活性,与植物过敏性坏死反应(hypersensitive response,简称HR)和系统获得性抗性(systematic acquired resistance,簡称SAR)有密切关系,PRP在寄主中的诱导表达常作为SAR建立的标志[7],因此人们可通过构建PRP基因的方法获得抗菌谱广、作用持久的抗病新品种。
马铃薯软腐病是马铃薯产区发生最严重的细菌性病害,在苗期和窖藏期容易发生,马铃薯是我国重要的经济作物和蔬菜品种,营养丰富,产量很高,但目前我国多数马铃薯主产区都受到了马铃薯软腐病的严重威胁,对我国马铃薯的生产造成极大的破坏,2000年福建省福鼎市马铃薯软腐病发生面积为25107 hm2,是总种植面积的82%,造成了严重的经济损失[8]。
本研究对病程相关蛋白StPR-1b 进行原核表达,通过构建原核表达系统将融合蛋白大量表达和分离纯化,探索该蛋白对马铃薯软腐病病原菌的抑制作用,以期开发安全无害的抗生素,并为该基因在马铃薯抗病育种中的应用提供理论基础。
1 材料与方法
1.1 试验材料
1.1.1 生物材料 马铃薯软腐病病原菌、表达载体pET30a载体、pET30A-StPR-1b质粒,均为笔者所在实验室保存;表达宿主为大肠杆菌感受态细胞,购自Invitrogen公司。
1.1.2 酶和试剂 T4连接酶、DNA Marker、NdeⅠ和XhoⅠ内切酶,均购自TaKaRa公司;凝胶回收试剂盒,购自生工生物工程(上海)股份有限公司;异丙基硫代-β-D-半乳糖苷(IPTG),购自Sigma公司;PVDF膜,购自Millpore公司;其他试剂均为国产分析纯。
1.2 试验方法
1.2.1 引物设计 根据StPR-1b基因序列,利用引物设计软件Rrimer 5.0设计合成引物,引物序列:上游5′-GACACGACACCATATGCAGAACTCTCCGCAGGATTAT-3′,下游5′-GTGTCCTCGAGGTACGGACGCTGACCAACCCAG-3′,以含StPR-1b全长的pET30A-StPR-1b质粒为模板进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。
1.2.2 PCR反应条件 以pET30A-StPR-1b质粒为模板,在总体积为50 μL的EP管中依次加入1 μL dNTP(25 mmol/L)、5 μL高温聚合酶(Pfu) Buffer(10×)、2 μL上游引物、2 μL下游引物、0.4 μL Pfu(5 U/μL),用ddH2O补至50 μL。扩增程序:95 ℃预变性3 min,95 ℃变性22 s,53 ℃退火20 s,72 ℃ 延伸60 s,24个循环,72 ℃修复延伸5 min。
1.2.3 PCR电泳及回收 将PCR产物用2%琼脂糖凝胶在1×TAE缓冲液,电压为150 V,电流为100 mA条件下,20 min电泳观察。将目的条带切下,按试剂盒回收StPR-1b片段,回收纯化好的片段备用酶切。酶切体系为1 μg纯化回收好的片段、5 μL酶切Buffer(10×)、1 μL限制性内切酶NdeⅠ(10 U/μL)和1 μL限制性内切酶XhoⅠ(10 U/μL),用ddH2O补至50 μL,在温度为37 ℃恒温水浴锅中反应2 h。
1.2.4 目的片段与载体连接、转化和筛选 回收纯化好的目的DNA片段8 μL、T4连接酶Buffer 2 μL、pET30A载体4 μL、T4连接酶1 μL,用ddH2O补至20 μL,在16 ℃条件下反应 4 h;然后将其转入oneshort感受态细胞中,检测筛选出阳性克隆送生工生物工程(上海)股份有限公司进行测序。测序正确的菌液使用质粒提取试剂盒SK8191 SanPrep柱式质粒DNA小量抽提试剂盒提取质粒DNA。
1.2.5 原核表达载体的构建 用NdeⅠ和XhoⅠ内切酶对测序正确的pET30A-StPR-1b质粒和表达载体pET30A分别进行双酶切,切胶回收目的片段用T4 DNA连接酶连接到pET30a(+)载体上,将连接产物转化到oneshort感受态细胞中,提取转化子的质粒DNA,经PCR检测和酶切检测证实含目的基因的片段已经插入原核表达载体中并成功转入表达宿主菌中,得到重组表达载体。
1.2.6 融合蛋白的诱导表达及纯化 挑取表达菌株的单菌落于含卡那霉素的LB培养基中,在37 ℃、220 r/min下过夜培养。然后按1 ∶ 100稀释培养液,在37 ℃、220 r/min下培养至D600 nm为0.6时,添加终浓度为 0.5 mmol/L 的IPTG,在 220 r/min,温度分别为20、37 ℃条件下诱导过夜;37 ℃诱导 4 h,以未加IPTG诱导剂的处理作为阴性对照。4 000 r/min离心10 min收集菌体,弃上清,菌体用500 μL PBS(pH值为7.4)缓冲液悬浮,添加终浓度为 0.5 mmol/L 的溶菌酶,超声破碎6 min,破碎0.5 s停1.5 s,分别离心收集上清和沉淀,沉淀用500 μL包涵体溶解液(8 mol/L 尿素,50 mmol/L Tris-HCl,300 mmol/L NaCl,pH值为8.0)溶解,分别取40 μL样品和10 μL 5×protein loading buffer混匀,沸水浴10 min,离心后取上清,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(简称SDS-PAGE)检测。准备12%的SDS-PAGE,Tris-Gly电泳缓冲液(Tris 3.0 g,甘氨酸14.4 g,SDS 1.0 g,定容至1 L),上样量为10 μL,浓缩胶条件:80 V 20 min,分离胶条件:120 V 60 min,凝胶电泳结束用考马斯亮蓝染色20 min,脱色后观察蛋白条带。
将培养的菌液按1 ∶ 100比例接种于3 L含有卡那霉素的LB液体培养基中,在37 ℃、220 r/min条件下培养,当D600 nm达到 0.6 时,添加终浓度为0.5 mmol/L的IPTG,在 20 ℃、220 r/min条件下诱导过夜,离心收集细胞菌体,采用镍琼脂糖亲和层析进行蛋白纯化后,-80 ℃保存。
1.2.7 蛋白免疫印记试验(Western Blot) 将纯化好的 HIS-StPR-1b蛋白进行Western Blot检测,蛋白经过SDS-PAGE转移至PVDF膜后,用5%的脱脂奶粉,在37 ℃条件下缓慢振荡2 h,加兔抗his标签的一抗(1 ∶ 500稀释)在37 ℃条件下缓慢振荡 60 min。加羊抗兔的二抗孵育60 min,最后用3,3′,5,5′-四甲基联苯胺(TMB)显色鉴定。
1.2.8 纯化的HIS-StPR-1b蛋白对马铃薯软腐病病原菌的抑制试验 将HIS-StPR-1b蛋白用无菌双蒸水配制成 1 mg/mL 蛋白溶液,再稀释成不同浓度梯度备用。将保存的马铃薯软腐病病原菌胡萝卜软腐果胶杆菌活化,在LB液体培养基中培养24 h。在已灭菌的EP离心管中加入880 μL液体LB培养基,20 μL软腐病病原菌菌液,同时加入稀释好的HIS-StPR-1b蛋白溶液100 μL,32 ℃振蕩培养12 h,每个浓度做3次重复,测定D600 nm。同时做空白对照。
2 结果与分析
2.1 StPR-1b原核表达载体的构建
以pET30a-StPR-1b质粒为模板进行PCR扩增,扩增出与预期大小一致的417 bp条带(图1),对目标条带进行琼脂糖电泳、回收。回收产物亚克隆于pET30a载体中。对含有StPR-1b基因的重组pET30a质粒进行NdeⅠ和XhoⅠ双酶切,PCR检测和酶切鉴定结果显示,StPR-1b基因已成功导入到原核表达载体pET30a中,目标片段大小与该基因编码区大小一致。
2.2 StPR-1b蛋白的诱导表达
将原核表达载体pET30a-StPR-1b转化至大肠杆菌oneshort感受态细胞,在IPTG诱导下StPR-1b能成功表达,菌体中检测到高表达量的蛋白条带(图2的泳道3和泳道5)。考察不同温度诱导StPR-1b蛋白表达的影响,结果显示,在20、37 ℃ 2个温度处理中,37 ℃诱导更有利于StPR-1b蛋白的表达。表明不同诱导温度对StPR-1b蛋白表达的影响较明显。
2.3 纯化蛋白SDS-PAGE分析
采用镍琼脂糖亲和层析对在大肠杆菌中大量表达的重组StPR-1b蛋白进行纯化,采用不同浓度的咪唑基(Imidazole)洗脱液洗脱,发现20 mmol/L Imidazole洗脱组分能较好地将StPR-1b蛋白分离纯化(图3),收集蛋白洗脱液冷冻干燥,经检测蛋白浓度为84%。StPR-1b融合蛋白经过纯化,SDS-PAGE 电泳分析在约15 ku出现明显条带,表明融合蛋白成功得到了纯化(图4)。
2.4 StPR-1b融合蛋白的Western Blot分析
为了进一步确定StPR-1b融合蛋白是否在大肠杆菌中成功表达,用抗his标签的一抗和加羊抗兔的二抗进行Western Blot检测,用TMB显色鉴定。结果表明,在预期的 15 ku 位置有特异性条带出现(图5),证明StPR-1b融合蛋白表达成功。
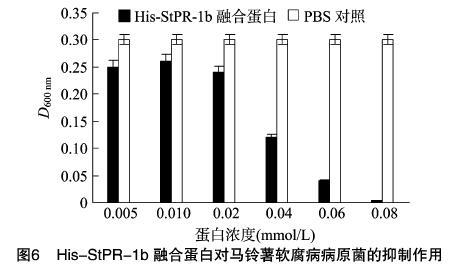
2.5 StPR-1b蛋白对马铃薯软腐病病原菌的抑制作用
配制不同浓度StPR-1b融合蛋白溶液,研究其对软腐病病原菌的抑制作用。结果(图6)显示,在0.005~0.08 mmol/L蛋白溶液浓度范围内,His-StPR-1b融合蛋白对马铃薯软腐病病原菌胡萝卜软腐果胶杆菌有一定的抑制作用,蛋白浓度越大,抑制效果越强,当His-StPR-1b融合蛋白浓度为 0.08 mmol/L 时,抑制率达到90.0%。
3 结论
马铃薯软腐病在世界范围内广泛发生,是马铃薯产区发生最严重的细菌性病害,严重影响马铃薯产量。积极培育抗病品种,是缓解马铃薯软腐病的有效途径。本研究通过构建原核表达载体,将StPR-1b基因成功在大肠杆菌中得到表达。在原核表达系统中,不同诱导条件对StPR-1b蛋白表达的影响较明显,本研究经多次诱导及SDS-PAGE分析后发现,StPR-1b蛋白最佳诱导温度为37 ℃,采用镍亲和层析进行蛋白纯化,最佳纯化条件为20 mmol/L Imidazole洗脱组分,获得了纯度为84%的蛋白,这为进一步研究StPR-1b蛋白的生物活性及在马铃薯抗病方面的生物学功能奠定了基础。
植物在受到真菌、细菌和病毒等病原体入侵时合成抗毒素、抗菌肽或一些病程相关蛋白,PRs与寄主植物抗病性和系统获得性具有密切关系,是植物自我抗御机制中的可诱导组分,目前已知的蛋白根据序列同源性、血清学关系和生物活性被划分为17个家族。抗病防卫反应中表达的基因主要是编码病程相关蛋白和植保素合成相关酶基因,而PRs在植物抗病性和系统获得抗性中起重要作用,是因为不同PRs基因的表达水平和抗病性之间紧密相关。StPR-1b蛋白属于 PR-1 家族成员,StPR-1b基因编码1个含有159个氨基酸的蛋白质,在N端存在长为24个氨基酸的信号肽。本研究通过PCR技术扩增了马铃薯病程相关蛋白 StPR-1b基因,并使克隆的StPR-1b基因在大肠杆菌中得到成功表达,优化表达体系为纯化产物验证体外生物活性及后期培育抗病转基因马铃薯提供了参考。
参考文献:
[1]Loon L V,Strien E V. The families of pathogenesis-related proteins,their activities,and comparative analysis of PR-1 type proteins[J]. Physiological & Molecular Plant Pathology,1999,55(2):85-97.
[2]Christensen A B,Cho B H,Nsby M,et al. The molecular characterization of two barley proteins establishes the novel PR-17 family of pathogenesis-related proteins[J]. Molecular Plant Pathology,2002,3(3):135-144.
[3]王勇刚,曾富华,吴志华,等. 植物诱导抗病与病程相关蛋白[J]. 湖南农业大学学报(自然科学版),2002,28(2):177-182.
[4]Hoffmann-Sommergruber K. Pathogenesis-related (PR)-proteins identified as allergens[J]. Biochemical Society Transactions,2002,30(6):930-935.
[5]Bertini L,Leonardi L,Caporale C,et al. Pathogen-responsive wheat PR4 genes are induced by activators of systemic acquired resistance and wounding[J]. Plant Science,2003,164(6):1067-1078.
[6]Ziadi S,Poupard P,Brisset M N,et al. Characterization in apple leaves of two subclasses of PR-10 transcripts inducible by acibenzolar-S-methyl,a functional analogue of salicylic acid[J]. Physiological and Molecular Plant Pathology,2001,59(1):33-43.
[7]范志金,劉秀峰,刘凤丽,等. 植物抗病激活剂诱导植物抗病性的研究进展[J]. 植物保护学报,2005,32(1):87-92.
[8]马 宏. 我国马铃薯软腐病防治的研究进展[J]. 生物技术通报,2007(1):42-44.
收稿日期:2018-10-31
基金项目:陕西省科学院科技计划(编号:2015K-05);陕西省科技厅农业攻关计划(编号:2014K02-13-02、2016NY-197);西安市科技局农业创新计划[编号:2017050NC/NY009(4)]。
作者简介:卢美欢(1981—),女,广东罗定人,硕士,副研究员,主要从事植物病害生物防治研究。E-mail:lu_meihuan@sina.com。
通信作者:李利军,研究员,主要从事微生物物资开发与利用研究。E-mail:lijun_lli@163.com。
