GSK-3β和E-cadherin在子宫内膜腺癌中的表达和意义
2019-03-02李家平袁红瑛
李家平,何 涛,袁红瑛
(1.河南科技大学第一附属医院妇科,河南洛阳 471003;2.河南科技大学临床医学院,河南洛阳 471003)
近20年子宫内膜癌发病率呈逐年上升趋势,且逐渐向年轻人群迈进[1-3],在欧美发达国家其发病率高居生殖系统肿瘤首位[4]。子宫内膜癌的发病原因,机制目前尚无明确定论,给治疗带来诸多困难。近年来人们认为Wnt信号通路的上游分子糖原合成酶激酶-3(GSK-3β)可能影响肿瘤细胞的形成、迁移和自我更新,起着促进细胞程序性死亡,限制细胞增殖,发挥负性调控行为[5-6]。SOKOLOSKY等[7]研究显示GSK-3β在胃癌组织中阳性表达水平较正常胃组织明显下调。E-钙粘蛋白(E-cadherin)在正常微环境中起着维持细胞之间结构的稳定性,防止它们随意迁移、黏附,其表达水平降低易导致上皮-间质转化事件发生。许多研究显示E-cadherin下调与上皮肿瘤关系密切,在口腔癌[8]、乳腺癌等上皮癌中E-cadherin表达较正常组织明显下调。肿瘤的形成、进展涉及微环境的变化和细胞内部结构的改变等繁杂的程序[9],本研究试图应用免疫组织化学技术,检测GSK-3β和E-cadherin在子宫内膜腺癌中的表达情况,旨在分析该基因与子宫内膜腺癌的关系,有助于子宫内膜腺癌的治疗,为临床预后提供参考,现报道如下。
A:正常增殖期内膜组(SP×200);B:子宫内膜不典型增生组(SP×200);C:子宫内膜腺癌组(SP×100)
图1 3组GSK-3β的表达
1 资料与方法
1.1一般资料 本试验86例标本来自2010年1月至2012年12月河南科技大学第一附属医院妇科手术切除子宫内膜组织,分为正常增殖期内膜组(12例),子宫内膜不典型增生组(19例)和子宫内膜腺癌组(55例)。采用免疫组织化学SP技术探测GSK-3β、E-cadherin在3组标本中表达情况。参照国际妇产科联盟规定的手术病理分期,18例Ⅲ~Ⅳ期和37例Ⅰ~Ⅱ期子宫内膜腺癌标本,其中17例淋巴结被癌细胞浸润。纳入标本的患者术前未进行放化疗、激素治疗,且无其他恶性肿瘤,切除标本被病理证实。纳选标本均按免疫组织化学试验要求制作。
1.2方法
1.2.1免疫组织化学SP法 试剂:兔抗人GSK-3β单克隆抗体(美国Abcam公司),试验浓度1∶200;兔抗人E-cadherin单克隆抗体(中国福建迈新公司)工作液,试验依照免疫组织化学SP-0023试剂盒(美国ZYMED公司)说明书步骤进行。
1.2.2免疫组织化学结果判定 GSK-3β阳性表达位于细胞质或细胞核,E-cadherin阳性表达位于细胞膜或细胞质。依据着色深浅和阳性细胞比例分析评定,a是着色水平:不着色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分;b是阳性细胞比例:阴性为0分,<1/4为1分,1/4~3/4为2分,>3/4为3分;统计a+b之和:0分为阴性(-),1~2分为弱阳性(+),3~4分为阳性(++),>4分为强阳性(+++)。本研究阳性等级依照+~+++标准。
1.3统计学处理 采用SPSS19.0 软件进行数据分析,计数资料以频数或百分率表示,比较采用χ2检验或Fisher精准性检验分析,Spearman秩和法进行相关性分析,Kaplan-meier法进行生存分析,以P<0.05为差异有统计学意义。
2 结 果
2.1GSK-3β和E-cadherin在子宫内膜不同病变中的表达
2.1.1GSK-3β表达 3组均可见GSK-3β表达,阳性表达主要定位于细胞质,表现为棕褐色、棕黄色、黄色,见图1。GSK-3β在正常增殖期内膜组、子宫内膜不典型增生组、子宫内膜腺癌组中阳性率分别为83.3%、78.9%、36.4%,3组比较差异有统计学意义(χ2=15.640,P=0.000)。子宫内膜不典型增生组GSK-3β表达水平较子宫内膜腺癌组显著增高(χ2=10.273,P=0.001),较正常增殖期内膜组差异无统计学意义(P=1.00),正常增殖期内膜组GSK-3β表达水平较子宫内膜腺癌组明显增高(χ2=8.789,P=0.003),见表1。

表1 GSK-3β在3组组织中的比较[n(%)]
2.1.2E-cadherin表达 3组均可见E-cadherin表达,阳性表达主要定位细胞膜,表现为棕褐色、棕黄色、黄色,见图2。E-cadherin在正常增殖期子宫内膜组、子宫内膜不典型增生组、子宫内膜腺癌组中阳性率分别为91.7%、73.7%、21.8%,差异有统计学意义(χ2=28.959,P=0.000)。子宫内膜不典型增生组GSK-3β表达水平较子宫内膜腺癌组显著增高(χ2=16.669,P=0.000),较正常增殖期内膜组差异无统计学意义(P=0.363),正常增殖期内膜组GSK-3β表达水平较子宫内膜腺癌组显著增高(χ2=18.333,P=0.000),见表2。

A:正常增殖期内膜组(SP×200);B:子宫内膜不典型增生组(SP×200);C:子宫内膜腺癌组(SP×100)
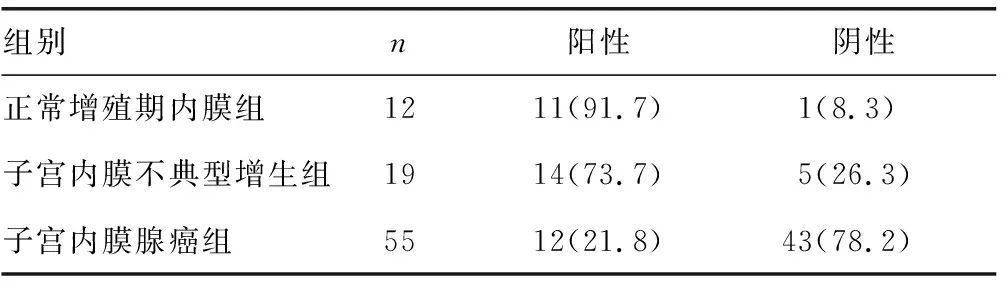
图2 3组E-cadherin的表达
2.2GSK-3β和E-cadherin的表达与子宫内膜腺癌临床病理特征的关系 GSK-3β在FIGO分期标准:Ⅲ~Ⅳ期、Ⅰ~Ⅱ期阳性表达率分别为16.7%,45.9%,两者比较差异有统计学意义(P<0.05)。E-cadherin阳性表达率在低分化组、中分化组,高分化组分别为9.1%、9.4%、66.7%,3组比较差异有统计学意义(P<0.05);高分化组和中分化组比较及高分化组和低分化组比较差异有统计学意义(P<0.05),中分化组和低分化组比较,差异无统计学意义(P>0.05)。随着肿瘤侵犯组织范围的扩大,GSK-3β的阳性表达率明显减弱,差异有统计学意义(P<0.05);E-cadherin的阳性表达率减弱,差异无统计学意义(P>0.05);随着病理分级的增高,GSK-3β的阳性表达率减弱,而差异无统计学意义(P>0.05);但E-cadherin的阳性表达率呈明显减弱趋势,差异有统计学意义(P<0.05)。而GSK-3β和E-cadherin的表达与癌细胞浸润子宫肌层深度、是否转移到淋巴结、患者的年龄无明显相关性(P>0.05),见表3。

表3 GSK-3β和E-cadherin的表达和子宫内膜腺癌的临床病理特征的关系[n(%)]
2.3子宫内膜腺癌中GSK-3β和E-cadherin表达的关系 相关性采用Spearman等级分析显示GSK-3β和E-cadherin表达呈正相关(r=0.516,P=0.000),见表4。
2.4子宫内膜腺癌中GSK-3β和E-cadherin蛋白表达与预后 纳入55例子宫内膜癌,从手术后病理证实日期开始至2017年12月,随访36例,中途有3例患者因其他疾病死亡,2例患者未复发。经Log-rank检验,GSK-3β阳性表达组临床预后较阴性组好,E-cadherin阳性表达组临床预后较阴性组好,差异有统计学意义(P<0.05),见图3、4。

表4 GSK-3β和E-cadherin在子宫内膜腺癌中的表达水平关系(n)

图4 E-cadherin的表达与子宫内膜腺癌临床预后的Kaplan-meier分析
3 讨 论
Wnt/GSK-3β信号通路是用来调控细胞增殖、细胞极性及控制细胞命运的基础通路。通路关闭时,GSK-3β与相关蛋白形成复合物抑制β-catenin入细胞核,从而阻止了细胞的癌变过程。GSK-3β由于具有“β”折叠的N端和“α”螺旋的C端结构域,因此拥有独特的磷酸化,亚细胞定位和GSK-3β结合蛋白之间的相互影响,协助在体内实现精准调控。磷酸化GSK-3β氨基端的丝氨酸(Ser9)导致其失活,Wnt等信号通路可磷酸化此位点,而磷酸化GSK-3β酪氨酸位点(Tyr216)导致其被激活。因此,GSK-3β与相关蛋白形成复合物后通过各个途径或规避或促进肿瘤的形成。胡福清[10]研究发现GSK-3β被激活可以抑制乳腺癌干细胞扩增,失活型GSK-3β可以导致乳腺癌细胞系MCF-7的耐药,同样高表达持续激活型GSK-3β可以抑制乳腺癌的成瘤[11-13];而梁爽爽[14]的研究发现,GSK-3β可抑制凋亡,认为肿瘤中可能存在如下机制:GSK-3β过度表达促使Wnt/β连环蛋白通路下游信号分子WISP-1过度表达,进而使半胱天冬酶(caspase)-3表达受抑,导致癌细胞增殖。本研究表明GSK-3β在正常和不典型增生子宫内膜呈高表达,而在子宫内膜腺癌呈低表达,提示可能是在癌组织中GSK-3β氨基端的一个丝氨酸(Ser9)磷酸化后其活性被抑制,导致GSK-3β与相关蛋白形成的复合物崩解,β-catenin逃逸被磷酸化而在细胞质集聚并入核,本研究发现在子宫内膜癌组织中,随着分期增加,阳性表达逐渐降低;随着病理分级的增高,淋巴结的转移,阳性表达有下降趋势,进一步论证试验的推测:入核后的β-catenin促进靶基因的转录,促进细胞增殖、转移,提示GSK-3β的低表达在肿瘤进行性发展中,扮演重要生物学角色,预兆着肿瘤的侵袭力和恶性程度。但对于肿瘤早期诊断有局限性,可能需要扩大样本量进一步进行研究验证。
人类E-cadherin基因定位于16q22.1,主要分布于上皮细胞,与细胞骨架、β-catenin等连接形成复合体,与周围的组织细胞相互辨别、黏附,形成特定的组织[5],其表达降低易导致细胞刚性改变,进而变性、游走、定植,从而导致肿瘤细胞侵袭能力增强。在乳腺肿瘤、消化道肿瘤、泌尿系肿瘤中,E-cadherin基因的突变或减弱均被检测到。本研究结果显示E-cadherin在正常和非典型增生子宫内膜呈现高表达,而在子宫内膜腺癌显示低表达,随着病理分级的增高呈明显下降趋势(P<0.05),随着浸入肌层深度的增加、肿瘤分期的增高和淋巴结的转移,阳性表达也降低,更进一步验证试验推测:入核后的β-catenin结合LEF/TCF转录因子家族,启动下游基因转录,转录因子反过来抑制E-cadherin表达,导致细胞膜E-cadherin降低,一方面降低细胞极性、黏附性,触发上皮-间质转化事件,肿瘤细胞发生浸润、转移;另一方面,与细胞膜上E-cadherin蛋白结合的β-catenin从细胞骨架蛋白肌动蛋白附着处游离,在细胞质集聚,激活Wnt信号通路,进一步加剧上皮-间质转化现象。在本研究55例子宫内膜癌中,GSK-3β和E-cadherin有10例共为阳性,33例共为阴性,说明它们在子宫内膜癌的发生、发展中有相互协同作用。Wnt/GSK-3β信号如何与E-cadherin黏附复合物相互作用知之甚少,仍然需要大量的研究进行论证阐释,
综上所述,GSK-3β和E-cadherin的低表达,可能相互促进β-catenin在细胞质内稳定性并募集入核,一方面与相关蛋白相互作用规避细胞凋亡,另一方面结合E-cadherin启动子部位的E-box,促使E-cadherin的功能减弱而触发上皮-间质转化现象,癌细胞逃逸监管四处迁移增殖,导致肿瘤转移、复发。本试验采用Spearman等级相关分析,GSK-3β和E-cadherin表达呈正相关。通过随访观察,采用Kaplan-meier分析,发现子宫内膜癌GSK-3β和E-cadherin阳性表达患者临床预后较好而阴性表达者较差,两者在子宫内膜癌的发生、发展中可能起着既独立又协同的作用。通过手术后对标本进行联合检测,有利于临床医生对肿瘤的生物学特性准确判断、指导治疗和预后评估。
