臭氧与过氧化钙协同降解甲基红废水
2019-02-27郝思宇刘亚男
郝思宇,张 艾,刘亚男
臭氧与过氧化钙协同降解甲基红废水
郝思宇,张 艾*,刘亚男
(东华大学环境科学与工程学院,上海 201620)
对单独臭氧(O3)、臭氧与过氧化钙(O3/CaO2)联用技术降解甲基红染料废水进行了研究,考察了O3流量、温度、废水初始pH值、CaO2投加量、处理时间以及不同水基质等因素对甲基红降解效果的影响.结果表明,在O3流量为48L/h,温度为26oC,初始pH值为6.2的纯水中降解10min,单独O3处理对甲基红的降解率为86.1%.在此条件下投加CaO2,投加量为6.9mmol/L时,O3/CaO2联用技术对甲基红废水的脱色率可达到94%.水基质中草酸的存在并不会对O3/CaO2联用体系的降解作用造成抑制.O3/CaO2联用体系在多种复杂水基质中都能达到较好的脱色效果.通过对比试验发现,O3/CaO2联用对甲基红的降解起协同作用,CaO2不仅可以产生H2O2促进染料被O3降解,而且CaO2的吸附作用也有利于染料和污染物质的氧化去除.该联用工艺可高效地去除印染废水的色度,达到出水水质处理标准.
甲基红;臭氧;过氧化钙;协同作用
纺织品印染废水排放量大,组成复杂,污染物浓度高,其中含有大量结构复杂的染料和化合物[1].色度高是印染废水的主要特征之一,尤其是偶氮染料及其副产品具有一定的致癌性和突变性[2].而普通的吸附、絮凝等物理方法及活性污泥生物处理法都难以去除废水色度[3],若不能使其完全脱色,将会对环境造成严重危害.
近年来臭氧(O3)氧化在各类印染废水处理领域中均取得很好的实际处理效果[4].O3对印染废水的脱色非常有效,O3氧化过程中O3分子会攻击染料的发色基团—共轭双键,使印染废水快速脱色并得到降解[2].但O3氧化受水质影响较大,对于废水处理来说,O3降解易受废水中无机及有机物质的影响,导致运营成本偏高[5].
过氧化钙(CaO2)因其稳定的氧化能力,在降解有机污染物方面的效果优于同剂量的O3[6-7],同时其运输安全、投药简单、价格便宜,在废水处理、土壤和地下水的修复等领域得到了广泛应用[8].将CaO2/O3联用处理印染废水,CaO2投加可产生H2O2,与O3氧化产生协同作用[9];CaO2溶于水产生的Ca2+可消除复杂水基质中的HCO3-、CO32-、草酸等对O3氧化效果的影响[10-11];并且CaO2可在气液氧化体系中提供固相界面,可能会对O3降解有机物产生界面吸附和活化的促进效应.
目前,应用O3/CaO2联用技术处理有机废水的研究仍然十分欠缺.鉴于此,本研究以生物偶氮染料甲基红模拟废水为处理对象,考察了O3/CaO2联用技术对甲基红脱色的影响,并探讨了复杂水基质对其降解性能的影响,最后对O3/CaO2联用技术的协同作用机理进行了探究,为O3/CaO2联用降解有机污染物的技术发展提供参考.
1 实验部分
1.1 实验药剂与仪器
实验用甲基红、氢氧化钠、浓硫酸、碘化钾、草酸钛钾均为分析纯,购自中国国药集团.甲基红标准品溶于乙酸中配制成母液(1g/L),避光贮存在4℃的环境中.乙酸购自美国Sigma-Aldrich,为高效液相色谱(HPLC)纯.分析级过氧化钙(CAS: 1305-79-9, 75% CaO2,25% Ca(OH)2)购自上海阿拉丁生化科技股份有限公司.试验中所用的超纯水取自Milli-Q超纯水机(25℃下电阻率高于18.2MΩ).
仪器:臭氧发生器(上海拜森环保科技有限公子);PHS-3S型pH计(上海理达仪器厂);紫外可见分光光度计(日本岛津制作所);电子天平(上海力辰科技有限公司);磁力搅拌器(上海司乐仪器有限公司);玻璃转子流量计(常州双环热工仪表有限公司);恒温循环水浴保温器(上海汗诺仪器有限公司);微孔滤膜(上海嘉鹏科技有限公司);真空冷冻干燥机(上海胜卫电子科技有限公司);SA3100比表面积及孔径分析仪(美国贝克曼库尔特有限公司);ESR光谱仪(JES-FA 200,日本电子).
1.2 实验过程
实验装置如图1所示,整个反应系统由臭氧发生器、玻璃反应器(2.5L)、恒温循环水浴装置和尾气收集瓶组成.

图1 臭氧反应装置
实验开始前,反应器中装有一定量的超纯水并用1mol/L氢氧化钠或硫酸溶液调节至所需的pH值(2,4,6.2,8,10).调节O3流量至所需剂量(24,30,36,48, 60L/h),先向反应器中通入该剂量下的O3混合气体30min,待O3流量及水中O3浓度稳定后,再向超纯水中加入一定量的甲基红母液及CaO2固体粉末(0,0.1, 0.7,1.4,4.2,6.9,9.7,13.9,27.8,41.7mmol/L)及草酸(0, 5.6mmol/L)至所需浓度.以加入甲基红母液时刻为零时刻开始计时,在特定时间(0,1,3,5,7,10,13,15,20, 25min)取样测定溶液中的甲基红浓度.
在考察不同水基质影响的实验中,反应器内装有一定量的原水,不调节原水pH值.先向原水中加入甲基红母液及CaO2粉末(6.9mmol/L)后,再向原水中通入O3(48L/h).以通入O3时刻为零时刻开始计时,在特定时间(0,1,3,5,7,10,13,15,20,25min)取样测定原水中剩余的甲基红浓度.
O3由以空气为气源的臭氧发生器制备,通过转子流量计控制流量,由玻璃导管将O3混合气体通入反应器.O3混合气体经曝气头以均匀气泡的形式通入到甲基红废水中.O3尾气由酸化的20%KI溶液吸收.
在所有实验中,甲基红的初始浓度均为5mg/L. O3流量除研究O3流量的具体实验外,其余实验中O3流量均为48L/h.反应体系由恒温循环水浴保温器维持一定的温度,除研究溶液温度影响的具体实验外,其余实验中溶液的温度均为26℃.除研究溶液pH值影响的具体实验外,其余实验中溶液pH值均为6.2.所有反应过程中磁力搅拌器连续搅拌.所有实验均做3个平行.
1.3 样品分析方法
溶液pH值由pH计测定溶液pH值.甲基红溶液的浓度由UV2800A紫外可见分光光度计测定.酸性条件下,甲基红的吸收峰值为525nm,中性、碱性条件下吸收峰值为430nm[12].
溶液中过氧化氢的测定:取10mL待测溶液加入系列25mL带塞比色管中,加入一定量的草酸钛钾溶液(80mmol/L)和H2SO4溶液(0.48mol/L)稀释至刻度并摇匀后放置10min,在387nm下测定其吸光度[13].
CaO2孔径及孔容的测定:O3/CaO2联用反应25min后,溶液经0.45μm的滤膜过滤,取滤膜上的固体物质经真空冷冻干燥,得到反应后的CaO2粉末.将反应前及反应后的CaO2粉末在150℃下脱气6.8h.使用SA3100比表面积及孔径分析仪,在相对压力为0.99下测定CaO2粉末的孔体积,并由BJH孔径分布计算模型测定孔径分布[14].
溶液中∙OH的测定:电子自旋共振法(ESR),测试前用离子水制备100mmol/L DMPO溶液,整个测量期间保持4℃.将配制好的DMPO加入至待测水溶液中,使其浓度为5mmol/L.用ESR光谱仪来检测降解过程中形成的∙OH.
甲基红脱色率及反应速率常数的计算:甲基红染料脱色率计算如式(1)所示,并利用拟一级动力学模型研究单独O3、O3/CaO2联用降解甲基红染料过程中的降解动力学,如式(2)所示.
脱色率(%)=((0-)/0)×100 (1)
ln(/0)=-obs(2)
式中:0为反应前甲基红浓度,mg/L;为反应时刻为时甲基红的瞬时浓度,mg/L;obs为反应速率常数, min-1.
2 结果与讨论
2.1 单独O3降解甲基红
2.1.1 O3流量的影响 O3流量对甲基红废水脱色率的影响,以及不同流量下O3氧化甲基红染料废水的一级动力学拟合曲线,如图2所示.

图2 臭氧流量对臭氧降解甲基红的影响
O3流量为24~60L/h时,随着O3流量的增加,废水脱色率显著增加.O3流量为24L/h时,反应10min后,甲基红脱色率为56%.在O3流量为60L/min时,反应10min后,甲基红脱色率可达91%.Shen等[8]在O3处理活性红X-3B的研究中也得到了类似的规律,在O3流量为24~60L/h时,活性红X-3B的脱色率由68%提高至87%.由亨利定律可知,单位体积O3浓度的增加可提高传质驱动力,从而增加O3从气相到液相的传质速率[8].
为了在减少实验耗能的同时又保证处理效率,本实验最终选取O3流量为48L/h.在此条件下反应10min,甲基红去除率为86%.
2.1.2 反应体系温度的影响 通过恒温水循环装置进行温度控制,分别在7,26,40℃下,研究不同温度下O3对甲基红废水脱色率的影响,结果见图3.
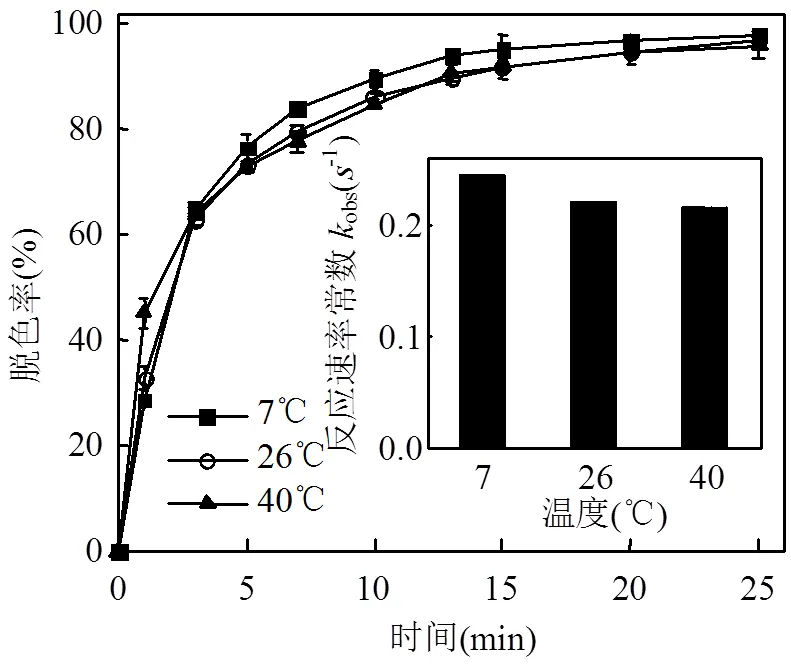
图3 反应温度对臭氧降解甲基红的影响
O3氧化染料废水符合一级动力学方程[15],根据拟合曲线得出反应速率常数obs如图3所示.在7~40℃范围内,反应体系温度的变化对甲基红脱色率的影响不大.随着反应体系温度的降低,甲基红脱色率稍有提高.7℃时向废水中通入O310min,甲基红的脱色率达到近89%,而相同条件下40℃时的脱色率为84%.虽然温度升高,反应速率常数会增加,但O3分子在水中的溶解度和稳定性会随着温度的升高而下降[9-10].因此过高的废水温度会导致甲基红脱色率下降,影响O3氧化效率.
考虑到工艺可行性及经济性等方面,选取常温26℃为最佳反应温度,在此条件下反应15min后,甲基红脱色率达到92%.
2.1.3 溶液pH值的影响 不同pH值对甲基红废水脱色率及拟合曲线得出的反应速率常数obs如图4所示.
由图4可知,当初始pH值为2时,反应3min后,甲基红脱色率达97%.当初始pH值为10时,反应7min后,甲基红脱色率达87%.初始pH值为6.2时,反应7min后,甲基红脱色率为80%.因此,在初始pH值为2~10时,在酸性和碱性条件下,甲基红的脱色速率快于中性条件,其中酸性环境下,甲基红废水脱色效率最高.Muthukumar等[12]发现,在O3氧化酸性红88染料时,溶液pH值在3和11时完全脱色所用时间较少,而在pH=7时脱色所需时间长,且pH=3为该染料脱色的最佳条件.张静等[16]在O3氧化处理酸性大红3R废水的实验中发现,酸性和碱性条件下的脱色速率明显高于中性条件,且酸性条件下O3氧化酸性大红3R染料废水脱色速率最快且氧化能力最强.

图4 pH值对臭氧降解甲基红的影响
在不同的pH值下,染料的O3降解遵循两种不同的途径.酸性条件时,O3分子有选择性地攻击偶氮染料结构中发色的-N=N-键和芳香族,可使甲基红染料溶液迅速褪色,生成醛、羧酸和其他副产物.而碱性条件时,臭氧化机理由O3分子直接氧化转变为复杂的链式机制,即一部分O3分子会转化为HO、HO2和HO4等自由基[17].其中,HO∙氧化能力最强,可把染料废水中存在的芳香族染料的环状结构打开,更有利于甲基红脱色副产物的降解[18].
2.2 O3/CaO2联用降解甲基红
2.2.1 CaO2投加量的影响 不同CaO2投加量对O3/CaO2联用过程中甲基红废水脱色率的影响如图5所示.另外,投加6.9mmol/L CaO2粉末至5mg/L甲基红溶液中,搅拌反应1h,发现不投加O3、单独投加CaO2对甲基红染料没有脱色作用.O3/CaO2联用氧化染料废水符合一级动力学方程[17],根据拟合曲线得出反应速率常数obs如图5所示.
由图5可见,CaO2的投加显著提高了甲基红的脱色反应速率.随着CaO2投加量的增加,溶液pH值升高,甲基红脱色反应速率先增高后减小, CaO2投加量为6.9mmol/L时,甲基红的脱色反应速率最大(obs= 0.3117s-1),在此条件下反应10min,甲基红脱色率可达94%;而在不投加CaO2时,单独O3下甲基红的脱色反应速率最小(obs=0.2219s-1),需单独通入O320min,脱色率才可达到94%.然而,当CaO2投加量超过6.9mmol/L时,甲基红的脱色效率会随着CaO2投加量的上升而下降.当CaO2投加量为41.7mmol/L时,此时溶液pH值升至10,脱色率下降,反应速率常数obs降至0.2435s-1.随着CaO2投加量的增大,溶液pH值升高,导致CaO2难以溶解,H2O2的释放也因此降低[19].另外,碱性条件下O3分子易转化为自由基,降低了可直接攻击甲基红的O3分子数,导致脱色率下降.

图5 CaO2投加量对O3/CaO2联用降解甲基红的影响
Zhang等[20]在Fe2+/CaO2联用降解水中三氯乙烯(TCE)的研究中发现,过量CaO2会使TCE的降解效率降低,当CaO2用量增加一倍时,反应15min后TCE的去除率从99.8%降至93.5%.CaO2粉末溶于水后会缓慢释放H2O2(CaO2+H2O→0.5O2+ Ca(OH)2; CaO2+2H2O→H2O2+Ca(OH)2)[5].CaO2投加量的增多会使溶解产生的H2O2的量增多,从而提高O3/CaO2联用时甲基红的脱色效率.但CaO2投加量过多会使溶解产生的H2O2相对过量,当H2O2浓度过高时会发生自分解现象(H2O2→O2+H2O),并且多余的H2O2还会消耗×OH等活性氧自由基(H2O2+×OH→HO2×+ H2O),从而使甲基红的脱色效率有所下降[21].
2.2.2 水中有机质的影响 草酸是水环境基质中大分子有机物经O3氧化的主要中间产物[11],因此选取草酸为水中有机质的代表物质,加入不同投加量(1.4,2.8,5.6,11.2mmol/L)的草酸时,研究对单独O3及O3/CaO2联用时甲基红脱色的影响,且根据拟合曲线得出反应速率常数obs,如图6所示.由图6可知,向O3/CaO2反应体系中加入不同浓度的草酸均可提高甲基红废水的脱色效率.在O3/CaO2反应体系中,草酸可与CaO2溶解释放的Ca2+发生反应生成草酸钙沉淀,促进CaO2释放H2O2的反应向右进行,提高H2O2的产量,从而提高目标物的降解效率.因此,水基质中草酸的存在并不会对O3/CaO2联用体系的降解作用造成影响,甚至会提高目标物的降解效率.
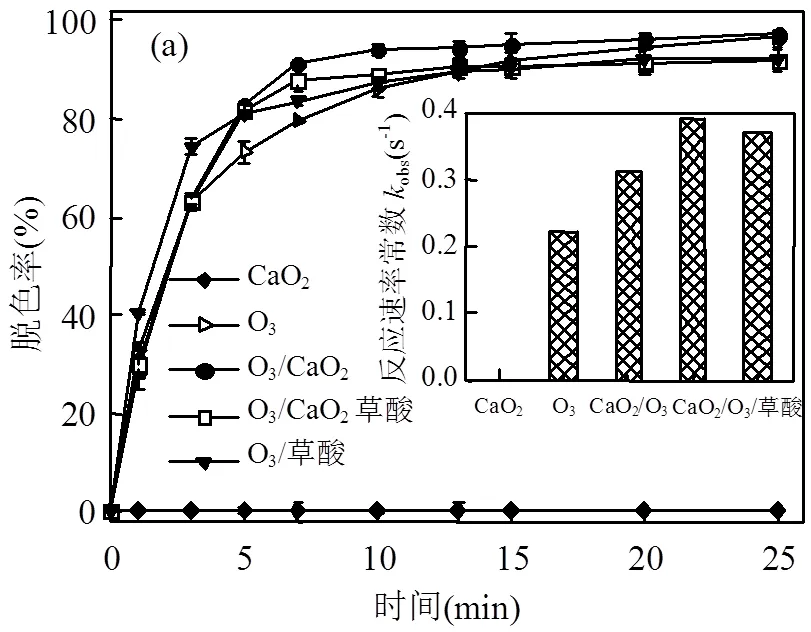
(a)不同工艺,(b)不同草酸浓度
2.2.3 不同水基质的影响 分别取蒸馏水(DI)、自来水(TW)、地下水(UW)、地表水(SW)及污水处理厂二沉池出水(EW)为背景水基质(地表水取自(N31°3¢39²,E121°12¢21²),地下水取自(N30°42¢37², E103°50¢28²)),研究不同水基质对O3/CaO2联用体系降解甲基红的影响.5种背景水基质的基本理化性质如表1所示.
不同水基质对O3/CaO2联用体系下甲基红溶液脱色效率的影响和反应速率常数obs如图7所示,脱色效率由高到低依次为地表水>蒸馏水>二沉池出水>自来水>地下水.其中地表水作为水基质时,反应速率最快,反应10min时甲基红的脱色率达97%.
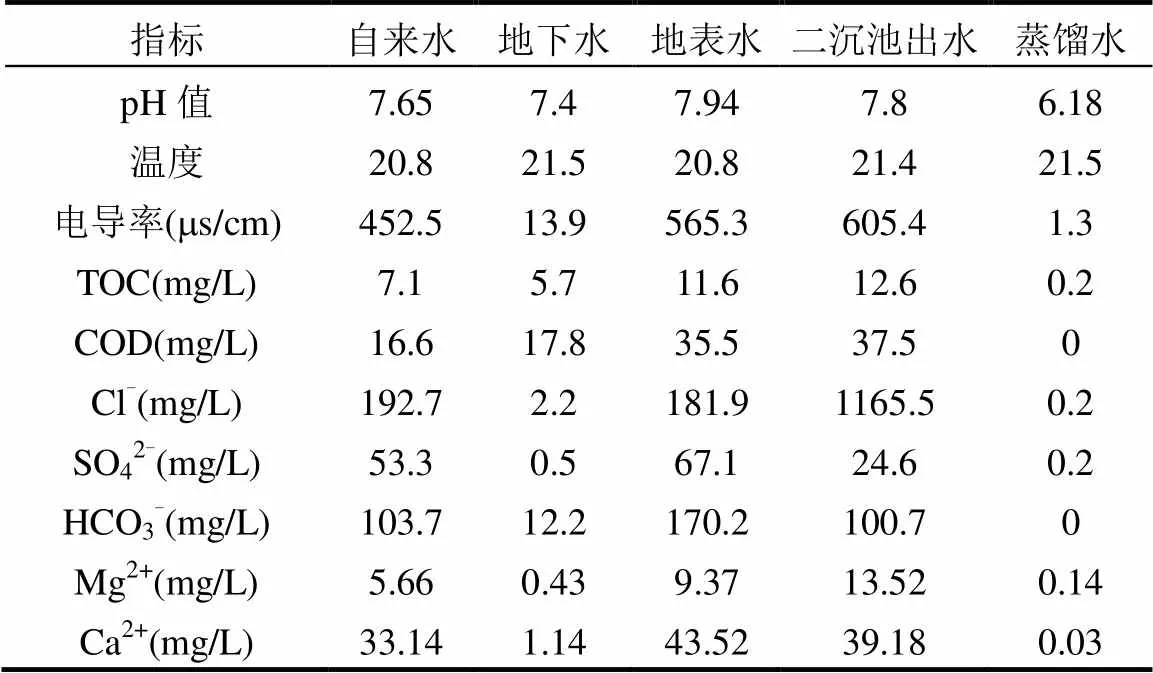
表1 不同水基质基本理化性质
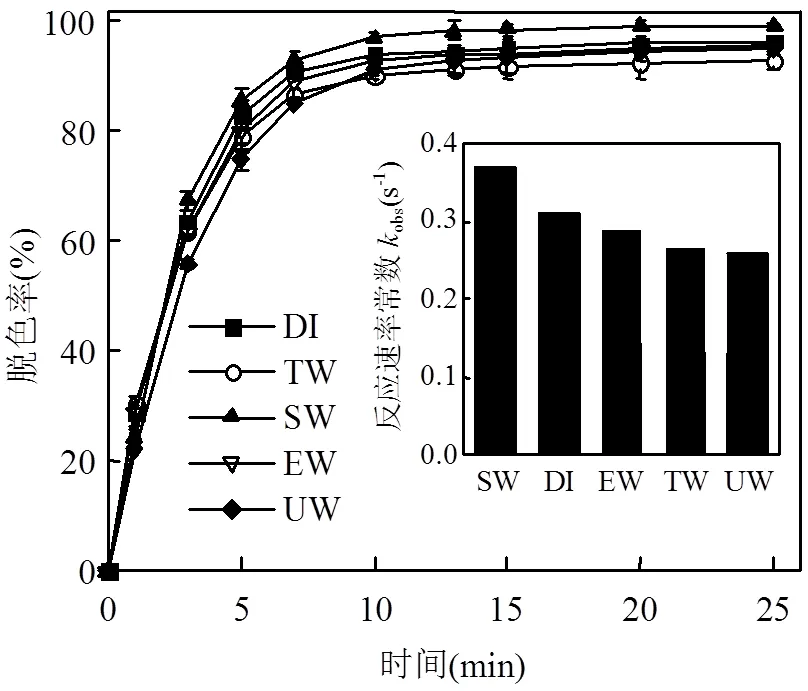
图7 不同水基质下甲基红脱色速率
由表1可以看出,地表水中SO42-、HCO3-的含量相比其他水基质中的含量均较高.废水中HCO3-的存在会猝灭氧化自由基,使目标物的降解率降低.但投加CaO2产生的OH-可与水基质中的HCO3-生成CO32-,与Ca2+生成CaCO3沉淀,减少HCO3-对羟基等自由基的消耗;同时,Ca(OH)2的消耗促进了反应CaO2+2H2O→H2O2+Ca(OH)2向右进行,提高了H2O2的产率,从而促进了目标物的降解.在O3氧化过程中,SO42-能抑制O3分子的分解并增加溶液中O3存在的时间[17,22],有利于O3分子直接攻击显色的偶氮基团,从而提高甲基红废水的脱色效率.Neppolian等[23]研究发现,SO42-具有攻击染料分子各种位置的独特性质,可导致染料分子快速断裂,有利于染料的降解和色度的去除.同时,地表水中Ca2+、Mg2+的含量也较高.Ca2+、Mg2+等金属阳离子可通过螯合或沉淀作用减少水中有机物杂质对氧化剂的竞争,提高O3和HO∙等氧化剂对目标污染物的降解率[24].向含有腐植酸的蒸馏水中分别投加不同浓度的SO42-、HCO3-、Ca2+、Mg2+(0~500mg/L)的试验结果表明,O3/CaO2联用过程中甲基红的脱色速率并不会受到抑制,证明了本文的结论.
除地表水外,蒸馏水作为水基质时,O3/CaO2联用体系下甲基红溶液的脱色效率也较高.在蒸馏水水基质中反应10min时,甲基红的脱色率达94%.这主要与蒸馏水的pH值有关.蒸馏水的pH值为偏酸性,而其他水基质的pH值均为中性偏碱性.如2.1.3所述,在pH=2~10的范围内,在酸性下,甲基红的脱色速率明显快于中性及碱性条件.除地表水与蒸馏水外,二沉池出水与自来水作为水基质时甲基红溶液的脱色效率也较高,在二沉池出水与自来水作为水基质时反应10min时,甲基红的脱色率分别达92%和90%.这与二沉池出水与自来水中SO42-、HCO3-、Ca2+、Mg2+等的含量也较高有关.综上所述,水基质对O3/CaO2联用体系氧化效果的影响较小,O3/CaO2联用体系在多种复杂水基质中都能达到较好的脱色效果.
2.3 O3/CaO2联用的协同作用机制研究
由2.2.2及2.2.3的分析结果表明,CaO2溶于水产生的Ca2+可消除复杂水基质中的HCO3-、CO32-、草酸等对O3及自由基的抑制及竞争,减弱水基质对O3氧化效果的影响,对O3氧化产生协同作用.除此之外,为验证O3/CaO2联用产生协同作用的其他可能的机制(如界面作用、产生H2O2的作用等),实验考察了CaO2颗粒反应前后的孔径、孔容等性质的变化情况,实验结果如图8所示.
从图8(a)CaO2孔径分布曲线可以看出,反应前后CaO2孔径分布范围较广(0~35nm),其中反应前CaO2孔径大多分布在0~10nm,空隙较小;而反应后CaO2孔径大多分布在5~20nm,孔隙变大.这表明CaO2颗粒具有一定的吸附能力,并且反应过程中部分溶解产生了H2O2,导致孔径变大.从图8(b) CaO2孔容的分布曲线也可以得出这一结论,在孔径为12~35nm之间的孔隙在反应后孔容均明显增加,这就说明反应过程中CaO2颗粒部分溶解产生H2O2,至使孔径和孔容均增大.Zhang等[25]发现,氧化反应前CaO2颗粒的比表面积显著大于氧化反应后的CaO2颗粒,并且反应后CaO2颗粒的平均孔径显著增大.CaO2较大的比表面积为污染物的吸附提供了可用的场所,随着反应时间的增加,CaO2颗粒的比表面积减小,其吸附能力也随之减小.

图8 CaO2颗粒孔径和孔容的分布曲线

另外,CaO2溶解产生的H2O2可生成HO∙,氧化降解甲基红及其中间产物.经草酸钛钾分光光度法测定,O3/CaO2联用体系的反应过程中H2O2含量始终维持在6~8mg/L,证明CaO2可缓慢持续生成H2O2.Zhang等[25]在CaO2去除水溶液中曲安奈德的研究中发现,HO∙是CaO2氧化过程中主要作用自由基.本实验中通过电子自旋共振法(ESR)检测了反应过程中产生的∙OH,结果如图9所示,相比单独O3处理,O3/CaO2联用时反应体系内∙OH信号强度显著增大.
因此,CaO2不仅可以产生H2O2促进染料被O3及∙OH降解,而且CaO2的固相颗粒形态本身具有的吸附作用也有利于目标污染物的氧化去除[26].
3 结论
3.1 单独O3氧化去除甲基红的效率随O3流量的增大而升高;在7~40℃范围内,反应体系温度的变化对甲基红去除效率的影响不大;在酸性和碱性条件下,甲基红的去除效率优于中性条件下.
3.2 O3/CaO2联用氧化对甲基红的处理效率明显优于单独O3氧化.在O3流量为48L/h,反应温度为26℃,初始pH值为6.2时,投加6.9mmol/LCaO2反应10min可使甲基红去除率达94%.并且水基质对O3/CaO2联用体系氧化效果的影响较小,O3/CaO2联用体系在多种复杂水基质中都能达到较好的去除甲基红的效果.
3.3 CaO2的投加主要是通过产生H2O2、屏蔽水基质中的O3竞争剂(有机质及阴离子)、产生界面吸附效应等机制对O3氧化产生协同作用.
[1] 石贾樱子,刘祥萱,王汝栋,等.树脂负载催化剂臭氧催化降解甲基红废水[J]. 净水技术, 2013,32(1):64-66.Shijia Y, Liu X, Wang R, et al. Ozone catalytic degradation of wastewater containing methyl red by employing fer-rum-loaded cation exchange resin [J]. Water Purification Technology, 2013,32(1):64-66.
[2] De S S, Bonilla K A, De A S.Removal of COD and color from hydrolyzed textile azo dye by combined ozonation and biological treatment [J]. Journal of Hazardous Materials, 2010,179(1–3):35-42.
[3] Quan X, Luo D, Wu J, et al. Ozonation of acid red 18wastewater using O3/Ca(OH)2, system in a micro bubble gas-liquid reactor [J]. Journal of Environmental Chemical Engineering, 2017,5(1):283-291.
[4] Parsa J B, Negahdar S H. Treatment of wastewater containing Acid Blue 92dye by advanced ozone-based oxidation methods [J]. Separation & Purification Technology, 2012,98(19):315-320.
[5] QianY, Zhang J, Zhang Y, et al. Degradation of 2,4-dichlorophenol by nanoscale calcium peroxide: Implication for groundwater remediation [J]. Separation & Purification Technology, 2016,166:222-229.
[6] Lu S, Zhang X, Xue Y. Application of calcium peroxide in water and soil treatment: A review [J]. J. Hazardous Materials, 2017,337:163-177.
[7] 沈拥军,苏 平,欧昌进.臭氧/活性炭组合工艺降解甲基红印染废水的试验研究[J]. 广东化工, 2011,38(11):81-83.Shen Y, Su P, Ou C. Experimental study on treatment of dyeing wastewater with ozone and activated carbon [J]. Guangdong Chemical Industry, 2011,38(11):81-83.
[8] Shen Y, Xu Q, Wei R, et al. Mechanism and dynamic study of reactive red X-3B dye degradation by ultrasonic-assisted ozone oxidation process [J]. Ultrasonics Sonochemistry, 2017,38:681-692.
[9] Song S, Xu X, Xu L, et al. Mineralization of CI Reactive Yellow 145 in Aqueous Solution by Ultraviolet-Enhanced Ozonation [J]. Industrial & Engineering Chemistry Research, 2008,47(5):1386-1391.
[10] Gomes A C, Nunes J C, Simões R M. Determination of fast ozone oxidation rate for textile dyes by using a continuous quench-flow system [J]. Journal of Hazardous Materials, 2010,178(1–3):57-65.
[11] Cardoso J C, Bessegato G G, BoldrinZanoni M V. Efficiency comparison of ozonation, photolysis, photocatalysis and photoelectrocatalysis methods in real textile wastewater decolorization [J]. Water Research, 2016,98:39-46.
[12] Muthukumar M, Sargunamani D, Selvakumar N, et al. Optimisation of ozone treatment for colour and COD removal of acid dye effluent using central composite design experiment [J]. Dyes & Pigments, 2004, 63(2):127-134.
[13] 陆 平.草酸钛钾分光光度法测定Fenton高级氧化系统中的过氧化氢 [J]. 建筑工程技术与设计, 2014,(8):582-582,517.Lu P. Spectrophotometric determination of hydrogen peroxide in Fenton advanced oxidation system with titanium oxalate [J]. Architectural Engineering Technology and Design, 2014,(8):582,517.
[14] Barrett E P, Joyner L G, Halenda P P. The Determination of Pore Volume and Area Distributions in Porous Substances. I. Computations from Nitrogen Isotherms [J]. Journal of the American Chemical Society, 1951,73(1):373-380.
[15] Langlais B, Reckhow D A, Brink D R, Ozone in Water Treatment [J]. Application and Engineering, 1990,44:117–121.
[16] 张 静,杜亚威,茹星瑶,等.pH对微气泡臭氧氧化处理染料废水影响[J]. 环境工程学报, 2016,10(2):742-748.Zhang J, Du Y, Ru X, et al. Effect of pH on microbubble ozonation treatment of dyeing wastewater [J]. Chinese Journal of Environmental Engineering, 2016,10(2):742-748.
[17] Asghar A, Abdul Aziz A R, Mohd A W D W. Advanced oxidation processes for in-situ production of hydrogen peroxide/hydroxyl radical for textile wastewater treatment: a review [J]. Journal of Cleaner Production, 2015,87(2):826-838.
[18] Katarzyna Paździor, Julita Wrębiak, Anna Klepacz-Smółka, et al. Influence of ozonation and biodegradation on toxicity of industrial textile wastewater [J]. Journal of Environmental Management, 2017, 195:166-173.
[19] Arienzo M. Degradation of 2,4,6-trinitrotoluene in water and soil slurry utilizing a calcium peroxide compound [J]. Chemosphere, 2000,40(4):331-337.
[20] Zhang X, Gu X, Lu S, et al. Degradation of trichloroethylene in aqueous solution by calcium peroxide activated with ferrous ion [J]. Journal of Hazardous Materials, 2015,284:253-260.
[21] 殷雪妍,张 艾,刘亚男.过氧化钙去除水中糖皮质激素的响应面分析 [J]. 中国环境科学, 2018,38(2):608-615.Yin X, Zhang A, Liu Y. Response surface analysis and optimization of glucocorticoid removal by calcium peroxide [J]. China Environmental Science, 2018,38(2):608-615.
[22] Beltrán F J.水和废水的臭氧反应动力学 [M]. 北京:中国建筑工业出版社, 2007.Beltrán F J. Ozone reaction kinetics in water and wastewater [M]. China Architecture & Building Press, 2007.
[23] Neppolian B, Sakthivel S, Arabindoo B, et al. Kinetics of photocatalytic degradation of reactive yellow 17dye in aqueous solution using UV irradiation [J]. Journal of Environmental Science and Health Part A Toxic/hazardous Substances & Environmental Engineering, 2001,36(2):203-213.
[24] Petre A L, Carbajo J B, Rosal R, et al. CuO/SBA-15catalyst for the catalytic ozonation of mesoxalic and oxalic acids. Water matrix effects [J]. Chemical Engineering Journal, 2013,225(3):164-173.
[25] Zhang A, Shen X, Yin X, et al. Application of calcium peroxide for efficient removal of triamcinolone acetonide from aqueous solutions: mechanisms and products [J]. Chemical Engineering J., 2018,345:594-603.
[26] Mashayekh-Salehi A, Moussavi G, Yaghmaeian K. Preparation, characterization and catalytic activity of a novel mesoporous nanocrystalline MgO nanoparticle for ozonation of acetaminophen as an emerging water contaminant [J]. Chemical Engineering Journal, 2017,310(1):157-169.
Removal of methyl red in aqueous by O3/CaO2treatment: influencing factors and synergetic effects.
HAO Si-yu, ZHANG Ai*, LIU Ya-nan
(College of Environmental Science and Engineering, Donghua University, Shanghai 201620, China)., 2019,39(2):591~597
The degradation of methyl red in dye wastewater by ozone (O3) and ozone/calcium peroxide (O3/CaO2) was studied. The effects of ozone flow rate, temperature, pH value, initial methyl red concentration, CaO2dosage, water matrix were investigated. The optimal conditions for methyl red degradation by O3oxidation were: ozone flow rate set as 48L/h, the temperature set as 26℃, the pH set as 6.2. At these optimal conditions, the removal efficiency reached 86.1% after oxidation for 10min. Adding 6.9mmol/L of CaO2at these optimal conditions could further accelerate the removal efficiency to 94%. The coexistence of oxalic acid in water would not inhibit the removal of methyl red during O3/CaO2treatment. The O3/CaO2treatment could achieve over 90% of methyl red removal in various real water matrices in 15min. The synergetic effects of O3and CaO2on methyl red degradation were explored for the first time. The O3/CaO2process could degrade organics effectively and improve the water quality.
methyl red;ozone;calcium peroxide;synergetic effects
X703.1
A
1000-6923(2019)02-0591-07
郝思宇(1994-),女,内蒙古包头人,东华大学环境科学与工程学院硕士研究生,主要从事高级氧化对水环境中微量有机物的去除研究.
2018-07-14
国家自然科学基金资助项目(51578122);中国博士后科学基金资助(2017M611423)
* 责任作者, 讲师, aizhang@dhu.edu.cn
