脊髓损伤中相关microRNA的研究进展
2019-02-22李庆宁综述荆珏华审校
刘 伟,祁 雷,李庆宁 综述 荆珏华 审校
脊髓损伤(spinal cord injury,SCI)是一种死亡率高、致残率高、医疗花费高的中枢神经系统 (central nervous system,CNS)疾病[1],随着现代社会经济和交通建筑事业的发展,其发病率逐年上升,我国每年新增病例超过6万人,给患者家庭以及社会带来沉重的经济负担,已经引起医师和学者的高度重视[2-3]。近 20 年来,随着分子生物学的发展和人类基因组计划的完成,临床上发现了一类新的由内源基因编码的长度约为24 个核苷酸的非编码单链RNA分子 (microRNA, miRNA),它们在动植物体内参与转录后基因的表达调控[4]。研究[5]表明,miRNA在SCI后的病理生理发展过程中发挥着重要的调节作用。因此研究miRNA在SCI病理发展过程中的功能及作用,可以给SCI的诊疗与康复提供新的治疗靶点和干预计策。
1 miRNA机制
1.1miRNA的形成机制miRNA是由20~24个核苷酸组成的单链非编码RNA,其在表观遗传水平上调节蛋白质的表达。它们最初从基因组DNA转录,主要是通过RNA聚合酶II以初级miRNA转录物的形式转录。初级miRNA长度可以是数千个碱基对,形成含有由反向重复组成的茎环的功能性二级结构[6],这些茎环被核糖核酸酶III识别和切割,导致从初级miRNA中释放前体miRNA[7]。通过输出蛋白5 (export protein 5, exportin-5)(参与核内RNA输出的蛋白质),前体miRNA被从 细胞核转运到细胞质中,经过一种核糖核酸内切酶Dicer和一种RNA结合蛋白TAR 的RNA结合蛋白处理,形成成熟miRNA 和相似长度的互补链[8],成熟的miRNA链一般具有生物活性,而互补链不具有生物活性,见图1。
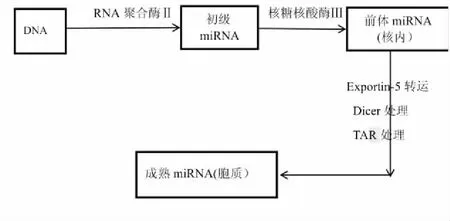
图1 成熟miRNA的形成
1.2miRNA对SCI后的作用机制RNA诱导的沉默复合物(RNA-induced silencing complex, RISC)中包含Argonaute家族的蛋白质在促进miRNA对mRNA的靶向和结合起到关键作用[9], 两者结合后由于mRNA的稳定性下降, miRNA-mRNA复合物的最终效果是降低蛋白质产量,见图2。定量蛋白质组学研究[10]显示,在生理条件下,单个miRNA可以下调数百种蛋白质的表达,但是变化的幅度很小(<4倍)。此外,降低蛋白质水平主要是由于mRNA不稳定而不是抑制翻译。这些发现表明,虽然特定的miRNA可能具有广泛的作用,但是对在细胞中引起功能相关变化相对较小。靶向类似途径基因的多个miRNA在细胞中引起功能相关的变化较大。miRNA靶向含有与miRNA'种子序列'互补的mRNA,miRNA种子序列是在miRNA的5'端包含2~7个核苷酸的区域,其在miRNA-mRNA结合中具有关键作用[11]。 mRNA上的miRNA结合位点通常在物种间保守,并且在3'非翻译区(untranslated region, UTR)中发现。 特定的miRNA可以在同一mRNA中具有多个结合位点,由此增强其整体效果。 然而,并不是所有的mRNA都被miRNA靶向。估计只有1/3的mRNA含有miRNA结合位点[12]。一些缺乏miRNA结合位点的mRNA转录物含有短的3'UTR,因此缺少miRNA结合域。 这种转录物逃避miRNA介导的抑制,许多这些“短”mRNA调节细胞的关键功能(DNA修复,蛋白质合成和增殖)。
1.3miRNA调控模式利用PicTar、MiRanda和TargetScan等生物信息学算法,可以预测miRNA的mRNA靶标。如上所述,一个miRNA可以结合许多不同的mRNA,并且相同的mRNA可以被不同的miRNA结合。 因此,相同miRNA可以调节功能上相关的基因家族的许多成员,由此增强miRNA介导的抑制的整体效应。 相反,同时上调靶向mRNA的多个miRNA,可以强烈抑制单个mRNA。 miRNAs能调控基因网络的各种模式,突出了这些分子的效能。

图2 miRNA的作用机制
2 相关miRNA
尽管miRNA 在人类疾病中的功能与作用尚需要进一步阐明,但是越来越多的研究表明,miRNA 可以作为一种全新的药物靶点。本部分重点阐述SCI研究领域的热点 miRNA 及其可能的分子机制,见表1。
2.1miRNA-21相关文献[13]报道了在人类许多不同的疾病(主要是癌症)中miRNA-21异常的表达现象,并且发现 miRNA-21表达上调与延长细胞存活、促进细胞生长、增殖以及减少细胞凋亡相关。研究[14]已证实miRNA-21的表达在许多CNS疾病如外伤性脑损伤(traumatic braininjury,TBI)中显著上调,并且与TBI诱导的细胞凋亡和神经元可塑性有关。Hu et al[3]通过miRNA-21拮抗剂抑制神经元中的miRNA-21的表达,导致大鼠后肢运动功能恢复减弱,损伤部位范围增大和正常组织范围减少。与阴性对照组相比,用miRNA-21拮抗剂处理显著增加了SCI后的细胞凋亡。促凋亡基因Fas配体(Fas ligand, FasL)、磷酸酶和张力蛋白同源物(phosphatase and tensin homolog, PTEN)和程序性细胞死亡蛋白4(programmed cell death protein 4, PDCD4)被证明是miRNA-21在许多疾病和细胞类型中的直接靶点,使用miRNA-21拮抗剂可增加体内FasL和PTEN的表达,但不影响PDCD4的表达。这些结果表明,miRNA-21在限制SCI后继发性细胞死亡中发挥着重要作用,并且miRNA-21的保护作用可能是其对促凋亡基因的调节的结果[15]。
另一个动物模型中,SCI后5周,miRNA-21的表达也显著增加,miRNA-21主要在培养的星形胶质细胞中表达[16-17],提示miRNA-21在星形胶质细胞中的作用可能是SCI后修复的关键点。Bhalala et al[16]在小鼠的星形胶质细胞中通过转基因过度表达了miRNA-21,结果显示星形胶质细胞中miRNA-21的过度表达一方面降低了对SCI的肥大反应。另一方面,星形胶质细胞中miRNA-21的抑制可导致病变部位的轴突密度增加。

表1 相关miRNA的相关信息
这些发现共同证明了miRNA-21在SCI恢复中的新作用,这种 miRNA-21对细胞增殖和生长的影响因细胞类型而异。在星形胶质细胞中有抑制作用,但在神经元中有促进作用。因此为了最大化发挥miRNA-21的治疗潜力,有必要对这些细胞特异性进行调节。
2.2miRNA-124CNS中特异性表达最为丰富的是miRNA-124。miR-124有3种亚型,其中以miRNA-124a最为常见。miRNA-124在急性脊椎外伤所致急性SCI中可能具有确诊价值。陈聚伍 等[18]研究发现脊髓完全损伤组、脊髓不完全损伤组患者外伤后24 h内的外周静脉血的 miRNA-124、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平都高于神经功能正常组,表明以上两项指标对于脊椎外伤患者的急性 SCI的确诊均有指导意义,其中miRNA-124诊断急性 SCI的特异度(90%)和灵敏度(90%)均高于TNF-α的特异度80%和灵敏度76.7%。所以有望将miRNA-124作为确诊脊椎外伤后急性SCI 的潜在检测标志物。 Song et al[19]在 SCI大鼠模型中研究了miR-124修饰的骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSCs)移植修复大鼠 SCI的机制。研究[19]发现,miR-124加速了 BMSCs向神经细胞的分化,促进了 SCI的修复。miRNA-124的过度表达抑制吡哆醛激酶(pyridoxal kinase,PDXK)的表达,这可能是miRNA-124如何促进 BMSCs分化的一个可能的机制,这项发现可能为 SCI治疗提供了一个新的目标。
2.3miRNA-133-bmiRNA-133-b通过降低ras同源蛋白A (ras homology protein A, RhoA)的表达来作为成年斑马鱼脊髓再生的重要决定因素[20]。Conrad et al[21]发现成年斑马鱼的SCI模型在脊髓横断后的再生脑干神经元中的miRNA-133-b表达被极度上调,反义吗啉代诱导的miRNA-133-b表达下调导致运动恢复减弱并轴突再生减少。miRNA-133-b靶向调节 RhoA,其表达在SCI后显著上调,而 RhoA的抑制促进了皮质脊髓束的修复,并通过减少 SCI后组织损伤来发挥神经保护作用[22]。这些研究使得miRNA-133-b和RhoA成为在SCI中具有吸引力的治疗靶点。
2.4miRNA-486与miR-21相类似,在鼠挫伤模型中SCI后第7天,同样检测到miRNA-486表达的增加。Jee et al[23]研究已经证明,将miRNA-486输注到健康小鼠的脊髓中会降低运动功能并增加神经元死亡。 相反,在小鼠SCI模型中敲除miRNA-486可以改善后肢功能恢复[24]。 运动神经元中miRNA-486的主要靶点是神经原性分化6 (neurogenic differentiation 6, NeuroD6),它是神经元分化和氧化应激反应的重要蛋白质[25]。 NeuroD6诱导SCI后谷胱甘肽过氧化物酶3(glutathione peroxidase 3,GPx3)和硫氧还蛋白样1(thioredoxin-like 1,TXNL1)的表达,可以有效清除 SCI中过度活性氧(reactive oxygen species, ROS)并减轻炎症[24]。基于这些发现,有希望的SCI治疗策略是可以通过上调NeuroD6表达来抑制miRNA-486,从而达到降低细胞凋亡并改善SCI后的功能缺陷的目的。
2.5miRNA-219和miRNA-338由脊髓CNS中的少突胶质细胞(oligodendrocytes,OLs)形成的髓鞘使轴突绝缘,从而加快动作电位传播。OLs损伤后髓鞘修复失败使衰弱性疾病中的脱髓鞘持续存在,如多发性硬化和脑白质营养不良[26]。miRNA-219和miRNA-338在成熟OLs中优先和大量表达[27-30],两种miRNA在从脊椎动物到人类的基因组进化中相对保守。Wang et al[31]研究发现miRNA-219缺陷不影响少突胶质前体细胞(oligodendrocytes precursor,OPC)形成,但是在发育过程中抑制它们的分化,miRNA-338对于CNS中的正常 OLs髓鞘形成不是必要的,但是miRNA-219在髓鞘形成中与miRNA-338协同能促进CNS 中的髓鞘修复。
3 总结与展望
到目前为止,已能证实单一 miRNA能够调节SCI后的关键过程,例如调控细胞炎症、死亡和凋亡。这些结果表明miRNA可以参与调控SCI后的继发损伤,促进损伤后的再生过程,从而有助于减轻SCI后的功能障碍。然而,CNS损伤后发生的细胞和分子变化是多种多样的,这就使单靶点治疗的疗效大大降低。由于众多miRNA可通过多种机制作用于靶RNA,参与SCI疾病的预后,因此针对各种途径中的多种miRNA组合进行相关研究是必要的。开发基于miRNA治疗是实现这一目标的有吸引力的手段。这篇综述讨论了SCI后miRNA的变化以及这些变化的生理和病理效应。然而,目前对SCI发病机制的了解仍然有限,需要做更多的研究来探索SCI相关miRNA的功能和靶点。
