miR-133b对喉癌细胞增殖、凋亡、侵袭的影响及机制研究
2019-02-22郭有新陈宝刚刘建伟马志红
郭有新,陈宝刚,刘建伟,李 立,张 红,马志红
喉癌(laryngeal carcinoma, LC)作为常见的头颈部恶性肿瘤,其主要病理类型为鳞状细胞癌,目前认为其发病与吸烟、饮酒、环境因素、放射线、病毒感染及微量元素的缺乏相关[1-2]。根据我国2015年全国肿瘤登记中心(NCCR)最新公布的中国癌症统计数据显示:2015年新发恶性肿瘤约429万例,死亡人数约281万;其中喉癌新发病例约2.64万,死亡人数约1.45万例[3],严重威胁人类的生命与健康。miRNA作为一类高度保守的非编码单链小RNA,已证实其通过转录后调控参与影响几乎所有的生理、病理进程,在多个物种中发挥重要作用[4-5]。不少miRNA被发现在喉癌发生过程中发挥着促进或者抑制的调节功能[6-7],但大部分miRNA在喉癌转移过程中的调控机制目前尚不明确。该研究探讨miR-133b对喉癌细胞增殖、凋亡、侵袭的影响及机制。
1 材料与方法
1.1细胞及主要试剂总RNA抽提试剂TRIzol购自美国Invitrogen公司;hsa-miR-133b mimics/NC、转染试剂riboFECTTM CP Reagent、hsa-miR-133b real-time PCR引物购自广州市锐博生物科技有限公司;逆转录试剂盒Reverse Transcription System、SYBR®PrimeScriptTMRT-PCR Kit试剂盒、mRNA SYBR Green荧光定量PCR试剂购自日本TaKaRa公司;Propidium Iodide/碘化丙啶、RNase A、MTT细胞增殖及细胞毒性检测试剂盒购自上海碧云天生物技术有限公司;喉癌Hep-2细胞购自北京协和基础研究所细胞中心。
1.2方法
1.2.1胃癌差异表达miRNA筛选 本研究基于GEO数据库下载并获取喉癌组织miRNA芯片高通量数据集GSE47610(GSM1153144- GSM1153148),其中包括3例喉癌组织样本与2例正常喉组织。本研究主要采用的生物信息学分析工具为Qlucore Omics Explorer (QOE)3.2,由瑞典隆德大学研制,一种新型的生物信息学分析软件,可用于分析基因芯片、基因表达、实时PCR以及DNA甲基化等多种生物学数据。
1.2.2实时定量PCR检测喉癌组织miR-133b表达量 选取河北省承德市医学院第二附属医院2015年6月~2017年6月收治的46例喉癌患者为研究对象,手术切除的喉癌组织标本为喉癌组,远离肿瘤的正常喉组织标本为对照组。TRIzol法提取组织总RNA,取10 μl RNA进行逆转录,采用U6作为内参进行相对定量分析,定量反应体系按照12.5 μl SYBR Premix Ex Taq,1 μl PCR Forward Primer, 1 μl Uni-miR qPCR Primer,2 μl cDNA模板,8.5 μl ddH2O,总体积为25 μl,每个样品设置3个平行孔。扩增程序为:预变性95 ℃、30 s;95 ℃、5 s,60 ℃、20 s,40个循环;采用2-ΔΔCt法计算miR-133b的相对表达量。
1.2.3转染hsa-miR-133b至Hep-2细胞及转染效率检测 培养并接种1×105个Hep-2细胞至含有适量完全培养基的24孔培养板中,使转染时的细胞密度达到30%~50%。用 30 μl 1× riboFECTTMCP Buffer稀释1.25 μl 20 μmol/L hsa-miR-133b mimic,轻轻混匀。加入3 μl riboFECTTM转染试剂,轻轻吹打混匀,室温孵育15 min。将培养板置于 37 ℃的CO2培养箱中培养24 h。荧光显微镜检测转染效率。其中,转染hsa-miR-133b NC设为对照组。
1.2.4MTT法检测细胞增殖 将过表达miR-133b组及NC组Hep-2细胞稳定培养后传代于96孔板,完全培养基培养,分别于24、36、48、72 h进行MTT检测。每组4个重复。96孔板每孔加入20 μl MTT (5 mg/ml PBS溶解),孵育4 h然后弃除上清液。每孔里面再加入150 μl Formazan溶解液,振荡10 min,充分溶解结晶物。酶标仪(490 nm)测定光吸收值。
1.2.5流式检测细胞周期 将过表达miR-133b组及NC组Hep-2细胞稳定培养后传代,完全培养基培养至24 h,用胰酶消化收集细胞,加入1 ml 75%预冷乙醇中,吹打均匀,4 ℃固定12 h以上,再加入PBS洗涤,离心1 000 r/min,5 min,清洗两次。重悬细胞用0.5 ml PBS,每孔加入PI和 RNaseA至终浓度50 μg/ml,37 ℃温浴30 min。流式细胞仪检测细胞周期。
1.2.6流式检测细胞凋亡 悬浮两组细胞离心(2 000 r/min离心5 min)收集,贴壁细胞用不含EDTA的胰酶消化收集,用PBS洗涤细胞两次(2 000 r/min离心5 min)收集5×105细胞,,加入500 μl的缓冲液悬浮细胞,加入5 μl Annexin V-EGFP混匀后,加入5 μl碘化丙啶,混匀,室温避光反应15 min,用流式细胞仪进行检测。
1.2.7细胞侵袭实验 将冻存于-80 ℃冰箱的BD matrigel 4 ℃过夜(24 h),变成液态,取300 μl无血清培养基,加入60 μl Matrigel,混匀,加入上室各100 μl,放入37 ℃培养箱中,孵育4~5 h,此间经常观察,当出现“白色层”时,说明已经变为固态。用无血清培养基洗Matrigel 1次,每孔加入100 μl两组细胞悬液,下腔室中加入500 μl含有20%FBS条件培养基,37 ℃培养箱中孵育24 h,取出Transwell用PBS洗2遍,5%戊二醛固定(4 ℃),加入结晶紫(0.1%)染色10 min,室温0.5 h,PBS洗2次,用棉球擦去上表面细胞,显微镜下观察。
1.2.8双荧光素酶载体法验证miR-133b靶基因 通过双荧光素酶报告基因检测系统,分别构建带有野生型和突变型GSTP1-3’UTR的报告载体pLUC;将hsa-miR-133b mimic、NC分别与pLUC- GSTP1-Mut、pLUC- GSTP1-WT共转染到293T细胞中,测定萤火虫荧光素酶相对活性。
1.2.9Western blot检测GSTP1蛋白 将过表达miR-133b组及NC组Hep-2细胞稳定培养后传代,完全培养基培养至24 h,提取两组细胞总蛋白,BCA法测定蛋白浓度,沸水变性,配制10%的分离胶及5%的浓缩胶,SDS-PAGE电泳;转膜后,加入用封闭液稀释的相应一抗,室温摇床孵育2 h,并用TBS洗膜3次,每次15 min;再加入用封闭液稀释的相应二抗室温摇床孵育1 h,并用TBS洗膜3次,每次15 min;ECL显色检测。

2 结果
2.1喉癌表达miRNAs的筛选基于GEO获取的喉癌组织miRNA芯片高通量数据,根据设定的数值过滤标准和中位值标准化处理,对表达差异miRNAs进行分层聚类分析,获得5个表达上调miRNA,8个表达下调miRNA,见图1。通过数据分析及前期实验室研究成果,选择miR-133b进行功能研究。
2.2miR-133b在喉癌中差异表达及临床特征关系采用Real-time PCR法检测miR-133b在23例喉癌组织和对应23例癌旁正常喉黏膜组织的表达,结果表明喉癌组织标本中miR-133b表达显著下调约4.1倍,差异有统计学意义(P<0.0001),见图2。此外,针对23例喉癌组织临床特征分析,表明miR-133b的表达水平与肿瘤局部浸润深度、是否存在区域淋巴结转移、患者临床分期以及组织学分级呈负相关,不同期别之间的差异有统计学意义,见表1。以上结果提示miR-133在喉癌的发生发展中可能具有关键的生物学作用。
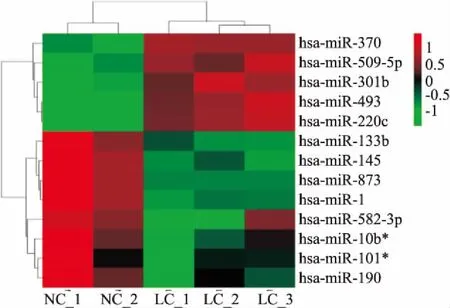
图1 喉癌表达miRNAs的筛选
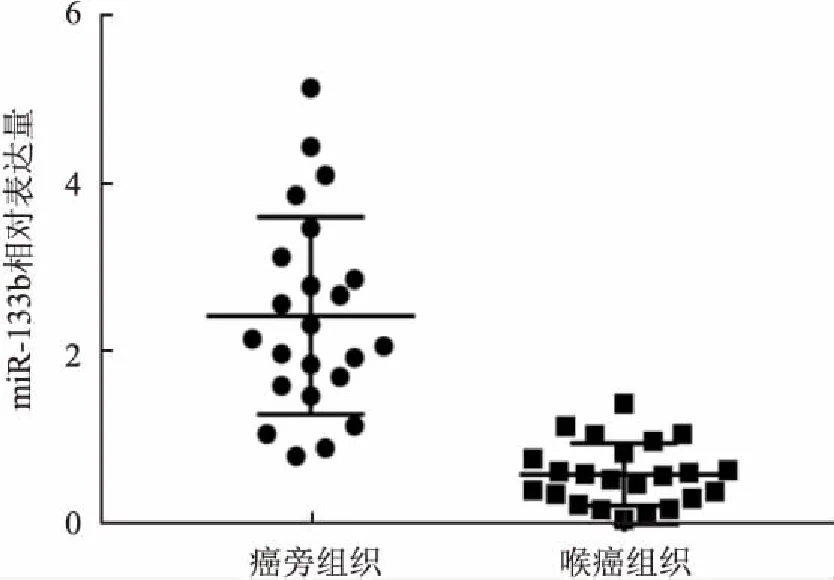
图2 hsa-miR-133b在喉癌组织中差异表达
2.3过表达miR-133b抑制喉癌细胞的增殖采用带有Cy3荧光蛋白的hsa-miR-133b mimic转染喉癌Hep-2细胞24 h后,荧光显微镜观察大致转染效率超过80%,见图3A。同时,Real-time PCR法检测miR-133b表达情况,结果表明相对于对照组,转染组miR-133b表达升高至30倍(P<0.0001),见图3B,表明转染成功。MTT法检测过表达miR-133b喉癌Hep-2细胞增殖情况,结果显示随着培养时间增加至72 h,miR-133b表现出显著性抑制喉癌增殖效果,尤其在48 h和72 h,抑制率达到(29.32±2.04)%和(34.81±2.76)%,见图3C。

表1 miR-133b表达与喉癌患者临床特征的关系
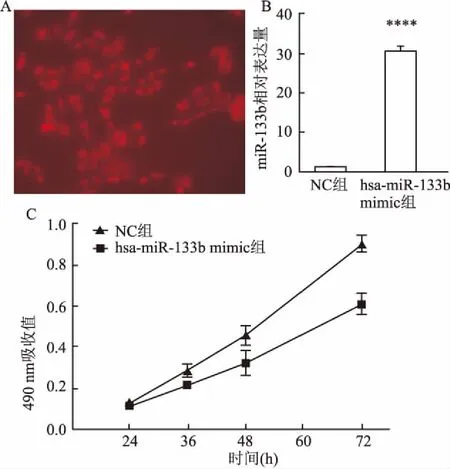
图3 过表达miR-133b抑制喉癌细胞的增殖
A:荧光显微镜观察采用带有Cy3荧光蛋白的hsa-miR-133b mimic转染效率;B:Real-time PCR法检测转染hsa-miR-133b 24 h后miR-133b表达情况;C:MTT法检测过表达miR-133b、NC喉癌Hep-2细胞增殖;与NC组比较:****P<0.000 1
2.4过表达miR-133b影响喉癌细胞周期通过流式技术PI单染法检测过表达miR-133b组及NC组细胞周期,结果显示相对于对照组,miR-133b过表达组S期细胞数量明显增多,说明细胞发生S阻滞,DNA合成受阻,细胞生长停滞,数量减少,见图4。

图4 过表达miR-133b影响喉癌细胞周期A:NC组;B:hsa-miR-133b mimic组
2.5过表达miR-133b促进喉癌细胞凋亡通过流式技术检测过表达miR-133b组及NC组细胞凋亡,结果显示对照组细胞凋亡率为(6.82±0.65)%,miR-133b过表达组凋亡率为(16.47±1.92)%,表明过表达miR-133b促进喉癌Hep-2细胞凋亡,差异有统计学意义(P=0.001 2),见图5。
2.6过表达miR-133b抑制喉癌细胞侵袭通过Transwell小室侵袭实验来检测细胞的侵袭转移能力,结果显示对照组细胞侵袭数目为(452±36),miR-133b过表达组细胞侵袭数目为(116±13),表明过表达miR-133b显著抑制喉癌Hep-2细胞侵袭,差异有统计学意义(P=0.000 1),见图6。
2.7miR-133b靶基因GSTP1的预测与验证使用TargetScan数据库对miR-32进行靶基因预测,从预测结果中挑选GSTP1等候选基因进行实验。通过双荧光素酶报告基因检测系统,分别构建带有野生型和突变型GSTP1-3’UTR的报告载体pLUC;将hsa-miR-133b mimic及NC分别与pLUC-GSTP1-Mut、pLUC-GSTP1-WT共转染到293T细胞中,通过测定萤火虫荧光素酶相对活性,结果表明hsa-miR-133b可以显著降低pLUC-GSTP1-WT中hRluc表达(P=0.043),并且针对pLUC-GSTP1-Mut没有作用,见图7。说明miR-133b可以通过GSTP1-3’UTR结合位点调控hRluc的表达,进而表明其存在靶向调控的关系。

图5 过表达miR-133b促进喉癌细胞凋亡A:NC组;B:hsa-miR-133b mimic组
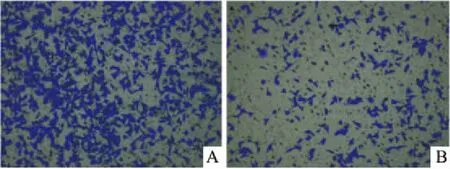
图6 过表达miR-133b抑制喉癌细胞迁移 ×200A:NC组;B:hsa-miR-133b mimic组
2.8过表达miR-133b降低靶基因GSTP1表达Western blot检测过表达miR-133b组及NC组GSTP1蛋白表达,结果显示过表达hsa-miR-133b可以明显下调GSTP1蛋白表达量(P=0.013),见图8。

图7miR-133b靶基因GSTP1的预测与双荧光素酶报告基因验证
与NC组比较:*P<0.05
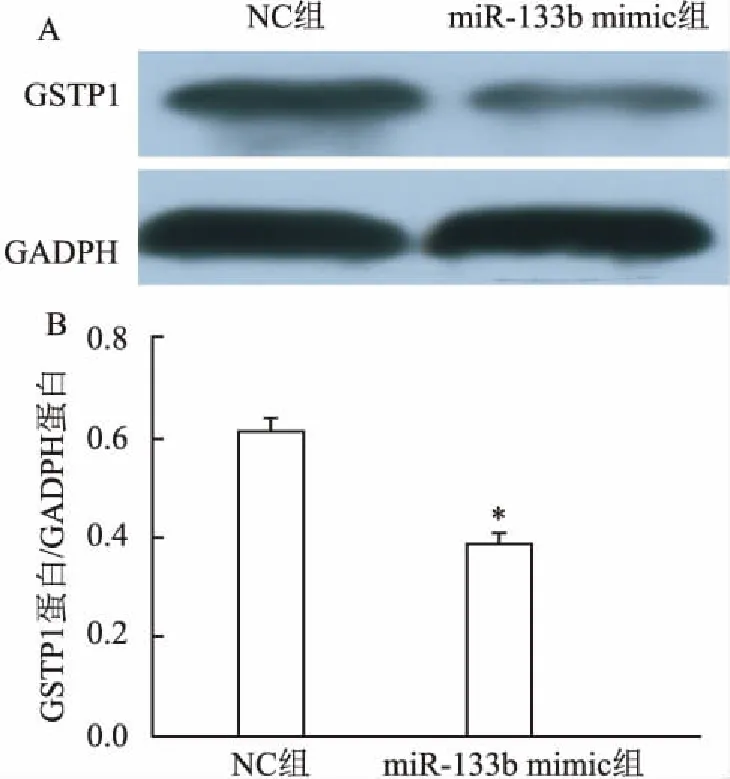
图8 过表达miR-133b降低靶基因GSTP1表达与NC组比较:*P<0.05
3 讨论
随着以miRNA为代表非编码RNA在肿瘤领域研究的不断深入,越来越多的喉癌相关miRNA被发现深度参与其发生发展治疗过程中。Shen et al[8]用亚硫酸氢盐测序技术针对104个喉癌组织及对应癌旁组织进行miR-34a启动子区域CpG6位点DNA甲基化水平测序,结果表明喉癌组织中miR-34a启动子甲基化程度显著高于对照组,此外,通过Kaplan-Meier存活曲线分析表明miR-34a启动子高甲基化与总生存率差相关(Log-Rank检验,P<0.05)。Liu et al[9]研究发现miRNA-125a在喉癌组织和喉癌干细胞Hep-2-CSCs中低表达,且miRNA-125a可以通过靶向调控造血细胞特异性相关X-1逆转喉癌干细胞的顺铂抗性,过表达miRNA-125a后,发现细胞对多柔比星、依托泊苷、长春新碱的耐药性大大提升。Zhou et al[10]研究表明miR-632在喉癌组织和喉癌细胞系中均表现为明显上调表达,且其促进细胞增殖和克隆形成,促进细胞迁移和侵袭,增强细胞增殖相关蛋白、cyclinD1和c-myc表达,且Pearson相关分析显示miR-632表达与喉癌组织中GSK3 mRNA表达呈负相关。这些异常表达miRNA发挥喉癌癌基因或抑癌基因作用,有望作为喉癌的早期诊断的新标志物,某些miRNA更有望可以作为喉癌的新治疗靶点。
本研究前期基于GEO获取的喉癌组织miRNA芯片高通量数据,分析差异表达miRNA并选择miR-133b进行功能研究。首先,收集喉癌组织样本,检测表明喉癌中miR-133b表达显著下调约4.1倍,且miR-133b的表达水平与肿瘤局部浸润深度、是否存在区域淋巴结转移、患者临床分期以及组织学分级呈负相关,提示miR-133b在喉癌的发生发展中可能具有关键的生物学作用。其次,转染hsa-miR-133b mimic转染喉癌Hep-2细胞,实现细胞水平过表达miR-133b。本研究通过细胞增殖、细胞周期、细胞凋亡、细胞侵袭等实验表明过表达miR-133b可以显著抑制喉癌细胞的增殖、影响喉癌细胞周期、促进喉癌细胞凋亡以及抑制喉癌细胞迁移,提示miR-133b在喉癌发展中扮演了抑癌基因的角色。最后,考虑到miRNA作为一种内源性非编码RNA,其发挥功能方式主要通过完全或者部分互补结合靶基因3’非翻译区影响靶mRNA稳定性,甚至降解mRNA,从而实现转录后水平调节靶基因的表达。通过生物信息学预测,笔者发现GSTP1是miR-133b潜在靶基因之一,通过双荧光素酶报告基因实验明确其之间确实存在关系,且过表达hsa-miR-133b可以明显下调GSTP1蛋白表达量,意味着miR-133b可能是通过调控GSTP1来发挥其在喉癌中的作用。
谷胱甘肽转移酶Pl(glutathione S-transferase pi, GSTP1),基因定位于染色体的1lql3,该基因全长约3 bp,包括6个内含子和7个外显子,编码210个氨基酸,属于谷胱甘肽S-转移酶(glutathione S-transferases, GSTs)。GSTs能催化谷胱甘肽与亲电子物质发生反应,对芳香族化合物具有较高降解性[11]。诸多研究[12]表明GSTP1在预防肿瘤发生的过程中起重要作用,但同时也是肿瘤细胞对化疗药物耐受的原因,并与许多耐药相关基因在肿瘤中共表达。在膀胱癌研究中,唐荣金 等[13]通过慢病毒表达系统,建立稳定低表达GSTPl基因的膀胱癌细胞T24细胞株,发现GSTPl表达下调抑制T24细胞增殖,并其机制可能与促进T24细胞凋亡相关。在喉癌研究中,周建荣[14]通过建立人喉鳞癌组织及其癌旁正常黏膜组织的双向凝胶电泳图谱,识别鉴定其差异表达的蛋白质,结果表明GSTP1在喉癌中表达上调,这与本研究中miR-133b在喉癌中表达下调,且通过靶向结合GSTP1发挥作用一致。近年来发现GSTP1多态性与肿瘤的易感性关系密切,有研究通过meta分析GSTP1基因启动子区甲基化检测在前列腺癌临床诊断中的意义,发现前列腺癌GSTP1基因启动子区相比正常对照组呈现显著高甲基化,差异有统计学意义(OR=17.98, 95%CI:12.16~26.58,P<0.000 1),不同亚组间差异无统计学意义[15]。Matthias et al[16]发现GSTP1基因型频率在喉癌与对照中的分布情况差异有统计学意义,该基因多态性可能与喉癌的遗传易感性存在关联。
综上所述,本研究表明miR-133b通过GSTP1对喉癌Hep-2细胞增殖、凋亡、侵袭行为的影响及其对肿瘤局部浸润深度、是否存在区域淋巴结转移、患者临床分期以及组织学分级呈负相关等临床意义,为将来基于miR-133b进行喉癌临床诊断、预后判断及分子靶向治疗提供新的思路和理论依据。
