分步添加AlOOH溶胶对Cu/Zn/Al催化剂催化合成气制乙醇的影响
2019-02-18刘雷强边仲凯顾尹婷
刘雷强,边仲凯,顾尹婷,黄 伟
(太原理工大学煤科学与技术教育部与山西省共建重点实验室,山西 太原 030024)
乙醇是一种优质的清洁能源和汽油添加剂,目前,全球工业乙醇的规模化生产主要是通过粮食发酵法和乙烯水合成法,其中粮食发酵法占到乙醇总产量的90%。保障国家粮食安全是发展生物燃料乙醇产业的基础和前提[1],但是粮食发酵法需要消耗大量的农作物作为原料,且成本和能耗过高,不符合我国耕地少、人口多的现实国情。因此,基于我国的能源现状和国家对环保的日益重视,大力发展煤炭的清洁利用,开发以煤炭为原料经合成气制备乙醇的技术路线,不仅可以充分发挥我国煤炭资源丰富的能源优势,也可以减少煤炭资源粗放利用带来的生态问题。
合成气制乙醇的技术路线主要有直接合成与间接合成法。间接合成法主要包括了乙酸酯加氢以及二甲醚羰基化加氢技术路线。间接法的技术路线复杂,涉及的工艺设备多,而直接合成法技术路线简单,能耗及设备投入较少。在直接合成法中,贵金属Rh具有最好的乙醇选择性[2],但其价格昂贵,资源有限,限制了其大规模的工业化应用。而Cu基催化剂具有反应压力低、反应温度温和、催化剂成本低等优点[3],这使其有广阔的应用前景。
本课题组黄伟等[4-6]在长期的实验过程中,以催化剂的成长与环境之间存在不可分割的本质联系为出发点,提出了新的催化剂制备方法——完全液相法。以此方法为基础,课题组在对Cu/Zn/Al催化剂催化合成气制乙醇的研究过程中发现,AlOOH组分对于CO解离以及链增长存在积极的作用[7];Bai等[8]通过密度泛函理论的计算结果也表明,γ-AlOOH的001晶面可以促进C-C键的形成,从而有利于乙醇的生成。这说明催化剂中的AlOOH组分并不单纯的以载体的形式存在,而很有可能作为一种活性组分参与催化过程。本文将从改变AlOOH溶胶的添加方式入手,采用分步加入的方法,研究其对催化剂结构和性能产生的影响。
1 实验部分
1.1 试剂
硝 酸 铜[Cu(NO3)2·3H2O],硝 酸 锌[Zn(NO3)2·6H2O],乙二醇[(CH2OH)2],石油醚,液体石蜡,聚乙烯吡咯烷酮(PVP),均为分析纯,天津科密欧化学试剂开发中心生产;异丙醇铝[Al(C3H7O)3],分析纯,天津光复精细化工研究所生产;浓硝酸(65%~68%),西陇化工股份有限公司生产;司班-80,化学纯,天津市化学试剂三厂生产;去离子水,太原理工大学中试基地制备;N2、H2、Ar(≥99.99%),太原市达江气体有限公司提供;CO(99.9%),北京氨普北分气体工业有限公司提供。
1.2 催化剂制备
催化剂的制备方法为溶胶凝胶法。为了研究分步添加Al溶胶对催化剂的影响,控制Al总量为0.1mol不变,将Al溶胶的添加分为两步:
第一步:将磨细的异丙醇铝溶解于乙二醇搅拌8h,硝酸铜和硝酸锌混合溶解于50mL乙二醇搅拌均匀;往三口烧瓶加入含有PVP的去离子水并升温至85℃,之后将异丙醇铝溶液滴加至三口烧瓶中水解1h,再加入1mL的浓硝酸解胶0.5h;解胶完成后,将铜锌溶液缓慢滴加至铝溶胶中并升温至95℃,在95℃下搅拌至催化剂呈溶胶状态为止。在该步骤中,控制异丙醇铝的用量分别为0.1mol、0.075mol和0.05mol,制备三个不同的催化剂,三个催化剂的nCu/nZn/nAl分别为2:1:0.8、2:1:0.6、2:1:0.4。
第二步:按照相同的方法制备另外的两份铝溶胶,异丙醇铝的用量分别为0.025mol、0.05mol。将0.025mol与0.05mol铝溶胶分别加入第一步中制备好的nCu/nZn/nAl为2:1:0.6与2:1:0.4的催化剂中并在常温搅拌1h制得催化剂前驱体。
将制备好的催化剂前驱体在室温下老化10d,之后加入300mL液体石蜡和少量span-80,在N2氛围下升温至280℃热处理8h得到成型催化剂。
将制得的三个催化剂分别命名为Cat-0、Cat-1、Cat-2。Cat-0代表未分步添加Al溶胶的催化剂,Cat-1代表第二步添加0.025mol铝溶胶的催化剂,Cat-2代表第二步添加0.05mol铝溶胶的催化剂。
1.3 催化剂评价
催化剂的评价过程在500mL高压浆态床反应釜中进行。首先在常压下对催化剂进行还原处理,之后将还原气切为反应气并加压反应,以下为催化剂还原条件与反应条件:
还原条件:还原气(V(H2):V(N2)=20:80)的流量为75mL/min,催化剂的还原温度280℃,还原时间10h,程序升温速率为0.5K/min,搅拌转速1000r/min。
反应条件:反应压力4.5MPa,反应气(V(H2):V(CO)=2:1)流量为150mL/min,反应温度250℃,程序升温速率0.5K/min,搅拌转速1000r/min。
产物组成在GC-950气相色谱上进行离线分析。色谱共有两个氢火焰检测器FID、一个热导检测器TCD。进入色谱的样品分为两路,一路经GDX-502色谱柱分离后直接通过FID检测器对产物中的C1~C5烃类、甲醇(MeOH)、乙醇(EtOH)、二甲醚(DME)进行检测,另一路经TDX-01色谱柱分离后先通过TCD检测器对产物中的H2进行检测,之后通过转化炉(镍催化剂)进入FID检测器,对产物中的CO、CO2进行检测分析。气相产物每天采样次数为三次,每8h取一次样,液相产物经冷凝后每天采样一次。产物分析方法采用甲烷归一化法,以各通道中甲烷含量为基准对其余各组分含量进行定量分析计算,经碳平衡后计算各产物的选择性和CO转化率。
1.4 催化剂表征
反应前后的催化剂以石油醚为介质,经索氏抽提2d后得到可以表征的催化剂固体粉末。
XRD表征在日本Rigaku D/max2500型X射线衍射仪上进行。辐射源为CuKα,Ni为滤片,连续扫描范围10~80°,扫描速率8°/min;电流100mA,管电压40kV。晶体粒径以谢乐公式计算。H2-TPR表征在天津先权仪器厂生产的TP-5080型程序升温吸附仪上进行。催化剂用量为50mg,还原气(V(H2):V(N2)=5:95)流量20mL/min,温度从50℃以10℃/min的速率升温至510℃,热导池检测耗氢量。
NH3-TPD-MS表征在天津先权仪器厂生产的TP-5080多用吸附仪上完成,催化剂用量为100mg。催化剂先在氢氮混合气、280℃下还原0.5h,降温至50℃下吸附NH30.5h,切换He气吹扫管路以及物理吸附NH3,之后以10℃/min的升温速率从50℃升温到810℃,以质谱检测器(QIC-20)检测脱附NH3。
N2-吸脱附曲线在美国康塔公司生产的Quanta chrome QDS-30物理吸脱附仪上完成。测脱附曲线之前催化剂先在200℃下脱气4h,之后在-196℃下测定吸脱附曲线,以BET公式计算催化剂比表面积,BJH法计算孔径分布。
2 结果与讨论
2.1 催化剂性能评价
图1为CO转化率、各产物选择性以及甲醇和乙醇占总醇(ROH)比例随时间变化的趋势图;其中,图(a)CO转化率,图(b)、(c)、(d)、(e)分别为总醇、DME、烃类、CO2的选择性,图(f)、(g)分别为甲醇和乙醇与总醇的碳的物质的量比。
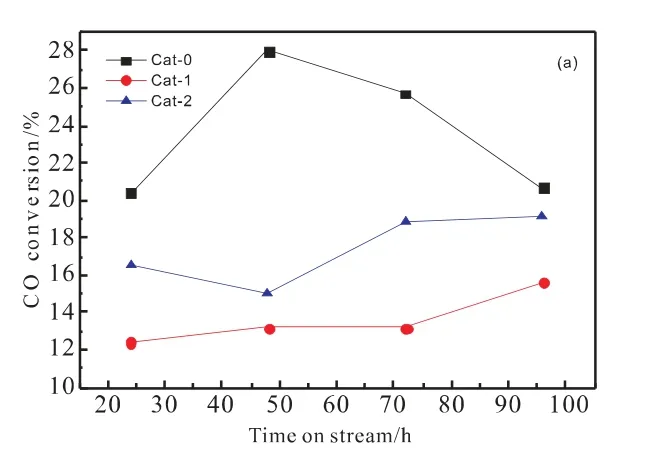

图1 催化剂反应性能评价结果Fig.1 Evaluation results of catalyst reaction performance
从图1中可以看出,三个催化剂的CO转化率随着反应时间的延长有着不同的变化趋势。采用分步添加铝溶胶的方法后,催化剂的CO转化率随反应时间延长有一定的上升,这说明催化剂的稳定性得到了提高,但是也可以发现其CO的转化率相对于Cat-0有所下降,且Cat-1下降较多。值得注意的是,Cat-0的DME选择性在4天的评价过程中最高仅为0.5%,而在分步添加铝溶胶后,其DME的选择性明显提高;Liu等[9]认为,AlOOH上的酸性位点是甲醇脱水合成DME的活性中心,结合Cat-0、Cat-1和Cat-2的NH3-TPD表征(见2.4)以及评价数据可以推测,虽然Cat-2与Cat-1当中的弱酸位点少于Cat-0,但是其甲醇选择性均明显高于Cat-0,因此较多的甲醇是促进Cat-1与Cat-2中二甲醚生成的原因。Cat-1与Cat-2烃类选择性变化相似,均随着反应时间逐渐降低,CO2的选择性则为Cat-0>Cat-1>Cat-2。从总醇选择性和乙醇占总醇比来看,Cat-1和Cat-2的总醇选择性相差不大,在反应至72h后,其值要明显高于Cat-0,在反应至96h时Cat-1达到了49.0%,而Cat-0的乙醇占比最高,在反应48h时最高为67.2%,这说明分步添加Al溶胶可以提高总醇选择性,但不利于提高催化剂中乙醇占总醇比。
2.2 XRD表征
图2为三个催化剂反应前(a)和反应后(b)的XRD谱图。
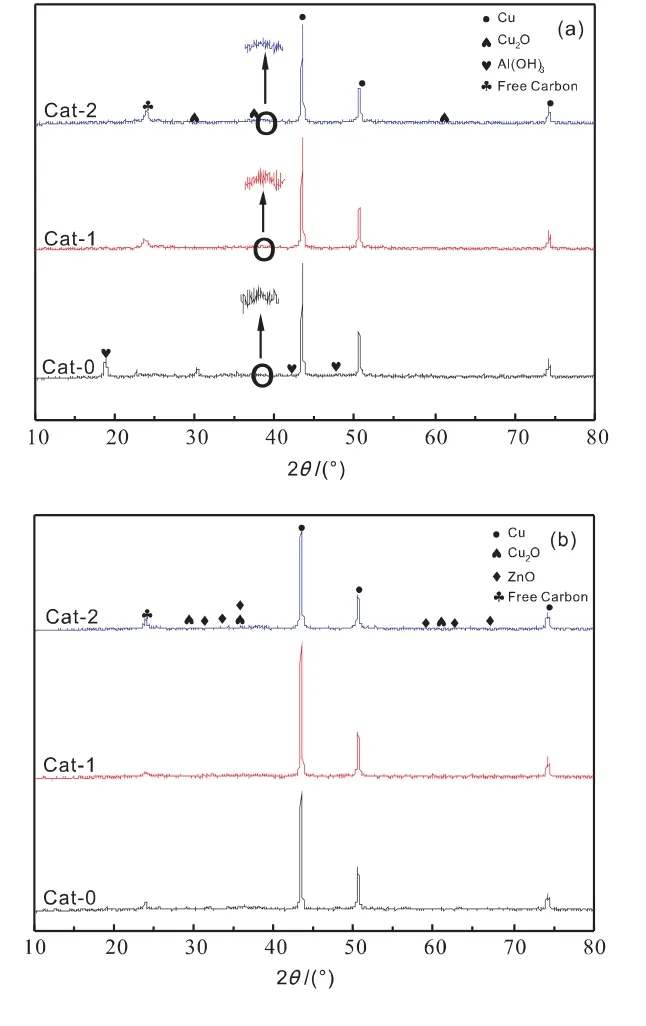
图2 催化剂反应前(a)反应后(b)XRD谱图Fig.2 XRD patterns of different catalysts before (a)and after(b)reaction
如图2所示,三个催化剂在反应前后均出现了Cu0(2θ=43.5°,50.6°,74.3°)以及微弱的Cu2O衍射峰,未出现CuO的衍射峰,这是由于在热处理过程中,二价铜离子会被液体石蜡还原为一价铜离子,之后继续被还原为单质铜[10]。从图2(a)可以看出,Cat-1的Cu2O的衍射峰峰形较为尖锐,说明Cat-1中的Cu2O结晶度较高,晶粒度较大;Cat-0在反应前出现了Al(OH)3(2θ=18.7°,40.7°,53.1°)的衍射峰,在反应后衍射峰消失,而Cat-1与Cat-2反应前后都没有Al物种的特征峰出现,这表明分步添加Al溶胶促进了Al物种的分散,还表明Cat-0中的Al物种除形成AlOOH相,部分还形成了Al(OH)3;反应前催化剂中未见ZnO晶相,说明其分散度较好,在反应过程中ZnO发生了一定的团聚,因此反应后三个催化剂中均出现了微弱的ZnO衍射峰。催化剂反应前后的Cu0晶粒尺寸如表1所示。可以发现,这三个催化剂在反应前后其Cu0晶粒尺寸都较大,在44~55nm之间,且Cat-0>Cat-1>Cat-2,说明分步添加Al溶胶可以促进Cu的分散,减小其晶粒度;结合评价数据可以发现,虽然Cat-0的Cu0晶粒尺寸较大,但其活性却最高,这表明催化剂的活性还受其它性质的制约;另外,文献[11]认为较大的Cu0晶粒度有利于CO插入成醇和碳链的增长,但从本实验的结果来看,在反应后,Cat-1的晶粒度最大,但其乙醇占比却低于Cat-0,这说明Cu晶粒度与乙醇选择性并不是简单的线性关系,存在多种因素共同影响乙醇的生成。
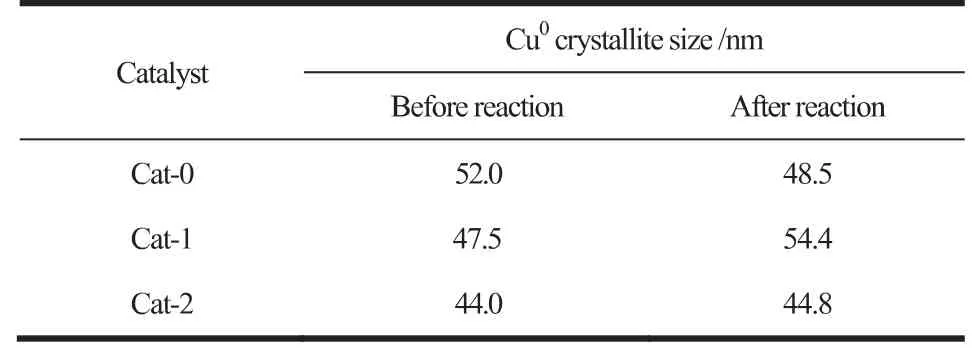
表1 催化剂反应前后平均Cu0晶粒尺寸Table 1 Average crystallite sizes of Cu0 in different catalysts before and after reaction
2.3 H2-TPR表征
图3是催化剂反应前的H2-TPR图。从图中可以发现,所有催化剂均出现了低温、中温以及高温三个还原峰,催化剂中Cu物种所处的化学环境较为复杂。结合XRD可知,三个还原峰均归属于Cu+→Cu0的还原。可以发现,三个催化剂的中温以及高温还原峰的峰顶温度在290~370℃之间,而Cu2O的还原温度一般在180~260℃之间,这种高温方向的偏移是由于催化剂中Cu2O物种的颗粒尺寸较大[12],且Cu与Zn、Al之间存在较强的相互作用导致的[13]。
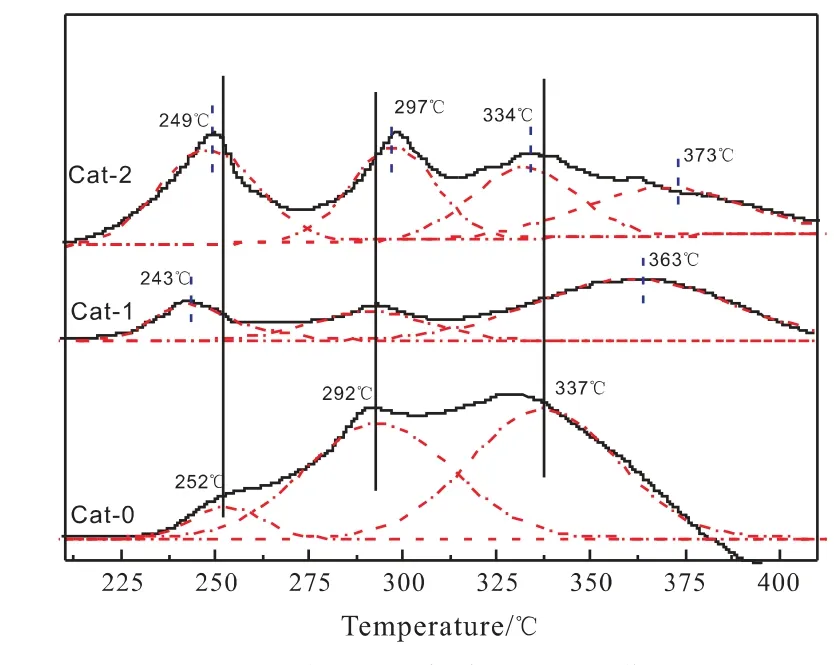
图3 催化剂反应前H2-TPR谱图Fig.3 H 2-TPR profiles of different catalysts before reaction
催化剂各还原峰的峰顶温度以及耗氢量如表2所示。从还原峰的温度来看,Cat-2的各还原峰温度与Cat-0相差不大,仅有较小的偏移,而Cat-1的高温还原峰温度相对Cat-0则偏移较大,结合XRD表征可知,这是由于Cat-1催化剂中Cu2O的晶粒尺寸较大,从而更难还原。随着分步添加Al溶胶量的增加,三个催化剂的低温耗氢量也依次增加,说明催化剂当中易还原的Cu量有所增加;从Cat-0到Cat-2,三个催化剂高温耗氢量则一直减少,表明分步添加Al量的增多不利于催化剂中难还原Cu量的增加。结合评价结果,催化剂中难还原的Cu量与CO转化率存在较好的对应,这表明催化剂的活性位点可能与Cu+的存在相关。另外,文献认为[14,15],催化剂中适宜的Cu+/Cu0比例对于乙醇的生成是有利的,Cat-0中较多的难还原铜使其有着适宜的Cu+/Cu0,从而有较好的乙醇选择性。
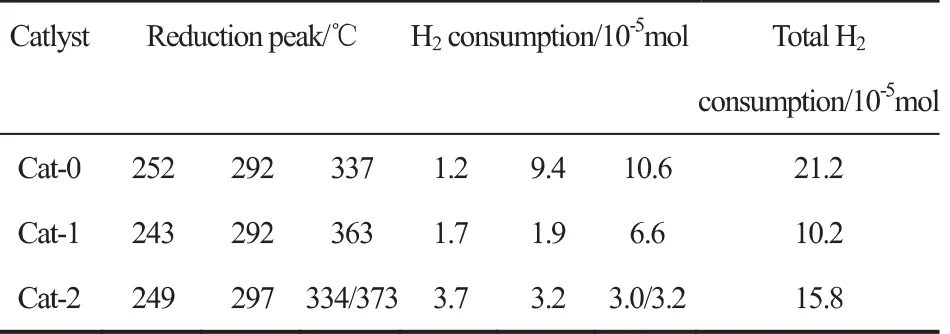
表2 反应前催化剂H2-TPR耗氢量Table 2 Hydrogen consumption from H 2-TPR
2.4 NH3-TPD-MS表征
催化剂的NH3-TPD表征如图4。反应前,Cat-0在148℃和450℃处出峰,Cat-1和Cat-2则在148℃和475℃处出峰;反应后,三个催化剂均在148℃和437℃处出峰。所有催化剂在反应前后均只出现了两个脱附峰,其中,148℃处为低温脱附峰,对应于催化剂中的弱酸位点;400~500℃为高温脱附峰,对应于催化剂中的强酸位点。表3为催化剂表面酸量。可以发现,催化剂中的酸性位点主要为弱酸位。反应前后,催化剂的弱酸和强酸量的大小关系均为Cat-0>Cat-1≥Cat-2,表明分步制备Al溶胶的方法会减少催化剂表面的弱酸和强酸量。在反应后,催化剂的弱酸量明显减少,而强酸量则略有增加,这说明随着反应的进行,催化剂表面的酸性位点发生变化,弱酸位点遭到破坏,而强酸位点则更多的暴露出来,这也是影响催化剂活性稳定的因素之一。结合催化剂的评价数据可以发现,三个催化剂的乙醇选择性与催化剂的弱酸量成正相关,这与课题组的前期研究结果相同[16]。

图4 催化剂反应前(a)反应后(b)的NH3-TPD脱附曲线Fig.4 NH 3-TPD desorption curves of different catalysts before(a)and after(b)reaction
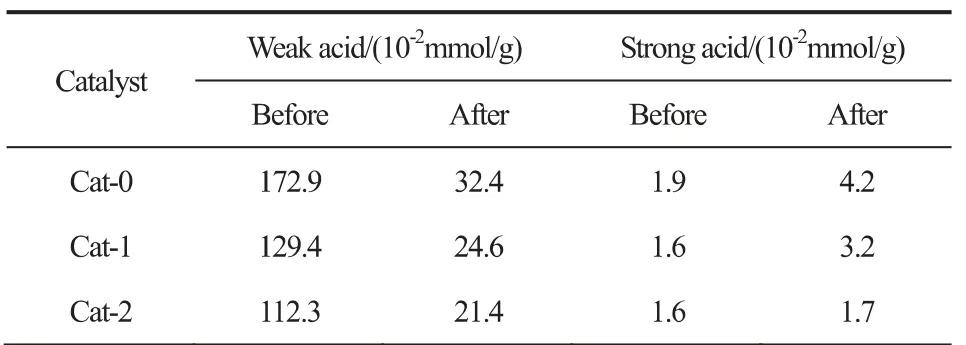
表3 反应前后催化剂表面酸量Fig.3 Catalyst surface acidity before and after reaction
2.5 N2吸脱附表征
图5(a)、(b)分别为催化剂反应前后的吸脱附曲线。所有催化剂在反应前后均为Ⅳ型等温线,具有H3型回滞环,说明催化剂中的孔结构是由片状材料堆积形成的,这是典型的AlOOH的孔结构[17]。Cat-0在反应前的吸附量明显小于反应后的吸附量,这是由于催化剂在反应后的比表面积和孔容有显著增加导致的。
图5(c)、(d)是催化剂反应前后的孔径分布图,从图中可以看出,在反应后,Cat-1与Cat-2的孔径分布相较反应前变得更加宽泛,而Cat-0的孔径分布则变得较为集中;另外,4nm处较多的孔是无定形AlOOH的中孔结构[18]。催化剂的织构性质如表4所示。在反应后,催化剂的比表面积均增大,这是由于热处理过程中堵塞在孔道中的石蜡在反应时被反应气和产物冲刷出来所致[19]。Cat-0在反应前的比表面积显著小于Cat-1与Cat-2,而从孔容可以看出,Cat-0的孔容在反应后明显增加,而Cat1与Cat-2变化较小,因此可以推测Cat-0在反应前孔道堵塞十分严重。
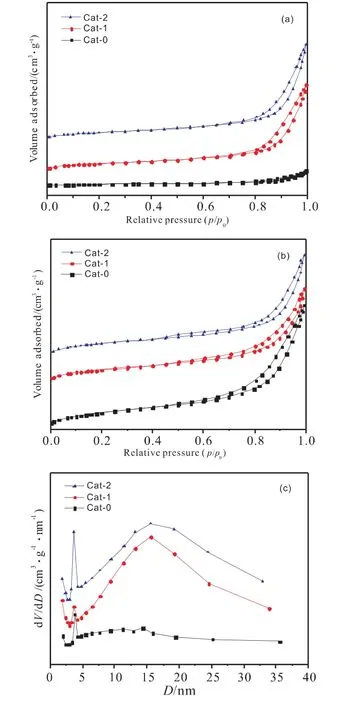
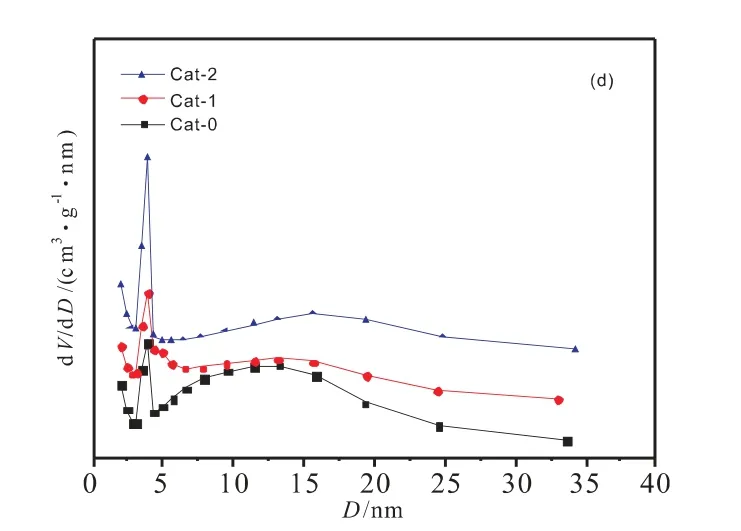
图5 催化剂反应前(a)反应后(b)的吸脱附曲线及反应前(c)反应后(d)的孔径分布图Fig.5 N2-adsorption-desorption isotherms of the catalysts before (a)and after (b)reation,and pore size distribution curves of the catalysts before (c)and after(d)reation
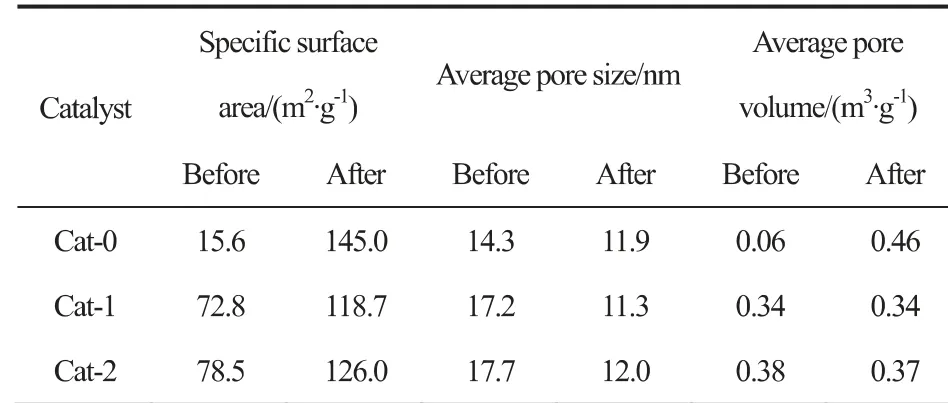
表4 催化剂反应前后织构性质Table 4 Textural parameters of different catalysts before and after reaction
3结论
分步添加Al溶胶的方法制备的催化剂可以增加催化剂的稳定性,明显提高总醇选择性,Cat-1最高可达49%,但不利于催化剂活性以及乙醇占总醇比的增加。结合表征分析发现,随着分步添加Al溶胶的量增加,催化剂中Cu、Al物种的分散程度增加,Cu的晶粒度下降,同时增加了催化剂中易还原的Cu物种量,减少了难还原Cu的量。催化剂中的酸性位点主要为弱酸位,反应后弱酸量减少,强酸量增加;另外,催化剂的弱酸量与乙醇选择性呈现良好的顺变关系。
