2-D-脱氧葡萄糖对二甲双胍抑制人结肠癌细胞作用的影响及机制
2019-02-15谢敏李红霞顾馨仪郝舒捷王仁军刘庆平秦建中张帆
谢敏,李红霞,顾馨仪,郝舒捷,王仁军,刘庆平,秦建中,张帆
(1 大连大学附属中山医院,辽宁大连116001;2 大连大学生命科学与技术学院 辽宁省糖脂代谢研究重点实验室;3内蒙古大学生命科学学院)
结肠癌是常见的消化道恶性肿瘤,发病率高,容易发生肝转移,严重威胁人类健康[1]。目前,手术切除肿瘤组织仍是结肠癌的主要治疗方法,但清除残留的原位或转移的肿瘤细胞,需要机体的抗肿瘤免疫反应和有效的化疗药物。肿瘤细胞代谢活跃,其生长增殖高度依赖糖酵解途径。己糖激酶抑制剂2-D-脱氧葡萄糖(2-DG)可抑制糖酵解代谢,导致肿瘤细胞生长抑制和死亡。然而,近年临床试验结果表明,单独使用2-DG对肿瘤患者的治疗效果并不显著,但与其他抗癌药物联合使用还有很大的研究空间。二甲双胍是用于糖尿病尤其是2型糖尿病治疗的常用口服降糖药物。近年研究表明,二甲双胍具有抑制肿瘤细胞增殖、促进细胞凋亡、增强肿瘤细胞对化疗药物敏感性等功能[2]。新近研究表明,降低葡萄糖水平或减少葡萄糖利用,可以显著增强二甲双胍的抗肿瘤作用[3],但作用机制仍不明确。2017年1月~2018年6月,我们观察了二甲双胍与2-DG联合应用对人结肠癌细胞HT-29的抗肿瘤效果,并通过检测蛋白激酶B(AKT)/雷帕霉素靶蛋白(mTOR)信号通路相关蛋白、自噬相关蛋白p62表达变化探讨其作用机制。
1 材料与方法
1.1 主要材料 2-DG、二甲双胍购自Sigma公司;HT29细胞由伊利诺斯大学芝加哥校区医学院微生物和免疫系提供,DMEM培养基、胎牛血清和青霉素-链霉素均购自Hyclone公司;MTT、0.4%台盼蓝染液、Bradford蛋白质浓度检测试剂由上海生工提供;细胞凋亡检测用Annexin-V染液和碘化丙啶(PI)试剂盒来源于Bio Vision公司;AKT/mTOR信号通路相关蛋白[AKT、磷酸化AKT(p-AKT)、核糖体p70S6激酶(p70S6K)、磷酸化核糖体p70S6激酶(p-p70S6K)]、p62及GAPDH抗体购自Santa Cruz Biotechnology公司,p-AKT抗体购自Cell Signaling Technology公司,HRP山羊抗兔IgG、HRP山羊抗小鼠IgG、HRP驴抗山羊IgG由上海碧云天生物技术有限公司提供,ECL超敏化学发光试剂盒购于北京Transgene公司。
1.2 细胞培养 将HT-29细胞接种于含有10%胎牛血清、100 μg/mL抗生素的DMEM培养液,放置在饱和湿度、5% CO2、37 ℃孵育箱中培养。细胞融合达70%~80%时,进行传代培养。
1.3 细胞活力观察 采用台盼蓝染色法。将HT-29细胞以1×105/孔接种于12孔培养板,37 ℃孵育过夜。单独或者联合加入不同终浓度的2-DG(1、5、10 mmol/L)和二甲双胍(5、10 mmol/L),每个处理设2个复孔,继续培养24 h。用胰酶消化后,离心收集细胞,再用0.5 mL培养液将细胞重悬。取细胞悬液10 μL与0.4%台盼蓝染液10 μL混合均匀后,用细胞计数板分别计数活细胞和死细胞,计算细胞死亡率。本实验重复3次。
1.4 细胞增殖能力观察 采用MTT掺入法。取对数生长期的HT-29细胞,以1×104/孔接种于96孔板,37 ℃孵育过夜。加入含终浓度10 mmol/L 2-DG或与不同终浓度二甲双胍(0、1、5、10、15、20 mmol/L)联合的培养液100 μL,每个处理设置3个复孔,空白对照只加同体积培养液,继续培养48 h;终止培养前4 h,于各个处理孔加入5 mg/mL MTT溶液15 μL。取出96孔板,弃除原培养液;每孔加入DMSO 100 μL,往复式摇床震荡10 min至有色沉淀完全溶解;多功能酶标仪检测各孔570 nm的吸光度(A)值,计算细胞存活率。细胞存活率%=(实验孔A值-空白孔A值)/(对照孔A值-空白孔A值)×100%。本实验重复3次。
1.5 细胞凋亡情况观察 采用流式细胞术。将HT-29细胞接种于6孔板,3×105/孔。次日单独或者联合加入不同浓度2-DG(5、10 mmol/L)和10 mmol/L二甲双胍,继续培养24 h。终止培养时,合并收集各孔漂浮与贴壁细胞于15 mL离心管,离心,并用预冷PBS洗细胞1次。向各管加入0.5 mL含5 μL Annexin V-FITC和5 μL PI的PBS,避光孵育10 min;300目网筛过滤后,用流式细胞仪检测细胞凋亡(早期和晚期凋亡细胞),计算细胞凋亡率。本实验重复3次。
1.6 细胞中AKT/mTOR信号通路相关蛋白及自噬相关蛋白p62检测 采用免疫印迹法。将HT-29细胞接种于直径60 mm培养皿,细胞贴壁后单独或者联合加入不同浓度2-DG(5、10 mmol/L)和10 mmol/L二甲双胍处理。培养24 h后,用细胞刮匙充分刮取细胞;离心沉淀细胞后,用PBS洗细胞1次。加入适量NP-40裂解液,反复吹打细胞至匀质;冰上裂解30 min,每隔5 min涡旋震荡1次;4 ℃离心,保留上清为全细胞蛋白。参照蛋白浓度测定试剂盒操作步骤,Bradford法检测蛋白质浓度。从每个样品取30 μg蛋白质,与4×加样缓冲液混合后,煮沸变性;上样到预先制备的SDS-PAGE胶进行凝胶电泳后,将凝胶中的蛋白质电转移到PVDF膜上;丽春红染色检查蛋白转膜效果,接着用5%脱脂牛奶于室温震荡封闭1 h。将膜置于TBS-T溶液中,并加入适量稀释的相应一抗于4 ℃孵育过夜;吸除一抗,2.5%脱脂牛奶洗膜2次;在室温下与相应种属的HRP标记的二抗孵育1 h,洗膜。取ECL显影氧化剂、发光剂各500 μL与加强剂1 μL混合均匀,滴加至欲显影的PVDF膜上;将膜置于凝胶成像仪中,获取目的蛋白图像。以目的条带与内参GAPDH条带灰度值比值表示目的蛋白的相对表达量。

2 结果
2.1 不同浓度2-DG、二甲双胍单药或联合处理24 h后HT-29细胞死亡率比较 不同浓度2-DG(1、5、10 mmol/L)和二甲双胍(5、10 mmol/L)联合处理24 h后,HT-29细胞死亡率均高于单药处理的细胞(P均<0.05);在2-DG、二甲双胍均为10 mmol/L时,HT-29细胞死亡率最高(P均<0.01)。见图1。

注:与同浓度单独2-DG处理比较,*P<0.05;与同浓度单独二甲双胍处理比较,#P<0.05。
图1不同浓度2-DG、二甲双胍单药或联合处理24h后HT-29细胞死亡率比较
2.2 2-DG与不同浓度二甲双胍联合处理48 h后HT-29细胞存活率比较 以10 mmol/L 2-DG与不同浓度的二甲双胍(0、1、5、10、15、20 mmol/L)联合处理48 h,在二甲双胍浓度≥5 mmol/L后HT-29细胞存活率低于单药处理的细胞(P均<0.05),10 mmol/L时HT-29细胞存活率最低(P均<0.01),20 mmmol/L时HT-29细胞存活率未继续明显降低。见图2。

注:与同浓度单独2-DG处理比较,*P<0.05,**P<0.01;与同浓度单独二甲双胍处理比较,#P<0.05,##P<0.01。
图22-DG与不同浓度二甲双胍联合处理48h后HT-29细胞存活率比较
2.3 不同浓度2-DG与10 mmol/L二甲双胍单药或联合处理24 h后HT-29细胞凋亡率比较 不同浓度2-DG(5、10 mmol/L)和10 mmol/L二甲双胍联合处理24 h,5 mmol/L 2-DG与二甲双胍处理时HT-29细胞凋亡率与单药处理细胞比较差异无统计学意义(P均>0.05),10 mmol/L 2-DG与二甲双胍处理时HT-29细胞凋亡率高于单药处理细胞(P均<0.05)。见图3。

注:与同浓度单独2-DG处理比较,**P<0.01;与同浓度单独二甲双胍处理比较,##P<0.01。
图3不同浓度2-DG与10mmol/L二甲双胍单药或联合处理24h后HT-29细胞凋亡率比较
2.4 不同浓度2-DG与10 mmol/L二甲双胍单药或联合处理24 h后HT-29细胞中AKT/mTOR信号通路蛋白表达比较 不同浓度2-DG(5、10 mmol/L)和10 mmol/L二甲双胍联合处理24 h,5 mmol/L 2-DG与二甲双胍处理时HT-29细胞凋中AKT/mTOR信号通路蛋白相对表达量比较差异无统计学意义(P均>0.05),10 mmol/L 2-DG与二甲双胍处理时HT-29细胞中p-AKT、p-p70S6K相对表达量低于单药处理细胞(P均<0.05)。见图4A、4B。
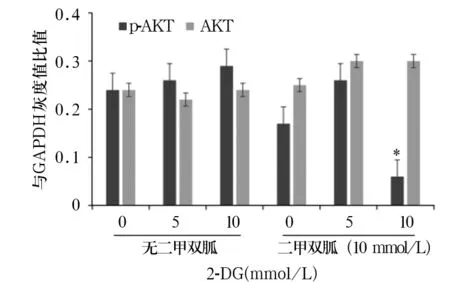
注:与同浓度单独2-DG处理比较,*P<0.05。
图4A不同浓度2-DG与10mmol/L二甲双胍单药或联合处理24h后HT-29细胞中p-AKT和AKT蛋白表达比较

注:与同浓度单独2-DG处理比较,*P<0.05。
图4B不同浓度2-DG与10mmol/L二甲双胍单药或联合处理24h后HT-29细胞中p-70S6K和p70S6K蛋白表达比较
2.5 不同浓度2-DG与10 mmol/L二甲双胍单药或联合处理24 h后HT-29细胞中p62蛋白表达比较 不同浓度2-DG(5、10 mmol/L)和10 mmol/L二甲双胍联合处理24 h,5 mmol/L 2-DG与二甲双胍处理时HT-29细胞中p62蛋白相对表达量比较差异无统计学意义(P均>0.05),10 mmol/L 2-DG与二甲双胍处理时HT-29细胞中p62蛋白相对表达量低于单药处理细胞(P均<0.05)。见图5。

注:与同浓度单独2-DG处理比较,*P<0.05。
图5不同浓度2-DG与10mmol/L二甲双胍单药或联合处理24h后HT-29细胞中p62蛋白表达比较
3 讨论
己糖激酶抑制剂2-DG是葡萄糖2号碳原子上的羟基被氢替换的化合物。它与葡萄糖的结构相似,通过葡萄糖转运蛋白转入细胞后在细胞内积累,竞争性地抑制己糖激酶与葡萄糖的反应[4,5]。由于肿瘤细胞较正常细胞生长迅速,但新生血管的生成相对滞后,提供的营养和氧气不能满足肿瘤细胞生长的需要。因此,肿瘤细胞为了适应低氧环境,主要依赖糖酵解代谢产生能量,即使在恢复供氧的情况下仍以糖酵解为主,这就是肿瘤代谢的Warburg效应[6]。2-DG与葡萄糖竞争性结合己糖激酶,但不能被6-磷酸葡萄糖异构酶识别,转化为6-磷酸果糖,从而抑制糖酵解代谢,导致肿瘤细胞生长抑制和死亡。而正常细胞主要以氧化磷酸化合成ATP,部分抑制糖酵解对正常细胞的功能影响较弱[7,8]。此外,糖酵解途径也为肿瘤细胞增殖提供合成大分子的必要中间产物,抑制糖酵解将干扰肿瘤细胞的核酸、蛋白质以及脂质合成,从而抑制肿瘤细胞生长。因此,肿瘤细胞的这种能量代谢特征为糖酵解抑制剂的靶向治疗提供了可能。大量流行病学研究表示,使用二甲双胍的糖尿病患者,其恶性肿瘤的发病率和病死率较低,表明二甲双胍可减少糖尿病患者罹患恶性肿瘤的风险。二甲双胍作为治疗糖尿病的一线药物,其安全性已得到广泛验证。有学者指出,将二甲双胍与化疗药物如多柔比星、卡铂联合用于乳腺癌动物模型,它们具有协同抗肿瘤作用[9]。本研究结果表明,单独使用2-DG或二甲双胍对HT-29结肠癌肿瘤细胞仅有较弱的抗肿瘤作用,当两者终浓度均为10 mmol/L时,联合应用能使抑制肿瘤细胞增殖和诱导细胞凋亡的作用达到最适状态。
由于2-DG通过与葡萄糖竞争结合己糖激酶,干扰细胞糖代谢过程,其有效浓度会伴随环境中葡萄糖含量有所差异。在本实验条件下,普通高糖DMEM培养液中葡萄糖浓度约25 mmol/L,这可能是本文只观察到较高浓度2-DG增强二甲双胍抗肿瘤作用的原因之一。近年研究表明,二甲双胍抗肿瘤作用主要是通过影响细胞能量代谢来抑制细胞增殖,细胞毒作用并不明显[10];但在缺乏或低葡萄糖条件下,其抗肿瘤作用明显增强[11]。本研究观察到显效的二甲双胍浓度高于生理条件所及,这可能与细胞生长于高糖环境有关,并不代表体内作用的有效浓度。本研究结果表明,在结肠癌细胞中,抑制细胞糖代谢能增强二甲双胍的抗肿瘤作用。二者抑制肿瘤细胞的机制和作用途径不同,尽管单独使用抗瘤作用较弱,但联合使用却可显著产生抑瘤效应,因此有望成为理想的联合用药候选组合。
AKT/mTOR信号通路是已知的癌症发生相关的主要信号通路之一,其生物学效应主要表现为阻止细胞凋亡、促进细胞存活以及影响细胞糖代谢等方面[12]。活化的AKT通过激活下游激酶mTOR,导致p70S6K和4EBP1磷酸化,后两者的协同作用促进细胞的蛋白质合成代谢。大多数肿瘤细胞都存在PI3K-AKT-mTOR信号通路异常度活化[13],该通路在防止细胞凋亡、促进细胞存活以及增强细胞代谢等方面具有重要作用[14]。最近有研究表明,PI3K-AKT-mTOR信号通路在肿瘤干细胞的更新和放疗、化疗抵抗中扮演重要的角色,而后两者被认为是癌症治疗失败的主要原因[15]。本研究发现,低浓度(5 mmol/L)2-DG单独处理HT-29细胞对p-AKT蛋白表达无明显影响,而高浓度(10 mmol/L)2-DG则可促进AKT磷酸化。二甲双胍单独处理可以抑制AKT磷酸化,这种抑制作用在2-DG为10 mmol/L的条件下更为显著。p70S6K是mTOR信号复合体的下游靶蛋白,虽然2-DG对其没有明显影响,但能显著增强二甲双胍对p-p70S6K蛋白表达的抑制作用。值得注意的是,2-DG和二甲双胍联合作用下,p70S6K总蛋白也有下调趋势。因此,2-DG联合二甲双胍显著抑制AKT和p70S6K的磷酸化,提示抑制AKT/mTOR信号系统是两者联合增强抗肿瘤效果的机制之一。
本研究还观察到,二甲双胍能够上调p62蛋白表达,而2-DG可以阻断这一作用。p62是一种多功能蛋白,尤其在细胞发生自噬反应中发挥重要作用[16]。二甲双胍上调p62蛋白表达,提示它可能诱导细胞自噬。目前认为,肿瘤细胞自噬反应是导致治疗抵抗的原因之一[17],因此2-DG阻断p62蛋白上调可能是二者协同另一机制。此外,新近研究发现,p62蛋白是转录因子Nrf2的激活剂,后者是导致细胞产生保护作用的重要转录因子[18]。这提示2-DG与二甲双胍的联合抗肿瘤作用与抑制Nrf2活化也有关联,值得进一步研究。
综上所述,本研究发现2-DG和二甲双胍联合应用能增强对结肠癌细胞的抗瘤效应,其作用机制之一是二者联合抑制AKT/mTOR信号系统,也可能与抑制细胞自噬与Nrf2活化有关。因此,这两种药物组合在体内对结肠癌的作用值得进一步研究。
