Fas/FasL、p38 MAPK通路在溃疡性结肠炎大鼠中的表达及雷公藤多苷的作用
2019-02-15钦丹萍杨新艳张春丽
杨 强,钦丹萍,杨新艳,岑 刚,代 群,张春丽,汪 瑶
(1. 浙江中医药大学第一临床医学院,浙江 杭州 310053;浙江中医药大学附属第一医院 2.消化内科、3.胃肠研究实验室、4.病理科,浙江 杭州 310006)
雷公藤多苷(Tripterygiumwilfordiipolycoride,TWP)具有免疫调控及抗炎作用,在临床上被应用于治疗类风湿关节炎、系统性红斑狼疮等自身免疫性疾病[1]。在临床中,我们观察到TWP对溃疡性结肠炎(ulcerative colitis,UC)具有良好的疗效,与硫唑嘌呤(azathioprine,AZA)等免疫抑制剂相比,其副反应低[2],且细胞实验表明,TWP具有良好的抗炎作用[3]。由此,我们开展了相关动物实验研究,其中表达谱分析显示,Fas/FasL系统中的FasL在UC大鼠结肠炎症活动时表达上调,在TWP干预时表现为下调的趋势。为此,本实验以real-time PCR法对FasL的这种改变加以明确与验证,并在此基础上,进行信号通路分析,并筛选出相关分子,用real-time PCR法验证,并对该信号通路的相关分子及末端炎症因子进行检测,以此探讨Fas/FasL及其相关信号通路p38 MAPK在2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzene-sulfonic acid,TNBS)/乙醇UC大鼠模型中的表达变化及TWP对其的影响。
1 材料
1.1实验动物8周龄SPF级♂Wistar健康大鼠90只,体质量(200±20)g,购自上海斯莱克实验动物有限责任公司,许可证号:SCXK(沪)2012-0002。浙江中医药大学动物实验中心常规饲养。
1.2药物与试剂雷公藤多苷片(生产批号:1311108B,浙江得恩德制药有限公司);硫唑嘌呤(生产批号:008953,Aspen公司)。TNBS(Sigma公司);FasL、MAPK14(p38α)、MAPK13(p38δ)引物,由上海伯豪生物技术有限公司合成;肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)、白细胞介素1β(interleukin 1 beta,IL-1β)PCR引物,由TaKaRa公司合成;RNA抽提试剂盒、反转录试剂盒(TaKaRa公司);IL-1β抗体(Abcam公司);TNF-α抗体(R&D公司)。
1.3仪器PCR扩增仪(Applied Biosystems公司);电泳仪及电泳槽(Bio-Rad公司);GeneChip®Scanner 3000(Affymetrix公司);Odyssey曝光机(LI-COR公司)。
2 方法
2.1造模及给药90只♂Wistar大鼠随机分为正常组、模型组、TWP低、中、高剂量组、AZA组,每组15只。适应性饲养1周后,除正常组外,其余各组大鼠均按每只大鼠100 mg·kg-1TNBS+0.25 mL 50%乙醇进行灌肠,制备UC大鼠模型。正常组、模型组给予10 mL·kg-1生理盐水灌胃;TWP低、中、高剂量组:分别按3、6、12 mg·kg-1的剂量配制成0.3、0.6、1.2 g·L-1TWP的混悬液,按10 mL·kg-1灌胃;AZA组:按6 mg·kg-1的剂量配制成0.6 g·L-1AZA的混悬液,按10 mL·kg-1灌胃;给药时间2周,末次给药24 h后处死大鼠。
2.2标本采集与处理留取大鼠距肛门4~12 cm处,长约8 cm的新鲜结肠标本,参照相关标准分别行结肠组织大体形态损伤评分[4]及光学显微镜下结肠组织病理损伤评分[5]。并将所取的结肠标本放入冻存管,置-80 ℃冰箱中保存。
2.3Fas/FasL表达谱分析用Affymetrix表达谱配套的试剂盒GeneChip 3′ IVT PLUS Reagent Kit,按照规范化流程对样品总RNA中的mRNA行放大、标记与纯化,获得带有生物素标记的cRNA。按照Affymetrix表达谱芯片配套提供的流程和试剂盒来完成杂交洗涤的工作。采用GeneChip®Scanner 3000扫描芯片结果,用Command Console Software 4.0软件读取原始数据,合格的数据再进一步采用Gene Spring Software 11.0行归一化处理,MAS5.0为所用算法。选取标本为正常组、模型组、TWP高剂量组和AZA组。
2.4Real-timePCR验证靶基因FasL表达水平按RNA抽提试剂盒说明书提取总RNA,进行逆转录反应合成cDNA,并对cDNA进行PCR扩增,以β-actin为内参。FasL引物序列:5′-CATAAAGTTTTGGGCTGCTGTGT-3′(上游),5′-TGCTCTTGGCCATTTAACATCA-3′(下游)。靶基因的相对表达量以2-ΔΔCt的形式表达。
2.5通过DAVID数据库进行靶基因Fas/FasL的信号通路分析通过DAVID数据库进行Fas/FasL的信号通路分析,揭示靶基因Fas/FasL参与UC炎症活动时可能涉及的信号通路,并在表达谱芯片(过程同“2.3”,选用标本亦同Fas/FasL)中筛选信号通路中相关分子(MAPK14、MAPK13),并用real-time PCR法加以验证(过程同“2.4”)。引物序列:MAPK14(p38α):5′-GGCCTCACCGCCTCAGTAT-3′(上游),5′-CCCAGACGTTGCTACTAACCATT-3′(下游);MAPK13(p38δ):5′-GCTGAGGGCCTTATAGGGAATG-3′(上游),5′-CAAAAAGGTAAAAGGCAGTCATCTC-3′(下游)。以β-actin为内参,MAPK14(p38α)、MAPK13(p38δ)的相对表达量以2-ΔΔCt来表示。
2.6RT-PCR法测定p38MAPK信号通路末端炎症因子TNF-α、IL-1βmRNA表达所取标本按RNA抽提试剂盒说明书提取总RNA,进行反转录反应合成cDNA,并对cDNA进行PCR扩增,以β-actin为内参。采用2-ΔΔCt法分析目的基因的相对表达水平。引物序列:TNF-α:5′-TCAGTTCCATGGCCCAGAC-3′(上游),5′-GTTGTCTTTGAGATCCATGCCATT-3′(下游);IL-β:5′-CCCTGAACTCAACTGTGAAATAGCA-3′(上游),5′-CCCAAGTCAAGGGCTTGGAA-3′(下游);β-actin:5′-GGAGATTACTGCCCTGGCTCCTA-3′(上游),5′-GACTCATCGTACTCCTGCTTGCTG-3′(下游)。
2.7Westernblot法测定p38MAPK信号通路末端炎症因子TNF-α、IL-1β蛋白表达将所取肠组织标本研磨粉碎后,加入6倍剂量的冷蛋白裂解液[20 mmol·L-1Tris/HCl(pH 7.5)、10 mmol·L-1胰蛋白酶样丝氨酸蛋白酶(APMSF)、1 mmol·L-1EDTA抗原修复液、1 mmol·L-1二硫苏糖醇(DTT)];取一定量蛋白上样,于10%聚丙烯酰胺凝胶电泳分离后,转移至PVDF膜。5%脱脂奶封闭2 h,加入TNF-α(1 ∶5 000)、IL-1β(1 ∶2 500)单克隆抗体,4 ℃孵育过夜。TBST洗膜5 min×3次。分别加入相应荧光二抗,室温缓慢震摇2 h,TBST洗膜5 min×3次。采用Odyssey曝光机进行图像显影,Odyssey软件进行图像数据分析,目的蛋白的表达以目的蛋白的灰度值与β-actin灰度值的比值表示。
3 结果
3.1UC模型大鼠结肠炎症评分如Fig 1所示,治疗14 d后,模型组大鼠大体形态损伤以及组织病理损伤评分与正常组相比明显升高(P<0.01);TWP高剂量组、AZA组结肠炎症评分较模型组均有明显改善(P<0.01)。

Fig 1 The inflammatory scores of colon in each
##P<0.01vsnormal;*P<0.05,**P<0.01vsmodel
3.2Fas/FasL表达谱分析结果及FasL相对表达量
3.2.1Fas/FasL表达谱分析结果 实验以倍数变化>2,P<0.05,表达值 > 7为筛选标准,筛选出的FasL呈现差异表达,而Fas未见明显的差异性表达。Tab 1结果显示,FasL的表达在模型组明显高于正常组(P<0.05),在TWP高剂量组、AZA组均低于模型组,其中AZA组与模型组相比具有统计学差异(P<0.01);Fas的表达在模型组高于正常组(P>0.05),在TWP高剂量组、AZA组高于模型组(P>0.05),但其各组间的比较差异均无统计学意义(P>0.05)。

Tab 1 The gene expression profile analysis of Fas/FasL in colon of each
#P<0.05vsnormal;**P<0.01vsmodel
3.2.2FasL mRNA相对表达量 如Fig 2所示,FasL mRNA的相对表达量在模型组明显高于正常组(P<0.01);在TWP中、高剂量组、AZA组均明显低于模型组(P<0.01)。
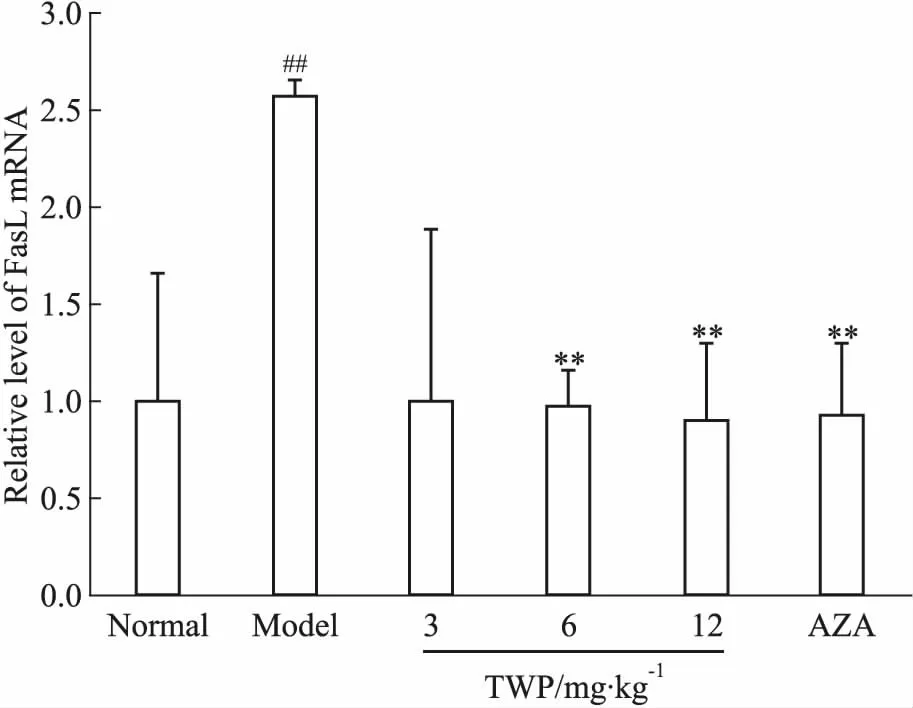
Fig 2 Relative mRNA expression of FasL detected by real-time PCR in colon of each
##P<0.01vsnormal;**P<0.01vsmodel
3.2.3Fas/FasL信号通路分析 针对Fas/FasL,在DAVID数据库中行信号通路分析,结果提示Fas/FasL调节UC炎症活动可能涉及到p38 MAPK信号通路。
3.3p38MAPK信号通路中相关分子表达谱分析及相对表达量
3.3.1p38 MAPK信号通路分子的表达谱分析结果 如Tab 2所示,MAPK14(p38α)的表达在模型组明显高于正常组(P<0.05),在TWP高剂量组、AZA组均明显低于模型组(P<0.05,P<0.01);而MAPK13(p38δ)的表达在模型组明显低于正常组(P<0.01),在TWP高剂量组、AZA组均明显高于模型组(P<0.05)。

Tab 2 The gene expression profile analysis of MAPK14 and MAPK13 in colon of each
#P<0.05,##P<0.01vsnormal;*P<0.05,**P<0.01vsmodel
3.3.2p38 MAPK信号通路分子mRNA的相对表达量 如Fig 3所示,MAPK14(p38α)mRNA的相对表达量在模型组明显高于正常组(P<0.01),在TWP低、高剂量组、AZA组均明显低于模型组(P<0.05,P<0.01);而MAPK13(p38δ)mRNA的相对表达量在模型组明显低于正常组(P<0.01),在TWP低、中、高剂量组、AZA组均明显高于模型组(P<0.01)。

Fig 3 Relative mRNA expression of MAPK14 and MAPK13 detected by real-time PCR in colon of each
##P<0.01vsnormal;*P<0.05,**P<0.01vsmodel
3.4p38MAPK信号通路中末端炎症因子TNF-α、IL-1βmRNA及蛋白的表达RT-PCR及Western blot检测结果显示(Fig 4、5),TNF-α、IL-1β mRNA及蛋白的表达在模型组均明显高于正常组(P<0.01),在TWP高剂量组、AZA组均明显低于模型组(P<0.01),TWP高剂量组与AZA组之间差异无统计学意义(P>0.05)。

Fig 4 Relative mRNA expression of TNF-α and IL-1β detected by RT-PCR in colon of each
##P<0.01vsnormal;*P<0.05,**P<0.01vsmodel

Fig 5 Expression of TNF-α and IL-1β protein detected by Western blot in colon of each
##P<0.01vsnormal;**P<0.01vsmodel
4 讨论
本实验采用TNBS/乙醇法建立UC大鼠模型,造模后模型组大鼠结肠大体形态损伤评分、结肠组织病理学评分均高于正常组。另外,在结肠炎症评分方面,TWP高剂量组及AZA组与模型组比较均有明显优势,但两组间差异无统计学意义。提示TWP能够改善UC大鼠的结肠炎症活动,其作用与AZA相当。
Fas是肿瘤坏死因子(tumor necrosis factor,TNF)受体族的膜蛋白分子,是一种Ⅰ型跨膜蛋白;FasL是Fas的天然配体,是II型跨膜糖蛋白分子;Fas与FasL结合能够活化Fas相关死亡结构域(Fas-associated death domain,FADD)及下游的caspases家族,从而诱导细胞凋亡[6]。有研究显示[7],在UC患者肠组织中,FasL阳性的细胞数量明显增加,与表达Fas的结肠上皮细胞结合即可引起其大量凋亡,破坏肠黏膜屏障,导致肠黏膜损伤和溃疡,从而参与UC的发病。
结合相关文献[8],在结肠组织中,FasL主要表达于激活的淋巴细胞、浆细胞等炎性细胞,其在活动性UC中呈高表达;而Fas则主要表达于结肠上皮细胞,其在正常与UC结肠中均呈保守表达。本实验中,表达谱分析提示FasL在模型组中的表达高于正常组,在TWP高剂量组及AZA组中,其表达较模型组均呈下调趋势,其中AZA组有统计学差异;而Fas的表达在各组间差异无统计学意义,该结果与上述文献报道相一致。针对FasL行real-time PCR检测,验证了其在表达谱分析中的变化趋势:FasL的相对表达量在模型组高于正常组,在TWP中、高剂量组及AZA组中均低于模型组(P<0.01),TWP高剂量组略好于AZA组,但差异无统计学意义,提示在UC结肠组织中FasL的表达呈升高趋势,而TWP可以下调其表达。
除了参与细胞凋亡外,Fas/FasL在促炎症反应中同样扮演了重要角色。目前,相关研究表明,Fas/FasL能够通过MyD88依赖途径、募集中性粒细胞等非凋亡相关途径介导炎症反应,但其机制研究尚不深入[9-10]。在此基础上,我们针对Fas/FasL行信号通路分析获知,Fas/FasL参与UC疾病活动时,其途径可能涉及p38 MAPK信号通路。有研究表明[11-12],Fas/FasL介导的细胞凋亡与p38 MAPK信号通路的激活有关。此外,p38 MAPK信号通路能通过复杂的级联反应对炎症因子进行调控,在UC的疾病进程中发挥着重要作用[13]。p38 MAPK共有4个亚型,其中MAPK14(p38α)、MAPK13(p38δ)在肠组织中都有表达,特别是MAPK14(p38α)与UC的相关性最为密切[13],其被MAPK激酶MKK3和MKK6通过双磷酸化途径激活后,可通过复杂的信号途径调控TNF-α、IL-1β等促炎性细胞因子的释放[14-15],而这些促炎因子是UC发病机制中的关键因子。Waetzig等[13]以MAPK14(p38α)抑制剂SB203580孵育UC患者肠黏膜活检组织培养液,其TNF-α的含量明显下降,且与SB203580浓度呈正相关。上述研究反映了p38 MAPK家族中的MAPK14(p38α)亚型在p38 MAPK信号通路中的重要作用。
本实验中,表达谱分析显示,MAPK14(p38α)在模型组中的表达高于正常组,在TWP高剂量组、AZA组中低于模型组,real-time PCR验证了这种表达趋势。提示TWP和AZA对MAPK14(p38α)的表达均有抑制作用,TWP抑制作用略好于AZA,但差异无统计学意义。与此相对应的是,p38 MAPK信号通路中末端炎症因子TNF-α、IL-1β mRNA及蛋白的表达在模型组均明显高于正常组;在TWP高剂量组及AZA组均明显低于模型组,提示TWP能够抑制该信号通路末端炎症因子的表达。
因此,我们推测TWP能够通过Fas/FasL系统及其所介导的p38 MAPK信号通路,对UC的炎症活动进行调控,从而发挥抗炎作用;其中与MAPK14(p38α)这个亚型的相关性较大。此外,本研究提示MAPK13(p38δ)在UC炎症活动时呈低表达,该结果与文献报道一致[13];而在TWP、AZA治疗后其表达均高于模型对照组,但目前MAPK13(p38δ)对炎症的作用还难以确定,这其中的机制有待我们进一步研究。
(致谢: 本文实验在浙江中医药大学动物实验中心及浙江中医药大学附属第一医院胃肠研究实验室完成,感谢对实验给予帮助的老师和同学。)
