江苏省扬州市水仙病毒检测鉴定与序列分析
2019-02-10张坤陈雯甘海峰罗云建陈夕军贺振
张坤 陈雯 甘海峰 罗云建 陈夕军 贺振


摘要 :水仙屬于石蒜科水仙属,是重要的观赏花卉之一。2016年-2017年,在江苏省扬州市采集的水仙上发现典型的花叶、条斑等病毒病症状。利用已报道的水仙病毒通用引物对疑似病样进行RT PCR检测,结果表明,扬州采集到的3份病样上均能扩增到与预期大小相同的DNA片段。经克隆测序和序列分析发现,所得序列包含3种不同的类型,分别与水仙普通潜隐病毒 Narcissus common latent virus (NCLV)、水仙退化病毒 Narcissus degeneration virus (NDV)和水仙黄条病毒Narcissus yellow stripe virus (NYSV)有93%、98%和99%的相似性,表明江苏水仙受到了NCLV、NDV、NYSV 3种病毒侵染。这是江苏水仙上第一次发现NCLV、NDV、NYSV。在系统树中,NCLV可分为两个组,本研究所得NCLV YZ与上海分离物位于同一组中;NDV也可分为两个组,本研究所得NDV与其他中国分离物均位于第二组;而NYSV具有很高的多样性,可分为4个组,本研究所得NYSV与其他部分中国分离物和日本分离物位于第一组。NCLV和NDV分组具有清晰的地理差异性,而NYSV受到地理隔离的影响不明显。
关键词 :水仙病毒; 检测; 序列分析
中图分类号:
S 436.81
文献标识码: A
DOI: 10.16688/j.zwbh.2018448
Detection, identification and sequence analysis of narcissus viruses in
Yangzhou city,Jiangsu province
ZHANG Kun, CHEN Wen, GAN Haifeng, LUO Yunjian, CHEN Xijun, HE Zhen
(School of Horticulture and Plant Protection, Yangzhou University, Yangzhou 225009, China)
Abstract
Narcissus is an important ornamental flower, which belongs to the family Amaryllidaceae. In 2016-2017, typical viral infection symptoms, such as mosaic, and streak, appeared on Narcissus in Yangzhou, Jiangsu province. The previously reported narcissus virus universal pair of primers were used to perform the RT PCR, and the results showed that the expected DNA fragments could be amplified from three samples collected from Yangzhou. Cloning, sequencing and analysis showed that the amplified sequence contained three different types, with 93%, 98% and 99% identities with the Narcissus common latent virus (NCLV), Narcissus degeneration virus (NDV) and Narcissus yellow stripe virus (NYSV), respectively. These results suggested that narcissus was infected by three viruses, NCLV, NDV and NYSV. This is the first report that the narcissus was infected by NCLV, NDV and NYSV in Jiangsu province. In the phylogenetic tree, all NCLV isolates were divided into two groups, while NCLV YZ clustered with Shanghai isolates as one group; all NDV isolates were divided into two groups, and NDV YZ clustered into group Ⅱ together with other Chinese isolates; all NYSV isolates were divided into four groups with highest diversity, and NYSV YZ clustered into group Ⅰ together with some Chinese and Japanese isolates. The phylogenetic tree constructed with both NCLV and NDV rather than NYSV reflected obvious geographical specificity.
Key words
narcissus viruses; detection; sequence analysis
水仙Narcissus tazetta为多年生草本植物,属于石蒜科Amaryllidaceae水仙属Narcissus,是重要的观赏花卉之一。中国水仙N. tazetta var. chinensis是水仙属中观赏价值极高的一类,也是化工和制药业中的重要资源植物[1]。由于水仙长期无性繁殖,致使病毒在体内不断积累,严重影响水仙产品的外观和品质,成为水仙生产的重要制约因素之一[2]。目前,在水仙上发现的病毒有20余种,主要以马铃薯病毒科Potyviridae、线性病毒科Flexiviridae和豇豆花叶病毒科Secoviridae病毒为主[3]。
水仙普通潜隐病毒Narcissus common latent virus (NCLV) 属于乙型线状病毒科Betaflexiviridae香石竹潜隐病毒属Carlavirus,病毒粒体线状,其基因组是一条正义单链RNA,全长8 539个核苷酸 (nucleotide,nt),含有6个开放阅读框[4]。基因组序列比对和系统进化树分析表明与其亲缘关系最近的是马铃薯M病毒Potato virus M (PVM)、啤酒花潜隐病毒Hop latent virus (HpLV)和乌头潜隐病毒Aconitum latent virus (AcLV)[5]。NCLV侵染水仙后,常常无明显症状。
水仙退化病毒Narcissus degeneration virus (NDV) 属于马铃薯病毒科Potyviridae马铃薯Y病毒属Potyvirus,在中国主要分布于上海崇明[6]和福建漳州[7];在新西蘭[8]和澳大利亚[9]也有报道。NDV侵染水仙后在叶片上表现褪绿条纹、斑驳、畸形等症状。
水仙黄条病毒Narcissus yellow stripe virus (NYSV) 也属于马铃薯Y病毒属Potyvirus。NYSV感染植株的典型症状是叶脉呈黄色条斑,病情严重时植株瘦小、矮化,和其他病毒复合侵染时症状更为严重。有报道其与水仙迟黄病毒Narcissus late season yellows virus (NLSYV)复合侵染能够引起叶片变黄,花朵的质量下降[10]。
为明确江苏省水仙病毒的发生情况,2016年-2017年,我们收集了水仙上表现花叶、黄色条斑等典型的病毒病害症状样品,提取总RNA,采用RT PCR序列测定和比对分析,结果鉴定到3种病毒,分别为NDV、NCLV和NYSV,并对这3种病毒进行了序列和系统发育分析。
1 材料与方法
1.1 材料
供试植物:2016年-2017年度,在江苏省扬州市开心农场、花卉市场、高邮市花卉市场采集到表现黄化、花叶和斑驳等疑似病毒病症状(图1)的样品共9株。
培养基:LB培养基 (Luria Bertani):胰蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,使用前加入终浓度为50 μg/mL氨苄青霉素。
试剂:TaKaRa MiniBEST Plant RNA Extraction Kit、5×M MLV Buffer、dNTPs、RNA酶抑制剂、反转录酶M MLV、Marker、pMD19 T载体,宝生物工程 (大连) 有限公司;AxyPrep DNA凝胶回收试剂盒,康宁生命科学 (吴江) 有限公司;烟草脆裂病毒ELISA试剂盒,上海桥杜生物科技有限公司;2×Taq Master Mix,南京诺唯赞生物科技有限公司。
仪器:Eppendorf AG 22331 PCR仪,德国Eppendorf公司;培清JS 680B凝胶成像系统,上海培清公司;XW 80A型漩涡振荡器,上海青浦沪西仪器厂;DYCP 28A、DYCP 31A型电泳槽,北京市六一仪器厂;Thermo Scientific MicroCL 17微量离心机,Thermo Fisher Scientific公司。
1.2 方法
1.2.1 叶片总RNA提取
取0.1 g水仙叶片,参照TaKaRa MiniBEST Plant RNA Extraction Kit试剂盒说明书,提取总RNA。最终将RNA溶解于40 μL无核酸酶水中。
1.2.2 cDNA合成及PCR扩增、克隆和序列测定
利用反转录酶M MLV (Promega),通过水仙病毒反向通用引物Tu3T9M (5′ AAAAAAAAAA AAAAAGAGCTCGGA 3′) [1113]将总RNA反转录成第1链cDNA。在PCR管中依次加入下列试剂:20 μmol/L下游引物Tu3T9M 1 μL、700 ng/μL总RNA 1 μL、无核酸酶水4 μL。混匀离心后,于70℃孵育10 min,然后迅速置于冰上冷却2 min。离心5 s后再加入下列试剂:5×M MLV Buffer 2 μL、dNTPs (10 mmol/L) 0.5 μL、40 U/μL RNA酶抑制剂(RNase inhibitor) 0.25 μL、200 U/μL反转录酶M MLV 0.25 μL、无核酸酶水1 μL。混匀后离心5 s,于42℃孵育1 h,70℃孵育15 min,冰上冷却2 min。得到的cDNA溶液保存于-20℃待用。
以获得的cDNA为模板。50 μL PCR反应体系:cDNA 2 μL、水仙病毒通用引物Tu3T9M和POTYNIbNOT4P(5′ GGGGCGGCCGCATATGG GGTGAGAGAGGTNTGYGTNGAYGAYTTYAAY AA 3′) 各2 μL、5 U/μL 2×Taq Master Mix 25 μL、超纯水19 μL。PCR反应条件:94℃变性1 min,按下列条件进行30个循环:94℃变性30 s,60℃退火30 s,72℃延伸1 min 30 s,最后72℃延伸10 min。全部PCR产物经1%琼脂糖凝胶电泳分离后,切取大小为1 000~1 500 bp左右的目的条带,用凝胶回收试剂盒回收纯化后,克隆到pMD19 T载体,转化大肠杆菌Escherichia coli DH5α。经菌液PCR验证阳性克隆后,随机选取20个克隆由生工生物工程 (上海) 股份有限公司进行测序,所得序列利用BLASTn和BioEdit软件进行序列比对和分析。
1.2.3 多样性比对和系统发育分析
分别以马铃薯M病毒 (KY364848)、芜菁花叶病毒Turnip mosaic virus (AB701690)和芜菁花叶病毒TuMV (KT934662) 作为NCLV、NDV和NYSV比对分析的外组。将GenBank中已登录的4个NCLV分离物,18个NDV分离物,38个NYSV分离物与本研究中获得的序列,通过DNAMAN、Clustal X2和transAlign (由Georg Weiller教授惠赠) 进行核苷酸序列和氨基酸序列的比对,以确定比对后的核苷酸序列能正确编译出氨基酸。
用软件MEGA 7.0对上述3组序列通过邻接法 (neighbor joining,NJ) 进行系统发育分析,用自举法 (bootstrap) 进行1 000次模拟复制计算检验。
2 结果与分析
2.1 水仙样品RT PCR检测
利用水仙病毒通用引物Tu3T9M和POTYNIbNOT4P进行RT PCR扩增,在YZ7、YZ8、YZ15三个样品中有与预期大小相同的特异片段,长度在1 000~1 500 bp之间,健康的水仙样品中未扩增出任何片段。
2.2 序列鉴定
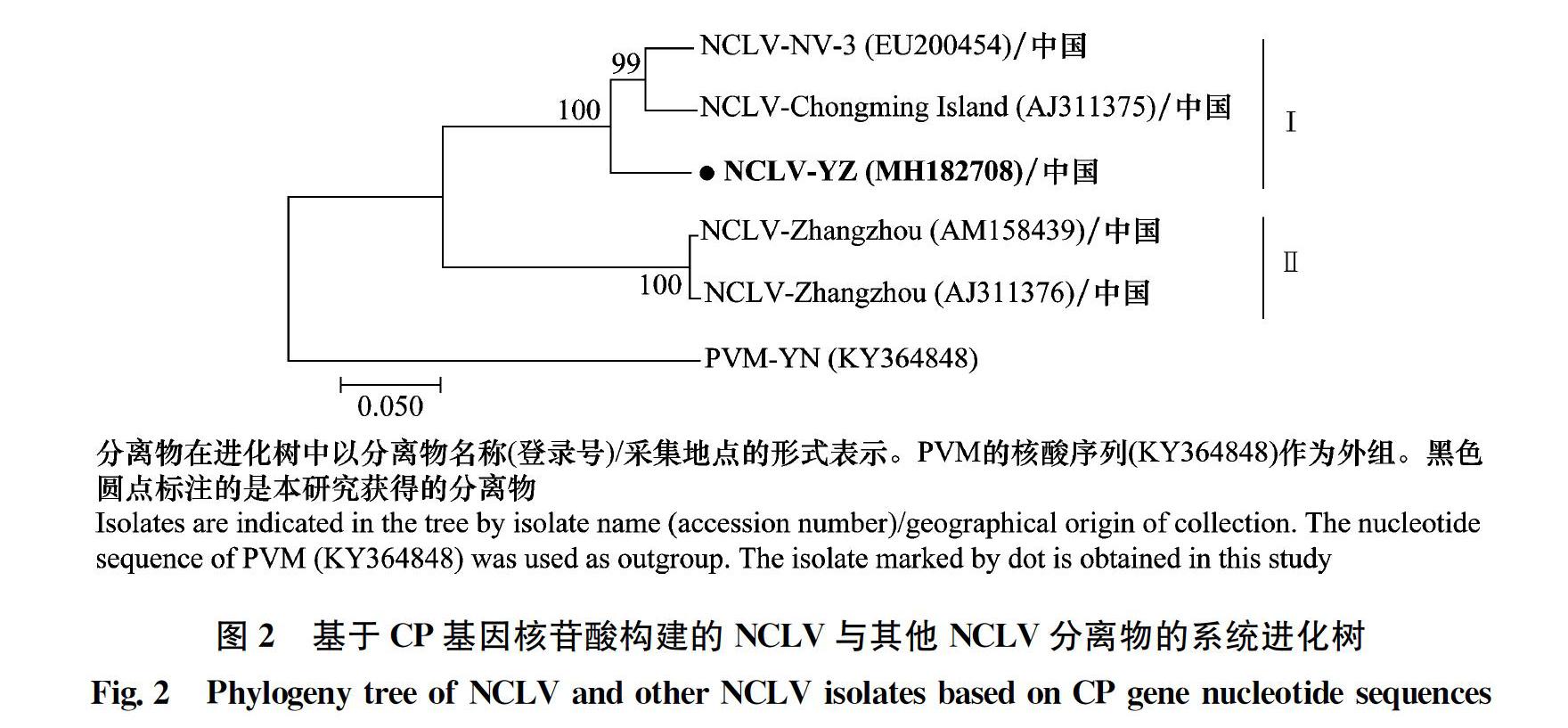
将检测出来的YZ7、YZ8、YZ15進行克隆测序,发现了3个不同的序列。BLASTn比对结果显示这3个序列分别与上海崇明水仙上分离的NCLV (EU200454)和NDV (AJ311374)具有93%和98%的相似性,与福建漳州水仙上分离的NYSV (AM158908) 有99%的相似性。表明江苏水仙受到了NCLV、NDV、NYSV 3种病毒侵染。其中,NCLV测定获得长1 445 nt 基因组C端序列,包括部分的三联体运动蛋白2 (triple gene block 2, TGB2) 序列 (132 nt),完整的外壳蛋白 (coat protein, CP) 序列 (906 nt)和核酸结合蛋白 (nucleic acid binding protein, NABP) 序列 (327 nt),完整的3′端非编码区 (3′ untranslated region, 3′ UTR) 序列 (75 nt);获得NDV的片段长度为 (1 177 nt),包括243 nt的核内含体b蛋白 (nuclear inclusion b protein, NIb) 片段,全部的CP序列 (786 nt)和3′ UTR序列 (148 nt);NYSV的片段长1 276 nt,包括240 nt的NIb片段,完整的CP序列 (825 nt)和3′ UTR序列 (211 nt)。将这3个分离物序列提交到GenBank数据库中,所得NCLV、NDV和NYSV扬州分离物 (YZ) 序列的登录号分别为MH182708、MH1824726和MH582714。
2.3 多样性分析和系统发育分析结果
将得到的分离物序列与GenBank登录的NCLV、NDV和NYSV的CP和3′ UTR核苷酸序列通过DNAMAN和Clustal X2进行相似性比对。结果显示,NCLV YZ CP序列和福建分离物 (AM158439和AJ311376) 的同源性为77.4%;与上海分离物 (EU200454和AJ311375) 的序列同源性约92.1%。而在3′ UTR序列上,NCLV YZ与福建分离物 (AM158439、AJ311376)、上海分离物 (EU200454、AJ311375) 的序列同源性在94.7%~97.3% (表1)。序列分析表明,NCLV YZ与上海分离物遗传关系较近,而与福建分离物存在较大的遗传差异。系统发育分析结果与之类似,依据CP基因序列,NCLV分为两个组,NCLV YZ与上海分离物位于同一组中,福建分离物位于另外一个组中 (图2)。这表明在国内,NCLV具有较为明显的地理差异性。
NDV YZ的CP序列与已经报道的福建、上海、澳大利亚和日本分离物的同源性都在96%以上。并且3′ UTR序列与已经报道的序列同源性都在97%以上 (表2)。序列分析表明,NDV YZ与已报道的分离物遗传关系都较近。系统发育分析表明,日本、澳大利亚的分离物聚成一组,中国分离物聚为第二组 (图3)。该结果表明,尽管NDV不同来源分离物间具有较低的遗传分化,但仍受到较为清晰的地理隔离的影响。
NYSV YZ的CP序列与GenBank上已报道的分离物一致率为77.3%~99.5%(表3),其中与福建分离物(AM158908、NC011541、AJ311372)序列同源性最高(99.5%);与澳大利亚分离物(JQ395042)和日本分离物(LC314394)的序列同源性最低(77.3%)。NYSV YZ的3′ UTR序列与已报道报道的分离物一致率为70.0%~100%(表3)。根据CP系统发育分析结果,可将来自中国、日本、印度的NYSV分为4个组(图4),NYSV YZ与部分中国和日本分离物聚为一组(第一组),各组间没有明显的地理特异性。
3 讨论
目前,病毒病是水仙上经常暴发的一类病害,并且经常多种病毒复合侵染[1]。水仙大多以无性繁殖为主,种球一旦带毒,病毒将在种球内不断积累,导致种性退化并影响子代[14]。水仙病毒可汁液传播,寄主广泛,病毒介体主要是蚜虫和线虫[15]。水仙病毒病的防治极其困难,现主要的防治手段仍是加强病毒检疫来预防病毒病的暴发[2]。已经报道的水仙病毒病在中国主要分布在福建、上海、浙江等地区,国外主要分布在日本、澳大利亚、英国等。
本研究利用水仙病毒通用引物,从江苏省扬州市采集的水仙上鉴定到3种病毒,其中,NCLV主要分布在中国,且在国内其分布也具有明显的地理差异性,NCLV YZ与上海分离物聚为一组,而福建漳州分离物聚为另一组,可能是由于目前国内水仙种球生产南北集中在福建省漳州市和江苏省宿迁市,而江苏和上海地区水仙可能来源于宿迁造成的。目前已报道的NDV集中在中国和日本,且不同来源的分离物间具有极高的相似性,但系统发育分析结果表明NDV在中国和日本间仍具有清晰的地理差异性。NYSV在这3个病毒中具有最高的遗传差异,来自于中国、日本、印度的NYSV在不同组间相互交叉,没有明显的地理差异性,这表明NYSV不同株系都能在中国、日本、印度等地区侵染扩散。NYSV可通过多种蚜虫以非持久性方式传播,包括甜菜蚜Aphis fabae、豌豆蚜Acyrthosiphon pisum和大戟长管蚜Macrosiphum euphorbiae等[16]。NYSV如此多样的遗传差异,可能正是由于上述多样的传播介体决定的。这与已报道的黄瓜花叶病毒Cucumber mosaic virus (CMV)、芜菁花叶病毒Turnip mosaic virus (TuMV)、马铃薯Y病毒Potato virus Y (PVY)和花椰菜花叶病毒Cauliflower mosaic virus (CaMV) 等相似[1720]。
本研究在江苏省扬州市水仙上鉴定到NCLV、NDV和NYSV,并且对这3种病毒分别进行了序列多样性的系统发育分析,明确了NCLV、NDV和NYSV扬州分离物与已报道的其他分离物遗传差异、聚类分布和地理特异性特征,为水仙病毒病的合理防控提供了理论依据。
参考文献
[1] 陈段芬,高健,彭镇华.水仙属植物研究进展[J].林业科学,2008,44(3):140146.
[2] 郑红英,鲁宇文,沈嘉乐,等.侵染水仙的虎眼万年青花叶病毒外壳蛋白的原核表达、抗血清制备及应用[J].浙江农业学报,2009,21(3):198201.
[3] 郑红英,林林,鲁宇文,等.水仙普通潜隐病毒基因组全序列及其与香石竹潜隐病毒属病毒的关系[C].彭友良.中国植物病理学会2006年学术年会论文集.北京:中国农业科学技术出版社,2006.
[4] 臧穎,严纯,戴凯新,等.水仙病毒病研究进展[J].北方园艺,2019(5):153160.
[5] ZHENG H Y, CHEN J, ADAMS M J, et al. Complete nucleotide sequence and affinities of the genomic RNA of Narcissus common latent virus (genus Carlavirus)[J]. Archives of Virology, 2006, 151(8):16671672.
[6] 梁艳,宋荣浩,杨翠云,等.上海崇明水仙病毒病病原种类鉴定[J].植物病理学报,2008,38(5):456461.
[7] 林双庆.福建漳州水仙病毒病的病原鉴定及两病毒基因组全序列分析[D].福州:福建农林大学,2012.
[8] WARD L I, VEERAKONE S, TANG J, et al. First report of Narcissus degeneration virus, Narcissus late season yellows virus, and Narcissus symptomless virus on Narcissus in New Zealand [J]. Plant Disease, 2009, 93(9): 964.
[9] CHEN J, CHEN J P, LANGEVELD S A, et al. Molecular characterization of Carla and Potyviruses from Narcissus in China [J]. Journal of Phytopathology, 2010, 151(1): 2629.
[10]WYLIE S J, JONES M G. Complete genome sequences of seven carlavirus and potyvirus isolates from Narcissus and Hippeastrum plants in Australia, and proposals to clarify their naming [J]. Archives of Virology, 2012, 157(8):14711480.
[11]WYLIE S J, LI Hua, SIVASITHAMPARAM K, et al. Complete genome analysis of three isolates of Narcissus late season yellows virus and two of Narcissus yellow stripe virus: three species or one?[J]. Archives of Virology, 2014, 159(6):1521.
[12]ZHENG L, RODONI B C, GIBBS M J, et al. A novel pair of universal primers for the detection of potyviruses [J]. Plant Pathology, 2010, 59(2):211220.
[13]OHSHIMA K, MURAOKA S, YASAKA R, et al. First report of Scallion mosaic virus, on wild Japanese garlic (Allium macrostemon) in Japan [J]. Journal of General Plant Pathology, 2015, 82(1):14.
[14]OHSHIMA K, NOMIYAMA R, MITOMA S, et al. Evolutionary rates and genetic diversities of mixed potyviruses in Narcissus [J].Infection Genetics & Evolution,2016,45:213223.
[15]林含新, 林奇英. 水仙病毒病及其研究進展[J]. 植物检疫, 1996(4): 227229.
[16]沈建国, 高芳銮, 蔡伟, 等. 进境欧洲水仙种球上病毒的检测与鉴定[J]. 植物保护学报, 2017, 44(2): 283289.
[17]沈建国, 高芳銮, 林双庆, 等. 一步RT PCR检测水仙黄条病毒[J]. 生物技术, 2014(1): 4448.
[18]RYOSUKE Y, NGUYEN H D, HO S Y W, et al. The temporal evolution and global spread of Cauliflower mosaic virus, a plant pararetrovirus [J/OL]. PLoS ONE, 2014, 9(1):e85641.
[19]OHSHIMA K, YAMAGUCHI Y, HIROTA R, et al. Molecular evolution of Turnip mosaic virus: evidence of host adaptation, genetic recombination and geographical spread [J]. Journal of General Virology, 2002, 83(6):15111521.
[20]OHSHIMA K, MATSUMOTO K, YASAKA R, et al. Temporal analysis of reassortment and molecular evolution of Cucumber mosaic virus: Extra clues from its segmented genome[J]. Virology, 2015, 487: 188.
[21]CUEVAS J M, DELAUNAY A, RUPAR M, et al. Molecular evolution and phylogeography of Potato virus Y based on the CP gene [J].Journal of General Virology,2012,93(11):24962501.
(责任编辑:张文蔚)
