昆虫病原线虫与Bt联用对黏虫的防治效果
2019-02-10李而涛曹雅忠张帅李克斌李金桥李晓峰张海茹尹姣
李而涛 曹雅忠 张帅 李克斌 李金桥 李晓峰 张海茹 尹姣
摘要 :為明确昆虫病原线虫与Bt联用后对黏虫致病力的协同增效作用,本研究分别测定了自主分离获得的一种新嗜菌异小杆属线虫Heterorhabditis sp.(LF)和实验室保存的Heterorhabditis bacteriophora(Hb)线虫对黏虫的致病力;比较了两种Bt菌株(HD1和G03)对黏虫的毒力差异,开展了G03对黏虫的毒力测定试验;明确了室内和田间试验条件下两种线虫(LF和Hb)与G03联用对黏虫的交互作用。结果表明,黏虫的死亡率随两种线虫剂量的增加而增加,在100 IJs/mL剂量下黏虫死亡率均达到了90%以上;Bt菌株G03对黏虫的毒力显著高于HD1,G03对黏虫的LC50为3.55×1010 cfu/mL;室内条件下LF 25 IJs/mL+G03(LC50)联用处理6 d对黏虫的防治具有显著的协同增效作用,较单独LF线虫和G03处理死亡率分别提高了50.72和50.0百分点,Hb 25 IJs/mL+G03(LC50)联用处理6 d对黏虫的防治也具有显著的协同增效作用,较单独Hb线虫和G03处理死亡率分别提高了76.67和50.0百分点;田间小区试验表明线虫与Bt联用对黏虫的防治具有协同的加成或增效作用,其中LF线虫与G03联用具有显著的增效作用,较单独LF线虫和Bt处理死亡率分别提高了47.96和46.80百分点。本研究为黏虫的防治提供了新的技术措施,拓宽了黏虫生防研究的思路。
关键词 :昆虫病原线虫; Bt; 黏虫; 协同增效
中图分类号:
S 433.4; S 476
文献标识码: B
DOI: 10.16688/j.zwbh.2018493
Control efficacy of the combined application of the entomopathogenic nematode
and Bt against the oriental armyworm,Mythimna separata (Walker)
LI Ertao1, CAO Yazhong1, ZHANG Shuai1, LI Kebin1, LI Jinqiao1, LI Xiaofeng1, ZHANG Hairu2, YIN Jiao1
(1. State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy
of Agricultural Sciences, Beijing 100193, China; 2. Bureau of Agriculture and Animal Husbandry of Kuancheng
Manzu Autonomous County, Chengde City, Hebei Province, Chengde 067600, China)
Abstract
In this study, we examined possible synergistic effects resulted from a combined application of the entomopathogenic nematode and Bt based on their virulence against Mythimna separata. The virulence of a newly isolated nematode Heterorhabditis sp. (LF) and a laboratory maintained nematode Heterorhabditis bacteriophora (Hb) against Mythimna separata was determined and the virulence of two Bt strains (HD1 and G03) against M.separata was compared. The interactive effect of two nematodes (LF and Hb) and G03 on M.separata was determined under both laboratory and field conditions. The results showed that the mortality of M.separata increased with the dose of two nematodes. The mortality of M.separata reached more than 90% when 100 IJs/mL was applied. The LC50 value of of Bt strain G03 was 3.55×1010 cfu/mL,significantly higher than that of HD1. Compared to single application of nematode or Bt, combined application exhibited a significant synergistic effect. The mortality of M.separata increased by 50.72% and 50.0% when LF 25 IJs/mL+G03 (LC50) was applied for 6 days under indoor conditions, respectively. The application of Hb 25 IJs/mL+G03 (LC50) exhibited a significant synergistic effect of 76.67% and 50.0% under indoor conditions after 6 days compared to the controls (Hb or G03 applied alone), respectively. Field trials showed that a combined application of nematodes and Bt had additive or synergistic effects on the mortality of M.separata. The combination of LF nematode and G03 showed a significant synergistic effect of 47.96% and 46.80%, respectively, higher than nematodes and Bt when applied alone. This study not only provides a new technical measure for the prevention and control of M.separata but also expands the research scope of biological control of M.separata.
1.2.2 Bt菌株HD1和G03对黏虫的毒力比较
在玻璃培养皿中(d =13 cm)加入50 g左右的灭菌土(湿度18%左右、过40目筛),铺平。将培养好的Bt菌株HD1和G03用无菌水稀释为1.5×1012cfu/mL,将新鲜玉米叶片在菌悬液中浸渍约1 min,拿出后自然晾干,取适量放入培养皿中,每皿分别接入20头健康、个体均匀的3龄黏虫幼虫。每个处理设3个重复,同时以浸渍无菌水作为对照。各处理置于人工气候箱中正常饲养。根据需要及时添加浸渍菌液后并晾干的玉米叶,每隔24 h观察并记录黏虫死亡情况。
1.2.3 Bt菌株G03对黏虫的毒力测定
毒力测定方法同1.2.2,其中将培养好的Bt菌株G03用无菌水稀释成1.0×1010、0.5×1011、1.0×1011、0.5×1012、1.0×1012cfu/mL 5个浓度梯度,每隔24 h统计黏虫死亡情况并计算LC50。
1.2.4 昆虫病原线虫LF和Hb分别与Bt联用对黏虫致病力的交互作用
将线虫LF和Hb的侵染期幼虫分别用无菌水稀释成25 IJs/mL和50 IJs/mL两个浓度梯度,Bt菌株G03浓度设为LC50(3.55×1010cfu/mL),将不同浓度的LF、Hb线虫与G03菌株两两组合后分别测定其对黏虫的致病力,各组合分别为A:LF 25 IJs/mL+G03(LC50);B:LF 50 IJs/mL+G03(LC50);C:Hb 25 IJs/mL+G03(LC50);D:Hb 50 IJs/mL+G03(LC50)。各组合处理方法如下:在玻璃培养皿中(d =13 cm)加入50 g左右的灭菌土,铺平。将新鲜玉米叶片在G03菌悬液中浸渍约1 min,拿出后自然晾干,取适量放入培养皿中,每皿分别接入20头健康、个体均匀的3龄黏虫幼虫。待黏虫取食经G03菌悬液浸渍的玉米叶片48 h后[25],取1 mL摇匀的线虫悬浮液均匀滴到培养皿中,每个组合处理设3个重复,同时以喂食未处理玉米叶片为对照。各处理置于人工气候箱中正常饲养。根据需要及时添加浸渍菌液后并晾干的玉米叶,每隔24 h观察并记录黏虫死亡情况。
1.2.5 昆虫病原线虫与Bt联用对黏虫致病力交互作用的田间试验
6月中旬播种玉米,生長至喇叭口期时,选择天气连续为阴天或多云时开展田间试验。试验田共分为18个小区,每小区面积为12 m2(3 m×4 m),并罩有高度为2 m的40目网纱。各小区之间间隔2 m。试验共设6个处理,分别为单独LF、Hb线虫处理,单独G03处理,LF与G03联用、Hb与G03联用处理,清水对照处理,每处理设3个重复。LF、Hb线虫浓度为2.5×103IJs/m2,Bt菌株G03浓度为1.11×1016cfu/m2。傍晚接虫,在每个小区的每株玉米的卷芯中放入3头2龄黏虫幼虫,田间适应2 d后,观察并统计每株上幼虫数并保证在喷施线虫或Bt前每株上只有2头3龄幼虫。整个试验均采用喷雾的方式将线虫和Bt均匀喷施在每个小区的玉米叶片和地面上,对于联用小区在Bt处理48 h后喷施线虫(傍晚)。每隔24 h观察并记录黏虫死亡情况。
1.3 数据分析
试验结果中黏虫的死亡率均为校正死亡率(%)。百分数值均经反正弦转换后在Excel 2003与SPSS 17.0统计软件上完成分析。处理之间的差异采用方差分析,然后采用Duncan氏法测验不同处理之间的差异显著性,概率水平设P<0.05。毒力回归方程及致死中浓度用probit模型分析。
校正死亡率=处理死亡率-对照死亡率1-对照死亡率×100%。
由χ2检验判断线虫与Bt联合作用类型[2628]。各处理昆虫的死亡率=死亡虫数除以处理总虫数,并且转换为校正死亡率。线虫与Bt联用对参试昆虫的期望致死数ME由期望致死率M =MN+MB(1-MN),乘以参试昆虫总数计算而得,其中MN和MB分别为线虫和Bt单独处理时试虫的校正死亡率。χ2=(MNB-ME)2 /ME,其中MNB为线虫与Bt联用时试虫的实际校正死亡数,ME为线虫与Bt联用时试虫的期望致死数。计算出的χ2值与χ2值表进行比较。当χ2≥3.84(df=1和P =0.05)及MNB
2 结果与分析
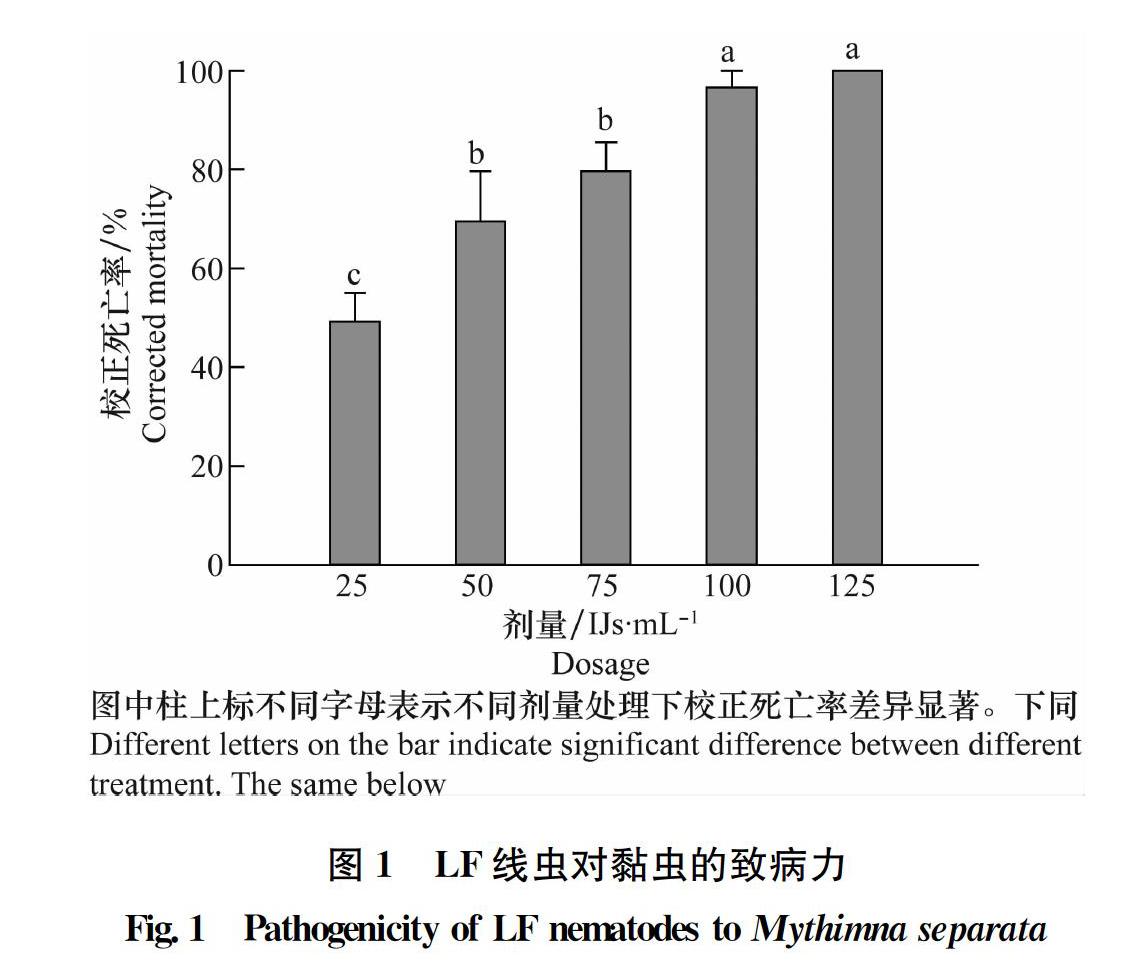
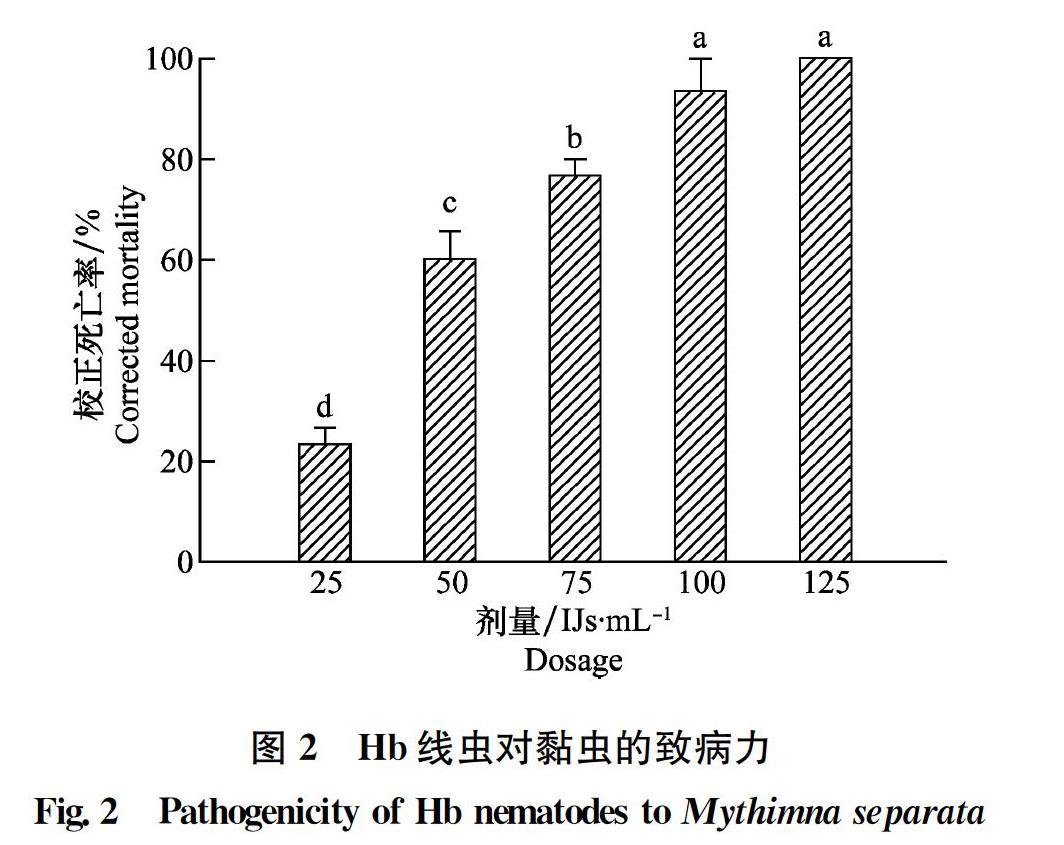
2.1 昆虫病原线虫LF与Hb对黏虫的致病力
LF线虫处理6 d后对黏虫致病力结果如图1所示:黏虫的死亡率随线虫剂量的增加而增加,在100 IJs/mL和125 IJs/mL剂量下黏虫死亡率均达到了95%以上,且两者差异不显著(P>0.05),但均显著高于75 IJs/mL处理的死亡率(P<0.05);75 IJs/mL与50 IJs/mL处理间差异不显著(P>0.05),但均显著高于25 IJs/mL的处理(P<0.05),25 IJs/mL剂量处理后黏虫死亡率为49.28%。Hb线虫对黏虫致病力趋势与LF线虫类似(图2),但75 IJs/mL与50 IJs/mL处理间黏虫死亡率差异显著(P<005),25 IJs/mL剂量下黏虫死亡率仅为2333%。可见,LF线虫对黏虫致病力略高于Hb线虫。
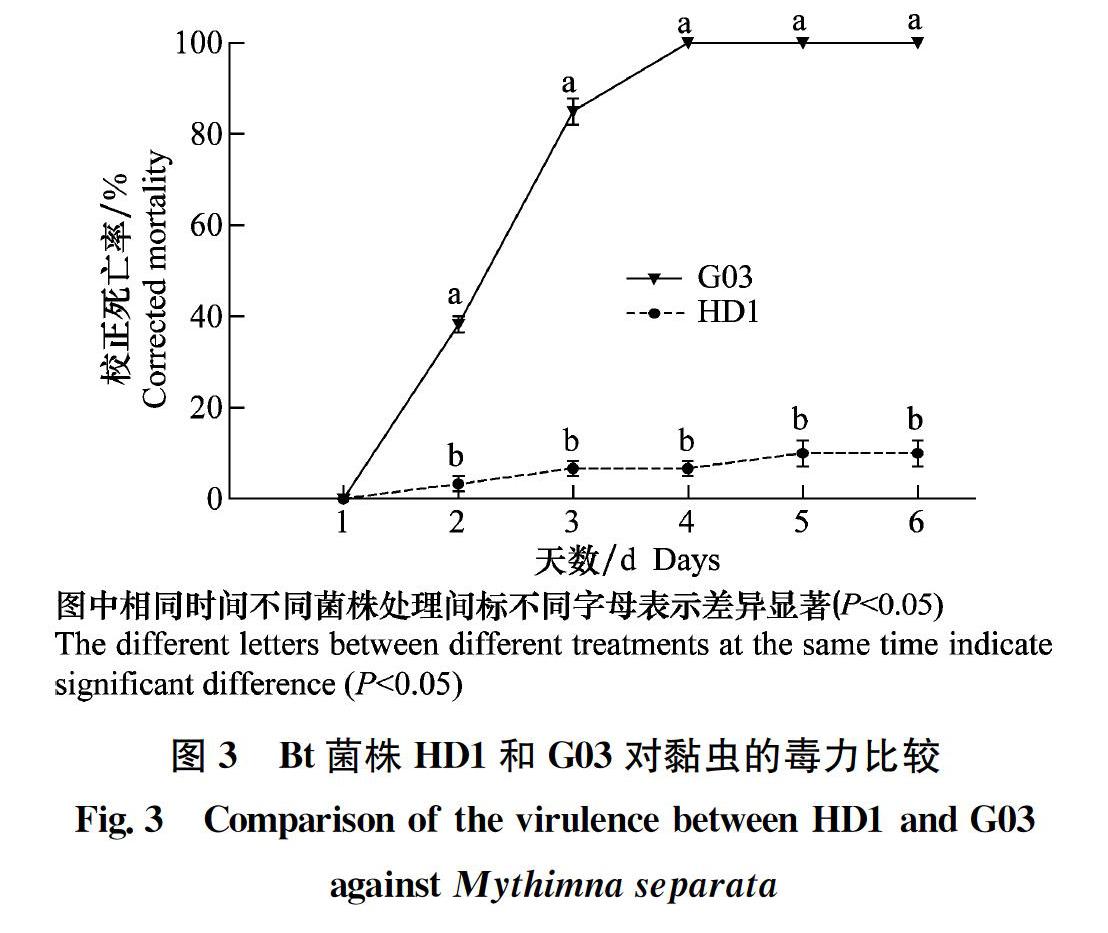
2.2 Bt菌株HD1和G03对黏虫的毒力比较
两种Bt菌株对黏虫毒力结果如图3所示:HD1菌株对黏虫毒力较弱,处理5 d后黏虫死亡率仅为10.0%,且以后不再增加;G03菌株对黏虫毒力较强,4 d后达到100%;图中可以明显看出在处理2 d后的任何时间段G03对黏虫的毒力均显著高于HD1菌株(P<0.05),表明G03菌株具有更为广阔的应用前景。
2.3 Bt菌株G03对黏虫的毒力测定
室内测定不同浓度下G03对黏虫的毒力,由动态图(图4)可知:整体上黏虫死亡率随Bt浓度和处理时间的增加而增加;4 d后死亡率增加趋势减缓,5 d后基本上不再增加。用1.0×1010、0.5×1011、1.0×1011、0.5×1012、1.0×1012cfu/mL的Bt浓度处理6 d后,黏虫死亡率分别达到了28.33%、50.00%、70.00%、96.67%和100.00%。由表1可知G03对黏虫的致死中浓度LC50为3.55×1010cfu/mL,相关系数为0.956。
2.4 病原线虫LF和Hb分别与Bt(G03)联用后对黏虫的致病作用
由表2可知,无论是病原线虫LF还是Hb与Bt菌株G03联用后都具有一定的协同作用。LF 25 IJs/mL与G03联用(A)处理不同时间黏虫的死亡率均显著高于单独线虫处理(P<0.05),联用处理6 d黏虫的死亡率显著高于LF线虫或Bt单独处理(P<005),分别提高了50.72和50.0百分点,表现为增效作用(ME=44.78,MNB=60,χ2=5.17);LF 50 IJs/mL与G03联用处理不同时间的防治效果好于线虫或Bt单独处理(P<0.05),均表现为加成作用。Hb 25 IJs/mL与G03联用处理不同时间差异显著(P<0.05),联用处理下黏虫的死亡率显著高于单独Bt处理(P<0.05),联用处理6 d黏虫的死亡率显著大于Hb线虫或Bt单独处理(P<0.05),分别提高了76.67和50.0百分点,表现为增效作用(ME=37.00,MNB=60.0,χ2=1430);Hb 50 IJs/mL与G03联用处理不同时间的防治效果均好于单独Bt处理(P<0.05),表现为加成作用。
2.5 病原线虫LF和Hb分别与Bt(G03)联用对黏虫致病力的田间试验
LF线虫与G03联用田间效果如图5所示:线虫与Bt联用4 d表现为加成作用,较单独的线虫与Bt处理下黏虫死亡率分别提高了43.29和45.23百分点,联用6 d后表现为显著的协同增效作用(ME=35.47,MNB=50.06,χ2=6.00>3.84),较单独线虫和Bt处理的死亡率分别提高了47.96和46.80百分点。
Hb线虫与G03联用对黏虫的田间效果如图6所示:线虫与Bt联用4 d较单独线虫和Bt处理的黏虫死亡率分别提高了35.95和35.61百分点,联用6 d较单独线虫和Bt处理死亡率分别提高了43.99和36.78百分点,均表现为加成作用。
田间试验结果表明病原线虫LF、Hb与Bt菌株G03联用对黏虫的控制具有协同增效或加成作用,可显著提高对黏虫的致病力,缩短防控所需时间,其中病原线虫LF与G03联用效果较佳。
3 讨论
黏虫是我国重要的暴发性害虫,目前对其防控方法比较单一,以化学防治为主,存在破坏自然生境、黏虫抗药性增强等潜在风险。而生物防治具有绿色、无污染、对人畜安全等優点颇受关注。为此本研究从黏虫的绿色防控角度出发,利用昆虫病原线虫和Bt两种生防因子对黏虫的致病力展开了研究,同时探讨了两者联用的协同增效作用,以期达到防虫、减药、增收的目的。尤为重要的是,随着转Bt玉米的大面积种植和推广,此研究结果可以为经典的生物控制策略与转基因Bt作物相结合的技术集成提供借鉴,开辟对重大害虫协调管理的新途径。
目前,我国利用昆虫病原线虫防治黏虫的研究报道中多数防治效果不佳。例如施用DD-136线虫(1 800 IJs/mL)对黏虫仅有40%的防效[29],田间应用中华卵索线虫Ovomermis sinensis(4 500 IJs/m2)防治黏虫时其校正寄生率也仅为52%[30]。为充分利用我国线虫资源,深入挖掘对黏虫有效的生防线虫,实验室通过大蜡螟诱集获得了一种对黏虫较为有效的嗜菌异小杆属线虫LF,该线虫在100 IJs/mL剂量下处理6 d黏虫的死亡率达到了95%以上;另外一种嗜菌异小杆属线虫Hb在相同浓度下黏虫的死亡率达到了90%以上;而赵奎军等室内应用斯氏线虫S.feltiae Beijing品系在800 IJs/mL剂量下处理6 d后黏虫的死亡率仅为78.9%[12],说明嗜菌异小杆属的这两种线虫在黏虫的控制上具有巨大的生防潜力。但相比于化学农药,其速效性较差。
蒋善军等研究表明Bt对黏虫也有较好的防治效果[31]。试验中比较了两种Bt菌株对黏虫的毒力差异,结果显示在相同剂量下G03处理后黏虫死亡率高达100%,而HD1菌株仅有10%。该生测结果与姚萌等比较G03和HD1基因组分析结果相吻合,其研究结果显示,G03菌株含有HD1不具有的Cry1Ca、Cry1Da基因,使其在虫害控制方面更具优势;与HD1相比,G03含有较少的噬菌体、转座子相关基因,G03可能有更好的遗传稳定性,使其在发酵中更稳定[32]。尽管G03表现出了较为优秀的杀虫活性,但其需要较高的浓度(0.5×1012 cfu/mL及以上)才可高效杀死黏虫,而较高的浓度将增加黏虫产生抗性的风险。已有研究表明长期使用高浓度Bt会使目标害虫产生抗药性,如美国棉铃虫Helicoverpa armigera在田间对Bt棉产生了抗性,印度田间的红铃虫Pectinophora gossypiella对Cyr1Ac产生了抗性等[3334]。而将两种昆虫病原线虫分别与Bt菌株G03联用后,室内和田间结果均表明对黏虫具有显著的加成或增效作用。在田间试验中,LF线虫与G03联用后较单独线虫和Bt处理黏虫的死亡率分别提高了47.96和46.80百分点。因此,线虫和Bt联用一方面可以减少线虫和Bt的使用剂量、提高速效性、节约防治成本,另一方面可以降低黏虫对线虫或Bt产生抗性的风险。
应用Bt预处理后,Bt菌株产生的毒素可能会引起黏虫中肠组织病变导致其中肠肠壁细胞排列疏松,细胞明显出现空洞化[35],这不仅便于病原线虫侵入,同时导致黏虫自身免疫力降低,对线虫的抵御能力下降,有利于其共生菌在黏虫体内繁殖;线虫会对寄主体内的CO2浓度、分泌物等做出敏感反应[36],而经Bt处理后势必会引起寄主体内代谢活动的变化[37],间接提高了线虫的侵入几率,以上因素都可能是两者联用产生加成或增效效果的原因。
本试验在田间进行期间,气候条件比较适宜线虫的存活和侵染。实际应用时建议与一些线虫保湿剂配合使用,尽量避开晴天或多雨天气。本研究只是初步明确了线虫与Bt联用对黏虫的防控具有协同作用,后续试验还需要评估Bt菌株是否会对线虫受精卵、各龄期幼虫的活力存在副作用,取食Bt后的黏虫对线虫寄生情况的影响以及线虫和Bt施用后持效期的长短等;另外还需从组织病理学及体内相关酶活性变化的角度对联用机理展开深入研究,为推动此防治策略在黏虫上的推广应用奠定基础。
参考文献
[1] 江幸福,张蕾,程云霞,等.我国粘虫研究现状及发展趋势[J].应用昆虫学报,2014,51(4):881889.
[2] 中国农业科学院植物保护研究所,中国植物保护学会.中国农作物病虫害[M].第3版.北京:中国农业出版社,2014:14301440.
[3] 姜玉英,李春广,曾娟,等.我国粘虫发生概况:60年回顾[J].应用昆虫学报,2014,51(4):890898.
[4] 刘洪娟.黑龙江省粘虫生物防治的重要性及主要生防类群[J].农村实用科技信息,2013(12):20.
[5] 董杰,刘小侠,岳瑾,等.北京地区粘虫对5种杀虫剂的抗药性[J].农药学学报,2014,16(6):687692.
[6] GEORGIS R, KOPPENHFER A M, LACEY L A, et al. Successes and failures in the use of parasitic nematodes for pest control [J]. Biological Control, 2006, 38(1):103123.
[7] 杨秀芬,杨怀文.昆虫病原线虫的致病机理[J].中国生物防治,1998(4):3842.
[8] POINAR G O. Taxonomy and biology of Steinernematidae and Heterorhabditidae [M]∥GAUGLER R, KAYA H K. Entomopathogenic Nematodes in Biological Control. CRC Press, Boca Raton, FL. 1990: 2361.
[9] BOEMARE N E, AHKURST R J, MOURANT R G. DNA relatedness between Xenorhabdus spp. (Enterobacteriaceae), symbiotic bacteria of entomopathogenic nematodes, and a proposal to transfer Xenorhabdus luminescens to a new genus, Photorhabdus gen [J]. International Journal of Systematic Bacteriology, 1993, 43(2):244255.
[10]李慧萍,韓日畴.昆虫病原线虫感染寄主行为研究进展[J].昆虫知识,2007,44(5):637642.
[11]吴文丹,孙昊雨,席景会,等.嗜菌异小杆线虫侵染后暗黑鳃金龟和大黑鳃金龟幼虫脂肪体和中肠组织超微结构观察[J].昆虫学报,2015,58(8):836845.
[12]赵奎军,张丽坤,宋捷,等.应用斯氏线虫防治8种鳞翅目、鞘翅目昆虫的研究[J].植物保护学报,1996(1):2024.
[13]SHAPIRO ILAN D I, GOUGE D H, PIGGOTT S J, et al. Application technology and environmental considerations for use of entomopathogenic nematodes in biological control [J]. Biological Control, 2006, 38(1):124133.
[14]SHAPIRO ILAN D I, GOUGE D H, KOPPENHFER A M.Factor affecting commercial success:case studies in cotton turf and citrus [J]. Entomopathogenic Nematology, 2002, 16:333356.
[15]VITERI D M, LINARES A M, FLORES L. Use of the entomopathogenic nematode Steinernema carpocapsae in combination with low toxicity insecticides to control fall armyworm (Lepidoptera:Noctuidae) larvae[J]. Florida Entomologist, 2018, 101(2):327329.
[16]NEGRISOIL A S, GARCIA M S, BARBOSA N, et al. Efficacy of entomopathogenic nematodes (Nematoda:Rhabditida) and insecticide mixtures to control Spodoptera frugiperda (Smith, 1797) (Lepidoptera:Noctuidae) in corn crops[J]. Crop Protection, 2010, 29(7):677683.
[17]BRAVO A, LIKITVIVATANAVONG S, GILL S S, et al. Bacillus thuringiensis:A story of a successful bioinsecticide [J].Insect Biochemistry and Molecular Biology, 2011, 41(7):423431.
[18]JOUZANI G S, VALIJANIAN E, SHARAFI R. Bacillus thuringiensis:a successful insecticide with new environmental features and tidings [J]. Applied Microbiology and Biotechnology, 2017, 101(7):26912711.
[19]SCHNEPL E, CRICKMORE N, VAN RIE J, et al. Bacillus thuringiensis and its pesticidal crystal proteins [J]. Microbiology and Molecular Biology Reviews, 1998, 62(3):775806.
[20]KIROUAC M, VACHON V, NOL J F, et al. Amino acid and divalent ion permeability of the pores formed by the Bacillus thuringiensis toxins Cry1Aa and Cry1Ac in insect midgut brush border membrane vesicles [J]. Biochemical et Biophysical Acta, 2002, 1561(2):171179.
[21]VACHON V, LAPRADE R, SCHWARTZ J L. Current models of the mode of action of Bacillus thuringiensis insecticidal crystal proteins:a critical review [J]. Journal of Invertebrate Pathology, 2012, 111(1):112.
[22]WHITE G F. A method for obtaining infective nematode larvae from cultures [J]. Science, 1927, 66(1709):302303.
[23]GAUGLER R. Entomopathogenic nematodes[M]. Wallingford, UK:CBAI. Parasitology, 2002: 115144.
[24]MALAN A P, KONETAE R, MOORE S D. Isolation and identification of entomopathogenic nematodes from citrus orchards in South Africa and their biocontrol potential against false codling moth[J]. Journal of Invertebrate Pathology, 2011, 108(2):115125.
[25]KOPPENHFER A M, GREWAL P S, KAYA H K. Synergism of imidacloprid and entomopathogenic nematodes against white grubs:the mechanism[J]. Entomologia Experimentalis et Applicata, 2000, 94(3):283293.
[26]KOPPENHFER A M, KAYA H K. Additive and synergistic interaction between entomopathogenic nematodes and Bacillus thuringiensis for scarab grub control [J]. Biological Control, 1997, 8(2):131137.
[27]KOPPENHFER A M, COWLES R S, COWLES E A, et al. Comparison of neonicotinoid insecticides as synergists for entomopathogenic nematodes [J].Biological Control,2002,24(1):9097.
[28]MCVAY J R, GUDAUSKAS R T, HARPER J D. Effects of Bacillus thuringiensis nuclear polyhedrosis virus mixtures on Trichoplusia ni larvae [J]. Journal of Invertebrate Pathology, 1997, 29(3):367372.
[29]秦久剛,周意滨.新线虫DD-136防治粘虫研究初报[J].湖北农业科学,1984(6):2122.
[30]张自亮,雷书芳,王合松,等.1990年人工释放中华卵索线虫防治麦田一代粘虫试验[J].生物防治通报,1992(4):148150.
[31]蒋善军,罗礼智,胡毅,等.Cry1Ac毒蛋白对粘虫生长发育、繁殖及飞行能力的影响[J].昆虫学报,2010,53(12):13601366.
[32]姚萌,王奎,束长龙,等.苏云金芽胞杆菌G03菌株的比较基因组分析[J].生物技术通报,2018(10):187193.
[33]ALI M L, LULLTTRELL R G, YOUNG S Y. Susceptibilities of Helicoverpa zea and Heliothis virescens (Lepidoptera: Noctuidae) population to Cry1Ac insecticidal protein [J]. Journal of Economic Entomology, 2006, 99(1):164175.
[34]TABASHNIK B E. Communal benefits of transgenic corn [J]. Science, 2010, 330(6001):189190.
[35]王小奇,束长龙,蒋健,等.对大黑鳃金龟甲幼虫高效的苏云金芽胞杆菌筛选及Cry基因鉴定[J].植物保护学报,2016,43(3):483492.
[36]杨秀芬,杨怀文.昆虫病原线虫的致病机理[J].中国生物防治,1998(4):3842.
[37]谭树乾.Cry8Ga1和Cry8Ea1蛋白毒杀蛴螬的生理生化机制研究[D].杨凌:西北农林科技大学,2013.
(责任编辑:杨明丽)
