当归生药中两种PR-10蛋白亚型的纯化与表征
2019-01-30王香玲李娴何火聪李玲玲吕迪陈翠煌叶小强刘树滔潘剑茹
王香玲,李娴,何火聪,李玲玲,吕迪,陈翠煌,叶小强,刘树滔,潘剑茹
1 福州大学 生物科学与工程学院,福建 福州 350108
2 福建医科大学附属肿瘤医院/福建省肿瘤医院放射生物学及肿瘤放射治疗学研究室,福建 福州 350014
3 福建省科技厅转化医学重点实验室,福建 福州 350014
病程相关 (PR) 蛋白是宿主植物因各类病原体 (例如病毒、细菌和真菌) 诱导产生的一类蛋白质[1]。目前根据生物学活性、物理化学性质及序列同源性将PR蛋白分类为17个家族 (PR-1至PR-17)[2-3]。PR-10家族蛋白属于其中一个类别,广泛地存在于不同单、双子叶植物中[4],该家族又被称为多基因家族,例如豌豆中存在至少5种PR-10基因,麝香中有18种Mal d 1基因[5]等。据报道PR-10蛋白质是多功能蛋白,主要参与植物病原体入侵的防御反应以及各种生物和非生物胁迫的应答反应,但家族成员间没有统一的生物学功能[1]。
研究表明,大多数PR-10蛋白是一类分子量小 (15–18 kDa)、酸性、结构相似且与核糖核酸酶同源的胞内蛋白[4]。最早从人参中分离出具有核糖核酸酶活性的PR-10蛋白为IPR 1和IPR 2[6-7]。类似地,从白羽扇豆根中分离的LaPR-10蛋白具有核糖核酸酶活性[8]。
当归[Angelica sinensis (Oliv.) Diels]是伞形科当归属的一种生多年草本植物。其干燥的贮藏根是我国一味常用的中药材,素有“十方九归”之说。性温,味甘、辛;归肝、心、脾经;具有补血活血、调经止痛、润肠通便的功能[9-10]。现有研究结果表明,当归多糖能有效地改善高脂饮食小鼠的脂肪肝并维持体内葡萄糖平衡[10-11];当归挥发油对高血脂小鼠动脉粥样硬化具有一定的保护作用[12];阿魏酸是较早被分离和鉴定的当归有效成分,也是当归有机酸主要成分之一,能抗动脉粥样硬化[9,13-14]。虽然目前关于当归多糖和当归药效小分子已有很多研究,但对于当归中重要的高分子化合物——蛋白质的研究却很少。本课题组早期研究发现当归中蛋白含量较为丰富,且当归总蛋白具有清除DPPH自由基能力,可促进人正常肝细胞L02增殖[15]。
本课题组近期发现初步纯化的当归低分子量蛋白AP可显著改善小鼠的急性放射损伤[16],且在当归鲜根中也存在PR-10家族蛋白[17]。本研究对当归生药中的AP蛋白进行了进一步纯化,首次从当归生药中纯化得到两种PR-10蛋白亚型(命名为ASPR-C-1和ASPR-C-2),并对二者的理化性质进行了表征。
1 材料与方法
1.1 材料与试剂
当归生药购自甘肃省岷县琪祥阁食品专营店。蛋白分子量marker购自美国Thermo公司。酵母tRNA购自上海宝曼生物科技有限公司。BCA蛋白含量测定试剂盒选购自美国Thermo公司。Sephadex G-50填料购自美国GE公司。DEAE Sepharose Fast Flow填料购自Pharmacia Biotech公司。其余试剂均为分析纯。
1.2 当归蛋白的制备与纯化
1.2.1 制备当归蛋白粗提液
将12.96 g当归生药切成片状,加入10倍体积 (即130 mL) Tris-HCl缓冲液 (0.05 mol/L,pH 8.0),4 ℃静置过夜,次日用4层纱布过滤,滤液于12 000 r/min、4 ℃离心10 min,收集上清 (蛋白粗提液),测定其蛋白含量和核糖核酸酶活力。
1.2.2 硫酸铵一步沉淀
将61.71 g硫酸铵加入蛋白粗提液 (110 mL)进行硫酸铵一步沉淀 (0–80%) (即561 g/L),沉淀过夜后于12 000 r/min、4 ℃离心10 min。收集沉淀,将沉淀溶于2倍体积的Tris-HCl缓冲液(0.05 mol/L,pH 8.0) 中,12 000 r/min、4 ℃离心10 min取上清 (当归生药蛋白粗提液),测定其蛋白含量和核糖核酸酶活力。
1.2.3 凝胶过滤层析分离
将当归生药蛋白粗提液流经以Tris-HCl缓冲液 (0.05 mol/L,pH 8.0) 预先平衡的Sephadex G-50层析柱 (3 cm×105 cm),流速为0.25 mL/min,收集第二个洗脱峰 (P2),测定其蛋白含量和核糖核酸酶活力,并于4 ℃保存备用。
1.2.4 弱阴离子交换柱分离
将样品 (P2) 上柱于用 Tris-HCl缓冲液(0.05 mol/L,pH 7.3) 预先平衡的DEAE-Sepharose弱阴离子交换柱 (2.5 cm×10 cm),流速为1 mL/min,收集穿透峰 1 (C1)、穿透峰 2 (C2),直至OD280<0.035,最后以含1 mol/L NaCl的Tris-HCl缓冲液 (0.05 mol/L,pH 7.3) 洗脱结合的杂蛋白,分别测定穿透峰1和穿透峰2的蛋白含量和核糖核酸酶活力,并于4 ℃保存。
1.3 PAGE和SDS-PAGE
PAGE分离胶浓度为10%,浓缩胶浓度为4%;SDS-PAGE分离胶浓度为15%,浓缩胶浓度为4%。以考马斯亮蓝R-250染色鉴定蛋白,结合PAGE和SDS-PAGE结果检测蛋白纯度;用高碘酸-希夫 (PAS) 染色鉴定糖蛋白[18];以Carestream MI SE 软件通过还原与非还原条件下 (即有无β-巯基乙醇) SDS-PAGE结果计算蛋白质分子量。
1.4 蛋白质及糖基含量测定
以BCA试剂盒测定粗提液和每一步纯化得到的当归蛋白的蛋白含量。以蒽酮硫酸法测定蛋白中糖基含量[19]。
1.5 质谱鉴定
相关蛋白经PAGE电泳后,剪下胶上对应目的蛋白质的条带,送至复旦大学蛋白质组学研究中心使用MALDI-TOF-TOF™ (AB SCIEX) 进行质谱鉴定,并用GPS Explorer (V 3.6) 数据库检索分析。
1.6 核糖核酸酶活性的活性表征
1.6.1 核糖核酸酶活力测定
1.6.2 反应pH的影响
以酵母tRNA为底物,使用缓冲体系 (0.1 mol/L磷酸二氢钠-柠檬酸缓冲液,pH 3.0–7.0;0.05 mol/L Tris-HCl缓冲液,pH 7.0–8.0) 分别将两种蛋白调至pH 3.0、4.0、5.0、6.0、7.0、8.0。按照本文方法1.6.1,在37 ℃反应15 min测定蛋白的核糖核酸酶活性。以最适pH条件下的酶活性为100%,计算各处理的相对酶活性。
1.6.3 反应温度的影响
以酵母tRNA为底物,将两种蛋白分别调至其最适pH,然后分别在温度为30 ℃、40 ℃、50 ℃、60 ℃、70 ℃下反应15 min,测定蛋白的核糖核酸酶活性。测定方法参照本文方法1.6.1,以最适温度条件下的酶活性为100%,计算各处理的相对酶活性。
1.6.4 温度稳定性研究
将ASPR-C-1和ASPR-C-2蛋白分别在常温(25 ℃)、40 ℃、60 ℃、80 ℃、100 ℃下水浴30 min,待样品冷却至室温,4 ℃离心 (12 000 r/min,5 min)取上清,以酵母tRNA为底物,分别于最佳反应条件下测定当归蛋白核糖核酸酶活性。测定方法参照本文方法1.6.1,两种蛋白均以其最适反应条件下的酶活性为100%,计算各处理的相对酶活性。
1.6.5 金属离子、螯合剂、表面活性剂和还原剂等对ASPR-C-1和ASPR-C-2酶活性的影响
过腔的特征主要有音调的依附性、或0性(即可去过腔)、音乐材料的以主调和级音为主性、构式的多样性、音数的不定性、起音的眼位性、乐音进行的级进性、节奏的顿逗性等。下面仅以音调的依附性、音数的不定性、结构的类型性和构式的多样性三点为例。
各种试剂对ASPR-C-1和ASPR-C-2酶活性的影响是分别在最适反应体系中加入含1 mmol/L(终浓度) 的金属离子 (Ca2+、Mg2+、Zn2+、Mn2+、Ag+、Cu2+、Fe2+)、螯合剂EDTA、蛋白还原剂DTT和表面活性剂SDS下测定当归蛋白核糖核酸酶活性。测定方法参照本文方法1.6.1,两种蛋白均以其最适反应条件下的酶活性为100%,计算各处理的相对酶活性。
2 结果与分析
2.1 当归蛋白的纯化
110 mL当归生药蛋白粗提液经过80%硫酸铵沉淀后,复溶,离心取上清,进行Sephadex G-50凝胶过滤层析,收集Sephadex G-50第二峰 (P2),色谱及SDS-PAGE结果如图1所示。由图1B可知,P2峰中含有分子量约为17 kDa蛋白,在PAGE中显示为两条条带 (图2B)。
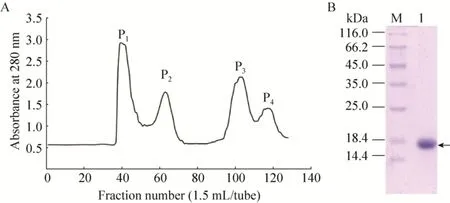
图1 当归生药蛋白粗提液的Sephadex G-50凝胶过滤层析图谱 (A) 与SDS-PAGE分析 (B)Fig.1 Sephadex G-50 gel filtration chromatography (A) and SDS-PAGE (B) of crude extracts of Angelica sinensis.M:protein weight markers; 1: P2 fractions.
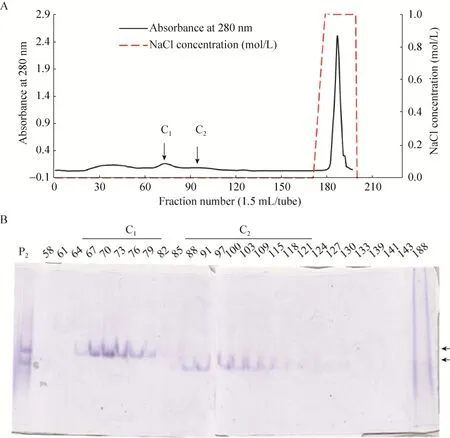
图2 P2组分的DEAE-Sepharose阴离子交换柱图谱 (A) 与PAGE分析 (B)Fig.2 DEAE-Sepharose chromatography (A) and PAGE (B) of P2 fractions.P2: P2 fractions; 58–188: fractions of DEAE-Sepharose chromatography.
将Sephadex G-50第二峰进行DEAE-Sepharose弱阴离子交换层析,分别收集穿透峰1 (67–82管,C1) 和穿透峰2 (88–121管,C2),其色谱结果和PAGE分析结果如图2所示。由图2B可知,DEAE-Sepharose可将PAGE上对应的两种蛋白分离开,穿透峰1 (C1) 和穿透峰2 (C2) 均为PAGE纯的蛋白,将其分别命名为ASPR-C-1和ASPR-C-2。为进一步验证其纯度,分别取两个峰的组分进行SDS-PAGE分析,结果如图3A所示,由图可知,ASPR-C-1 (泳道1) 和ASPR-C-2 (泳道2) 在还原条件下为SDS-PAGE纯的组分。两种蛋白的纯化过程如表1所示,ASPR-C-1比活力为73.69 U/mg,纯化倍数为5.35,ASPR-C-2酶的比活力为146.68 U/mg,纯化倍数为10.64。
2.2 蛋白二聚体和糖基分析
如图3所示,ASPR-C-1和ASPR-C-2蛋白在还原条件下经Carestream MI SE 软件计算得出分子量分别为17.33 kDa和17.18 kDa。在非还原条件下,ASPR-C-1和ASPR-C-2蛋白都出现了少量高分子量条带,分子量分别为35.66 kDa和35.32 kDa,是ASPR-C-1和ASPR-C-2蛋白分子量的2倍,可知高分子量的蛋白是ASPR-C-1和ASPR-C-2在溶液中部分聚集所形成的二聚体。
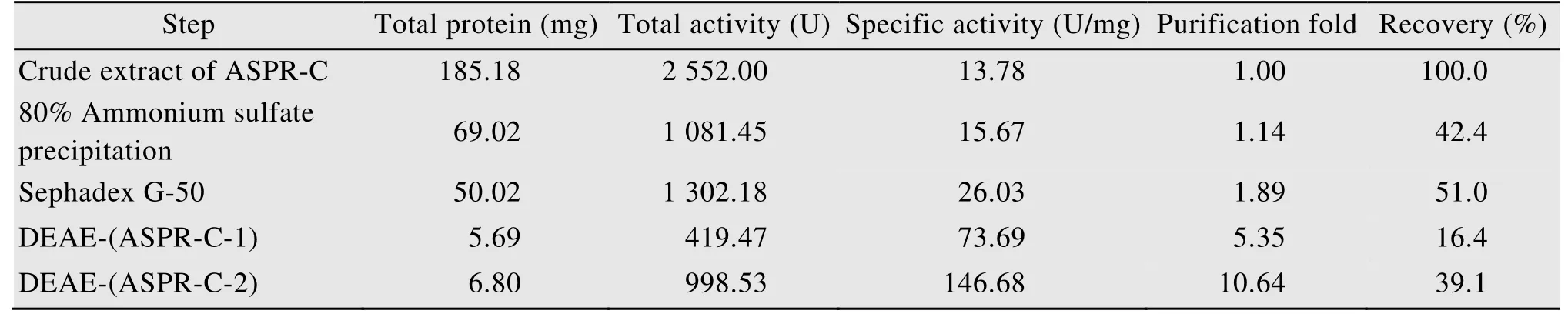
表1 两种蛋白亚型的纯化表Table 1 Purification summary of two isoforms.

图3 两种蛋白亚型的SDS-PAGE分析Fig.3 SDS-PAGE analysis of two isoforms.(A) SDS-PAGE of the isoforms with β-mercaptoethanol.(B) SDS-PAGE of the isoforms without β-mercaptoethanol.(C) PAS staining of the isoforms.M: protein weight marker, 1: ASPR-C-1, 2:ASPR-C-2.
如图3C所示,ASPR-C-1和ASPR-C-2蛋白在SDS-PAGE上的条带经PAS染色后均呈紫红色,表明两种蛋白均为糖蛋白。经蒽酮硫酸法检测,ASPR-C-1和ASPR-C-2糖基含量分别为2.6%和8.2%。
2.3 质谱鉴定
对纯化的当归生药蛋白进行AB SCIEX 5800 TOF/TOF质谱分析,得到其肽指纹图谱 (PMF,并将PMF质荷比为1 861.69 (ASPR-C-1)、952.52(ASPR-C-2) 的肽段作为母离子进行MALDI-TOF-MS(AB SCIEX) 二级质谱分析,用Masoct软件搜索NCBI nr 蛋白质数据库,鉴定结果如表2所示。由表2结果可知,与ASPR-C-1最为匹配的蛋白是来自胡萝卜Daucus carota的分子量为16 508 Da、得分为100、登录号为gi/18652047的Dau c 1.0201蛋白。同样的,与ASPR-C-2相匹配的除了与ASPR-C-1相似的major allergen isoform Dau c 1.0201蛋白外,还有来自芹菜Apium graveolens的分子量为17 079 Da、得分为102、登录号为gi/14423646的Api g 1蛋白和同样来自Apium graveolens、登录号为gi/1769847的Api g 1.0201。这些蛋白均属于PR-10家族蛋白。由此可知ASPR-C-1和ASPR-C-2均为PR-10类蛋白,是当归PR-10蛋白的两个亚型。
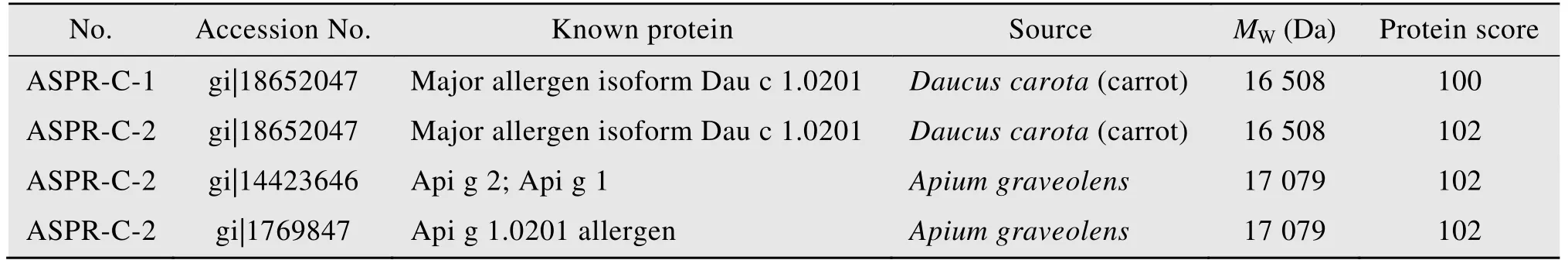
表2 ASPR-C-1和 ASPR-C-2质谱分析结果Table 2 Mass spectrometry analysis results of ASPR-C-1 and ASPR-C-2
2.4 ASPR-C-1和ASPR-C-2的酶学性质研究
2.4.1 反应pH的影响
图4所示的pH-活性曲线的结果表明,ASPR-C-1在pH 5.8左右相对酶活性最高,在pH 4.0–5.8之间,该酶相对酶活性随pH的增加而快速增加,pH 5.8–7.0之间,该酶相对酶活性随pH的增加反而急剧减少,当pH<4.0或pH>7.0时,其活性变化缓慢,该酶的相对酶活性均不到30%。反应pH 对ASPR-C-2核糖核酸酶活性的影响与ASPR-C-1的相似,但ASPR-C-2的最适反应pH为5.5。
2.4.2 反应温度的影响
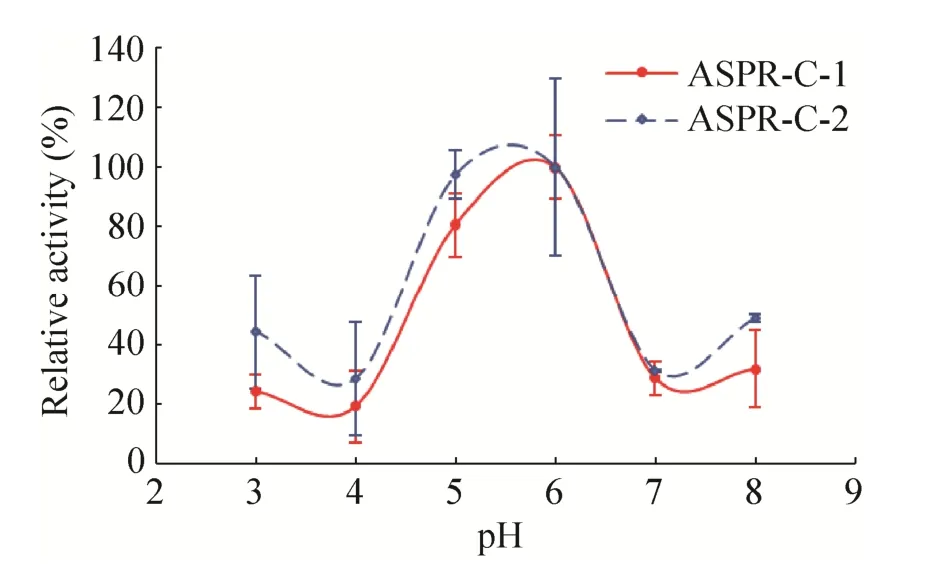
图4 两种蛋白亚型核糖核酸酶活性的最适pHFig.4 The optimum pH of the ribonuclease activity of two isoforms.
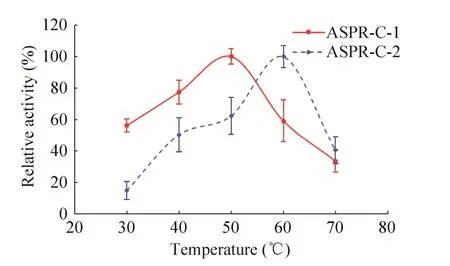
图5 两种蛋白亚型核糖核酸酶活性的最适温度Fig.5 The optimum temperature of the ribonuclease activity of two isoforms.
分别在最适pH的条件下进一步研究反应温度对两种蛋白核糖核酸酶活性的影响,结果如图5所示。当反应温度为30–50 ℃时,ASPR-C-1的相对酶活性随反应温度的增高而增加,当反应温度达到50 ℃时,该酶的相对酶活性最高,当反应温度继续增大时,ASPR-C-1的相对酶活性反而随着温度的增高而降低。ASPR-C-2酶活性的最适反应温度为60 ℃,反应温度低于或高于60 ℃都会使其相对酶活性下降。
2.4.3 温度稳定性研究
在两种蛋白的最适pH与最适温度下,两种蛋白的核糖核酸酶活性的热稳定性如图6所示。实验结果表明,两种蛋白在60 ℃下均有最佳的稳定性。其中ASPR-C-1在30–70 ℃保持15 min后剩余酶活性均大于50%,但是当温度超过70 ℃后,剩余酶活力急剧下降,表明ASPR-C-1在30–70 ℃时有较好的热稳定性;而ASPR-C-2在20–100 ℃保持15 min后剩余酶活性均大于50%,且在50–100 ℃的剩余酶活力均大于80%,表明ASPR-C-2在20–100 ℃时有较好的热稳定性活性。比较二者而言,ASPR-C-2具有良好的热稳定性,100 ℃处理后仍余80%以上活力。
2.4.4 金属离子、螯合剂、表面活性剂和还原剂等对ASPR-C-1和ASPR-C-2酶活性的影响
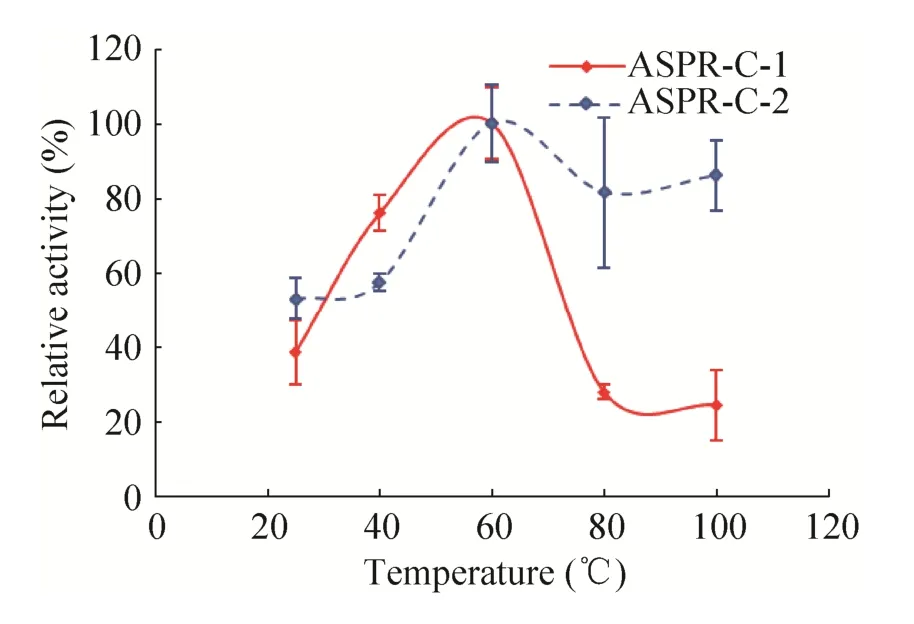
图6 两种蛋白亚型核糖核酸酶的热稳定性Fig.6 The thermal stability of the ribonuclease activity of two isoforms.
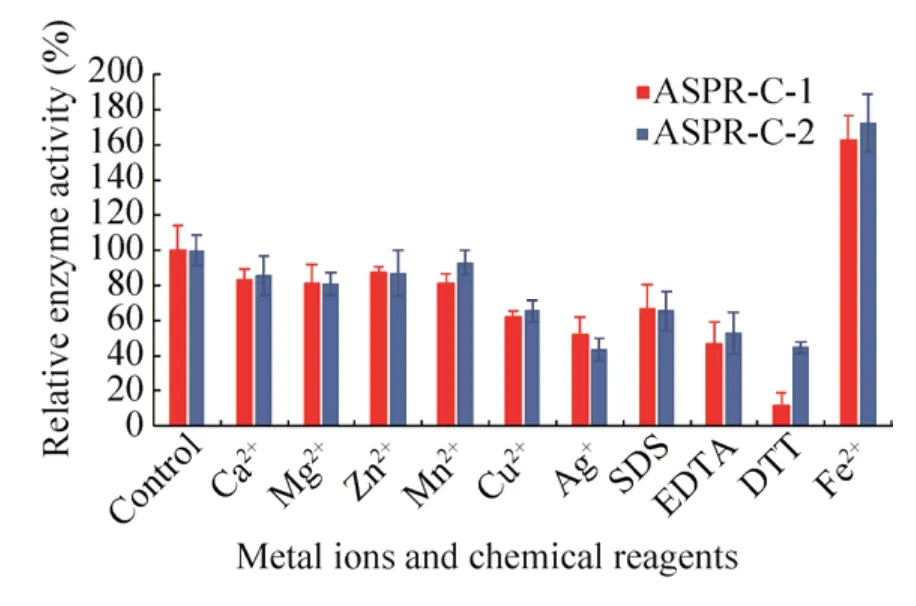
图7 金属离子、螯合剂、表面活性剂和还原剂等对ASPR-C-1和ASPR-C-2酶活性的影响Fig.7 Influence of metal ions, chelating agent,surfactant and protein reducing agent on ribonuclease activity of ASPR-C-1 and ASPR-C-2.EDTA: elhylene diamine tetraacetic acid; SDS: sodium dodecylsulphate;DTT: dithiothreitol.
如图7所示,Fe2+对ASPR-C-1和ASPR-C-2的核糖核酸酶活性有激活作用,分别使ASPR-C-1和ASPR-C-2的相对酶活性提高近60%和70%。而Ca2+、Mg2+、Zn2+、Mn2+对二者的酶活性显示轻微抑制作用,二者在这四种离子下相对酶活性均保留在80%以上。但二者的酶活性受Ag+、Cu2+、EDTA和SDS的抑制程度较强,特别是ASPR-C-1在有DTT存在下相对酶活性仅剩15%,而ASPR-C-2有50%的酶活性残留。
3 讨论
本研究中通过硫酸铵一步沉淀 (0–80%)、Sephadex G-50凝胶过滤层析和DEAE-Sepharose阴离子交换柱三步纯化从当归生药中分离纯化得到ASPR-C-1和ASPR-C-2两种蛋白,经质谱测序鉴定均为PR-10类蛋白,得率分别为16.44%和39.13% (图1,图2,表1)。两种蛋白在SDS-PAGE中分子量分别为17.33 kDa (ASPR-C-1)和17.18 kDa(ASPR-C-2) (图3A),与已报道的大多数PR-10蛋白的分子量相似[21-26]。
PR-10蛋白通常以单体形式存在,但也有一些例外。例如豆薯Pachyrrhizus erosus中的PR-10蛋白质 SPE-16[27]、黄芪 AmPR-10[26]和绿豆CSBP[28]在溶液中均为同二聚体,人参PgPR-10.1和PgPR-10.2蛋白在溶液中既能以同二聚体形式存在,又能因为相互作用彼此间形成异二聚体[29],桦树花粉过敏原Bet v 1在溶液中则既以单体存在又能形成二聚体[30]。
由于凝胶过滤层析Sephadex G-50分级分离的范围为1.5–30 kDa,本研究中所得的G-50第二峰中的蛋白分子量应低于30 kDa,但最终该峰中除了存在17 kDa左右的蛋白还存在35 kDa左右的蛋白 (图1B),由于后者的分子量为前者的两倍,可知后者应该为前者在溶液中形成的二聚体。最终纯化得到的蛋白的SDS-PAGE分析结果(图3B) 也证实了这一点,两种当归生药PR-10蛋白在溶液中的存在形式与桦树花粉过敏原Bet v 1类似,在溶液中主要以单体形式存在,但会部分形成二聚体[30]。
在已发现的植物PR-10家族的蛋白中具有糖基化的只有黄芪AmPR-10,糖基含量为13.7%[26],本课题组发现,源于当归的PR-10蛋白也是糖蛋白,且源于当归生药的两种PR-10蛋白 (糖基含量分别为2.6%和8.2%) 比鲜根中的PR-10蛋白[17]糖基含量高。
PR-10家族蛋白具有多种功能,其中核糖核酸酶活力是许多PR-10蛋白共同具有的生物学功能,例如黄芪AmPR-10[24]、羽扇豆根LaPR-10[8]、棉花GaPR-10[23]、豆薯中的 SPE16[24-27]、辣椒CaPR-10[25]等均具有核糖核酸酶活性。本研究纯化得到的两种当归生药PR-10蛋白也具有核糖核酸酶活性,与同为糖基化蛋白的黄芪AmPR-10蛋白 (74.11 U/mg)[22]相比,ASPR-C-1的比活(73.60 U/mg) 与之相当,ASPR-C-2的比活(146.76 U/mg) 是其近2倍 (表1)。当归生药PR-10蛋白也比当归鲜根中的PR-10蛋白具有更高的核糖核酸酶活性。当归生药PR-10蛋白核糖核酸酶活性的最适pH相近,均为5.6左右,但二者的最适温度不同,ASPR-C-1的为50 ℃,ASPR-C-2的为60 ℃ (图4,图5)。与ASPR-C-1以及当归鲜根中的PR-10蛋白[17]相比,当归生药中的ASPR-C-2具有最佳的耐热性能,在50–100 ℃热处理后的剩余酶活力均大于80% (图6)。
不同金属离子、螯合剂和表面活性剂、还原剂对PR-10蛋白的核糖核酸酶的影响有显著差异。有研究表明Ca2+、Mg2+、Zn2+、Mn2+、EDTA、Cu2+、Ag+和SDS对玉米Zm PR10和Zm PR10.1有轻微的抑制活性[31],但Cu2+、Ag+对黄芪AmPR-10有强烈的抑制活性[26]。在本研究中,Ca2+、Mg2+、Zn2+、Mn2+对二者的活性都轻微抑制作用,Cu2+、Ag+、EDTA、DTT和SDS对二者酶活性的抑制程度较强。而Fe2+对二者的核糖核酸酶活性有明显的激活作用 (图7)。
当归中不同PR-10蛋白PR-10蛋白核糖核酸酶活性的酶学参数及稳定性的差异可能源于二者不同的氨基酸组成及糖基含量。未来将进一步测定当归中不同PR-10蛋白的全序列、三维结构及生物学功能,以进一步揭示当归中不同PR-10蛋白之间的结构与功能的异同点。
