弱化呼吸链水平对代谢工程大肠杆菌聚羟基丁酸乳酸酯合成的影响
2019-01-30陆静娴李志敏叶勤吴辉
陆静娴,李志敏,叶勤,吴辉
华东理工大学 生物反应器工程国家重点实验室,上海 200237
石化基聚合物塑料的生产需要消耗不可再生资源,在生产和焚烧过程中排放温室气体,降解困难,存在诸多的资源和环境问题。生物基聚合物采用生物发酵可再生资源的生产方式,且能自然降解,给上述问题的解决提供了有效的途径,在国内外引起了广泛关注[1-4]。聚3-羟基丁酸乳酸酯[P(3HB-co-LA)]是聚羟基脂肪酸酯(PHA)家族的一员。P(3HB-co-LA)的机械性能和物理性能与常规塑料类似,并具有很多优点,如良好的生物降解性、生物相容性和低毒性,可用于生物医学、食品及日常用的高价值材料[5-9]。P(3HB-co-LA)的聚合单体来源于3-羟基丁酸和乳酸。作为共聚物,P(3HB-co-LA)与刚性的聚乳酸(PLA)[10]、不透明且呈脆性的聚3-羟基丁酸(PHB)均聚物相比,弹性和透明度更优。这意味着P(3HB-co-LA)具有更广阔的应用前景[11-12]。
2008年Taguchi等[13]首次在大肠杆菌中成功合成聚羟基丁酸乳酸酯[P(3HB-co-LA)],其中聚合物的乳酸组分的摩尔百分比为6%。为了提高聚合物中乳酸的含量,Yamada等[14]通过厌氧发酵,将聚合物中乳酸组分的摩尔百分比提高至47%。厌氧培养可以有效积累乳酸,但厌氧培养严重阻碍了菌体的生长,同时阻碍菌体中聚合物的积累,因此聚合物含量仅为2 wt%。同年Yang等[15]通过易错PCR和饱和突变分别增加了Pctcp对乳酸的底物特异性,以及PhaC1PS6-19对2-羟基丙酰CoA的底物特异性,在添加前体3HB的情况下生产出乳酸组分的摩尔百分比达49%,聚合物含量为53.5 wt%的P(3HB-co-LA)。
P(3HB-co-LA)中乳酸组分的摩尔百分比的限制条件之一是胞内乳酸的生产水平。为了在有氧条件下增加乳酸的积累,需要弱化呼吸链水平。Wu等[16]通过敲除辅酶Q8生物合成途径中的UbiX,引入辅酶Q8合成的底物竞争途径,减弱呼吸链关键成分辅酶Q8的合成,降低呼吸链活性,进而在有氧发酵中实现乳酸积累。本研究采用此调控新策略,通过减弱呼吸链强度来营造细胞微耗氧能力,希望实现在提高共聚物P(3HB-co-LA)的聚合前体乳酸浓度的同时,减弱厌氧环境对细胞生长和聚合物合成造成的影响。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
研究所使用的菌株和质粒见表1,质粒构建和基因敲除所使用的引物见表2。
1.1.2 试剂
高保真PCR酶primerstar、高保真T4-DNA连接酶、DNA Marker、限制性内切酶EcoRⅠ、SacⅠ和BamHⅠ酶,均购自TaKaRa公司;CloneExpress®MultiS One Step Cloning Kit 试剂盒购自诺唯赞公司;异丙基-β-D-硫代吡喃半乳糖苷、L-阿拉伯糖、氨苄青霉素、氯霉素等购自捷贝思基因技术有限公司;琼脂糖购自阿拉丁试剂公司;胶回收试剂盒,质粒小提试剂盒等购自生工生物工程公司;三氯甲烷、甲醇购自国药集团。

表1 本文中所用到的质粒和菌株Table 1 Plasmids and strains used in this study
1.1.3 培养基
种子培养基 (LB液体培养基) 每升含:酵母提取物5 g,胰蛋白胨10 g,氯化钠10 g,根据需要加入氨苄青霉素100 mg和氯霉素 34 mg。
发酵培养基 (M9培养基) 每升含:葡萄糖20g,Na2HPO4·12H2O 15.1 g,KH2PO43.0g,NaCl 0.5g,NH4Cl 1.0 g,MgSO4·7H2O 0.5 g,CaCl20.011 g,vitamin B110 mg和微量元素储存液0.1 mL。按需加入氨苄青霉素100 mg和氯霉素34 mg。不添加乳酸。微量元素储存液每升含有FeSO4·7H2O 80 g,AlCl3·6H2O10 g,ZnSO4·7H2O2.0g,CuCl2·2H2O 1.0 g,NaMoO4·2H2O2.0 g,MnSO4·H2O 10g,CoCl24.0g,H3BO40.5g。
1.2 方法
1.2.1 重组菌的构建
通过基于λ-red 重组系统介导的PCR 产物一步法[17]敲除E.coliMG1655中的ubiX基因,得到单缺失菌JX04。在单缺失菌JX04的基础上敲除dld基因,得到双缺失菌JX041。为了增加PHA合成酶(PhaC)对2-羟基丙酰CoA的聚合能力,需要对PhaC设计氨基酸突变。通过与Taguchi等[13]和Yang等[15]研究中使用的PhaC突变体进行氨基酸序列比对,本实验中荧光假单胞菌Pseudomonas fluorescensstrain 2P24来源的PhaCm的3个氨基酸突变位点分别设计为E130D、S325T、Q481K。突变体phaCm基因由生工生物工程公司经过密码子优化合成。
phaA基因通过酶切位点EcoRⅠ和SacⅠ酶切连接到pTrc99a上,phaB基因通过诺唯赞公司的Clone Express®MultiS One Step Cloning Kit试剂盒连接到pTrc99a上,phaCm基因通过酶切位点BamHⅠ和HindⅢ酶切连接到pTrc99a上,这3个基因串联构建了质粒pTrc99aABC。突变体pctth基因来源于丙酸梭菌Clostridium propionicumDSM 1682,包含1个氨基酸突变V193A和4个沉默突变 (T78C,T669C,A1125G,T1158C),通过SacⅠ和SmaⅠ位点酶切连接到pBAD33质粒上,将其命名为pBADpctth。

表2 本文中所用到的引物Table 2 Primers used in this study
1.2.2 摇瓶发酵
重组菌在含有100 mg/L的氨苄青霉素和34 mg/L的氯霉素的LB培养基中37 ℃、220 r/min过夜培养。随后按1%(V/V)的接种量转入M9培养基中,250 mL摇瓶的装液量为50 mL,在培养温度为30 ℃,转速为220 r/min的条件下,发酵培养48 h,并加不同浓度的IPTG和L-阿拉伯糖诱导。取样时间点为0、12、24、36、48 h。所有的摇瓶发酵设置3个平行,最终结果为3个平行的平均值。
1.2.3 HPLC分析
发酵过程中葡萄糖、乳酸、乙酸的浓度用HPLC测定。将–20 ℃冻存的上清液常温解冻后稀释,用0.22 μm的水相微孔滤膜过滤。检测条件如下:流动相为2.5 mmol/L稀硫酸,色谱柱为Aminex HPX-87H (Bio-Rad,USA),流速0.5 mL/min,柱温50 ℃,进样量20 μL,检测器为示差检测器。通过与葡萄糖、乳酸、乙酸标样的标准曲线比对,得出发酵过程中葡萄糖、乳酸、乙酸的代谢情况。
1.2.4 聚合物的萃取和分析
用于气相检测的样品处理方法:将发酵液冷冻干燥2 d后,称取约15 mg干菌体,加入1.5 mL氯仿和1.5 mL酯化液 (85 wt%甲醇,15 wt%硫酸,1 g/L苯甲酸) 100 ℃恒温萃取4 h。冷却后,加入750 mL的去离子水,旋涡振荡2 min,3 000 r/min低速离心3 min。取下层 (氯仿层),经无水硫酸钠干燥后,用0.22 μm的有机相微孔滤膜过滤。D-乳酸和3HB标样用同样的方法处理[18]。
细胞中聚合物的含量和单体组成通过GC-2014气相色谱仪 (岛津,日本) 测定。色谱柱为rx-5毛细管柱,长30 m,内径0.25 mm。检测器为火焰离子化检测器。使用高纯氮气为载气,氢气为燃气,空气为助燃气。使用AOC-20S型自动化进样器,乙醇作为清洗剂。GC分析程序为:开始时于54 ℃停留4 min,再以5 ℃/min的速度升温至125 ℃,随后以20 °C/min的速度升温至180 ℃。
2 结果与分析
2.1 聚羟基丁酸乳酸酯合成途径的打通
聚羟基丁酸乳酸酯[P(3HB-co-LA)]的前体为2-羟基丙酰CoA和3-羟基丁酰CoA。其中2-羟基丙酰CoA由乳酸和乙酰CoA经过丙酰CoA转移酶突变体 (Pctth) 催化合成,3-羟基丁酰CoA是由乙酰CoA,通过来源于罗尔斯通氏菌Ralstonia eutropha的β-酮基硫解酶 (PhaA) 和NADPH依赖的乙酰乙酰CoA还原酶 (PhaB),经过两步催化转化而成。这两个前体经过来源于Pseudomonas fluorescensstrain 2P24的PHA合成酶突变体(PhaCm) 的聚合形成共聚物,聚合物的代谢途径如图1A所示。通过pTrc99a质粒表达phaA、phaB和phaCm,构建质粒pTrc99aABC。通过pBAD33质粒表达pctth,构建质粒 pBADpctth。质粒pTrc99aABC和pBADpctth的构建如图1B所示。
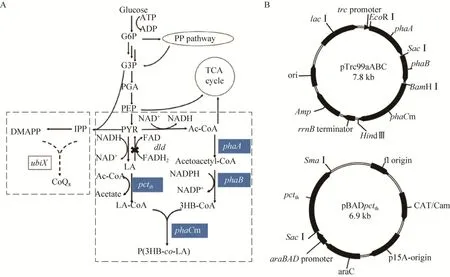
图1 代谢工程大肠杆菌中P(3HB-co-LA) 合成途径 (A) 和重组质粒pTrc99aABC、pBADpctth构建图 (B)Fig.1 Poly(3-hydroxybutyrate-co-lactate) synthesis pathway in metabolically engineered E.coli (A) and construction of recombinant plasmids pTrc99aABC and pBADpctth (B).The genes shown are as follows: phaA, β-ketothiolase; pctth,evolved propionyl-CoA transferase; phaB, NADPH-dependent acetoacetyl-CoA reductase; phaCm, evolved polyhydroxyalkanoate synthase; ubiX, flavin prenyltransferase; dld, D-lactate dehydrogenase; idi, IPP isomerase.Metabolites shown are as follows: G6P, glucose 6-phosphate; G3P, glyceraldehyde 3-phosphate; PGA,3-phosphoglycerate; PEP, phosphoenolpyruvate; PYR, pyruvate; LA, lactate; LA-CoA, lactyl-CoA; Ac-CoA,acetyl-CoA; IPP, isopentenyl diphosphate; DMAPP, dimethylallyl diphosphate.
将带有pTrc99aABC和pBADpctth的重组大肠杆菌命名为MG-01,将携带pTrc99aABC和pBAD33质粒的重组大肠杆菌命名为MG-C。其中,MG-C不携带pctth基因,为对照菌株。气相结果显示,在培养基中不添加乳酸的条件下,不含pctth基因的MG-C菌株发酵生产的聚合物中不含乳酸组分,即生产的是均聚物PHB。而使用MG-01菌株时,聚合物中有乳酸组分出现,聚合物中乳酸组分的摩尔百分比达到1.6%,聚合物含量为83.9 wt%。这表明pctth具有合成2-羟基丙酰CoA的能力。因此通过引入外源的phaA、phaB、pctth和phaCm,我们成功地在大肠杆菌中建立起了聚羟基丁酸乳酸酯合成途径。
2.2 调节P(3HB-co-LA)合成途径对聚合物中乳酸单体含量的影响
2.2.1 不同强度Pctth酶表达的影响
虽然以上实验可得到共聚物,但聚合物中乳酸组分的摩尔百分比较低,仅为1.6%,因此推测可能是由于PHA的底物2-羟基丙酰CoA的浓度较低造成的。由图1可知,在胞内积累2-羟基丙酰CoA,最直接的方法就是增强催化乳酸转化为2-羟基丙酰CoA的Pctth酶的催化活性。
合适的蛋白折叠是发挥酶生物活性的重要因素,而诱导剂浓度是影响蛋白折叠的重要因素之一[19]。因此,通过设置诱导剂L-阿拉伯糖的浓度梯度来优化Pctth酶的表达。如图2所示,当诱导剂L-阿拉伯糖的浓度从10 mmol/L上升到50 mmol/L时,聚合物中乳酸组分的摩尔百分比也由1.9%上升至4.0%。而pctth基因表达的增强对聚合物在细胞中的含量影响不大,聚合物含量维持在79 wt%到84 wt%之间。当诱导剂L-阿拉伯糖浓度高于40 mmol/L时,聚合物中乳酸含量增加不明显。这可能是因为尽管随着诱导剂浓度增加,阿拉伯糖启动子达到诱导极限,Pctth酶的蛋白表达量几乎无变化;或者,由于底物乳酸或者辅酶A供应的限制,聚合物中乳酸的摩尔百分比无法得到提高。基于实验结果,50 mmol/L的L-阿拉伯糖进行下一步实验。
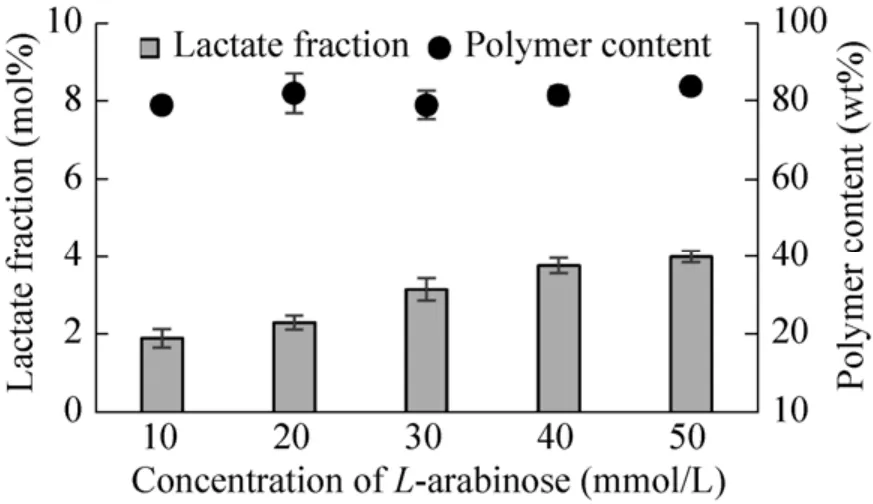
图2 L-arabinose浓度梯度下聚合物含量及聚合物中LA含量的变化Fig.2 Content changes of polymer and LA fraction with different L-arabinose concentrations.
2.2.2 不同强度PHA合成途径的影响
在聚合物的合成过程中,胞内的乙酰CoA既是合成3HB-CoA的底物,又是2-羟基丙酰CoA的辅酶A供体,即2-羟基丙酰CoA的积累与3HB-CoA的生成存在竞争关系。因此,提高2-羟基丙酰CoA的供应需要减弱3HB-CoA的生产。但另一方面,3HB-CoA是P(3HB-co-LA)聚酯合成的引发剂,是其合成所必需的[20],若胞内3HB-CoA的含量太低,不利于聚合物的合成。为了平衡这一矛盾,需要选出合适的IPTG浓度来诱导聚合途径。
如图3所示,当IPTG浓度为0.01 mmol/L和0.02 mmol/L时,聚合物中乳酸组分的摩尔百分比均低于1%。这表明当IPTG浓度过低时,PHA聚合酶接受底物2-羟基丙酰CoA的效率降低,这同样影响了聚合物中乳酸组分的摩尔百分比。当IPTG浓度为0.05 mmol/L时,聚合物中乳酸组分的摩尔百分比提高到4.2%。当IPTG浓度为0.1 mmol/L时,聚合物中乳酸组分的摩尔百分比达到峰值5.1%,此时聚合物占细胞干重的比例也达到最小值76.2 wt%。当IPTG浓度高于0.1 mmol/L,聚合物中的乳酸组分的摩尔百分比略有下降。根据实验结果,选用0.1 mmol/L的IPTG进行下一步实验。
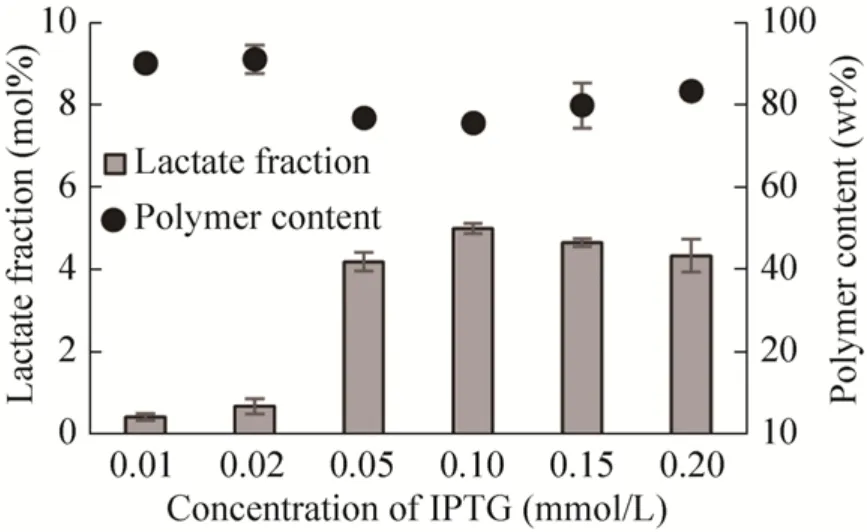
图3 IPTG浓度梯度下聚合物含量及聚合物中乳酸含量的变化Fig.3 Content changes of polymer and LA fraction with different IPTG concentrations.
2.3 呼吸链弱化对聚合物合成前体供应的影响
提高P(3HB-co-LA) 中乳酸单体含量的另一策略是增强胞内乳酸的积累。针对重组大肠杆菌MG-01进行了不同装液量 (50、75和100 mL) 的摇瓶 (250 mL) 发酵实验,结果表明乳酸积累的峰值会随着装液量的增加而提高,但会造成较高浓度的乙酸的积累,这会使菌体干重和聚合物含量的下降,从而影响聚合物产量。与此同时,Yamada等[14]在厌氧条件下发酵生产P(3HB-co-LA)的实验证明了通氧量降低对菌体生长的影响。Wu等[16]的调控策略表明通过弱化呼吸链水平可以有效积累乳酸,同时减少对菌体生长的影响。辅酶Q8是呼吸链的重要组成,通过减弱辅酶Q8的生成,可以弱化呼吸链水平。在大肠杆菌中,UbiX和UbiD是一对同工酶,共同参与辅酶Q8生物合成的初期阶段,将4-羟基-3-辛酰基苯甲酸 (HP8B)转换为2-辛酰基苯酚。通过ubiD或ubiX基因的单缺失可以将大肠杆菌中的Q8含量减少至野生型的20%–25%。因此文中构建了ubiX基因缺失的突变株JX04 (图4),拟通过此策略部分降低辅酶Q8的合成,从而减弱突变株的呼吸链强度。
Choi等[21]发现,在接近发酵后期时,D-乳酸的浓度减少,这是由于dld基因编码的D-乳酸脱氢酶将D-乳酸反转为丙酮酸。为了消除这一现象对聚合物中乳酸组分的摩尔百分比的影响,如图4所示,我们在JX04中进一步敲除D-乳酸脱氢酶基因,得到双缺失菌,将其命名为JX041。
在添加了20 g/L葡萄糖的M9培养基中摇瓶培养36 h以观察野生菌和缺失菌的生长和乳酸积累情况。如图5A所示,与MG1655相比,单缺失菌JX04和双缺失菌JX041的生长都有所放缓,这是由于弱化呼吸链造成的生长迟缓。最终,单缺失菌和双缺失菌的干重均能达到野生型水平。JX04和JX041消耗的葡萄糖与MG1655相近,MG1655积累较多的乙酸,而JX04和JX041中乳酸的积累量较多,整体pH变化相似。由于聚合途径未引入,细胞没有蛋白过表达及聚合物合成的代谢负担,因此弱化呼吸链只造成生长迟缓,但未影响到最终的细胞浓度。
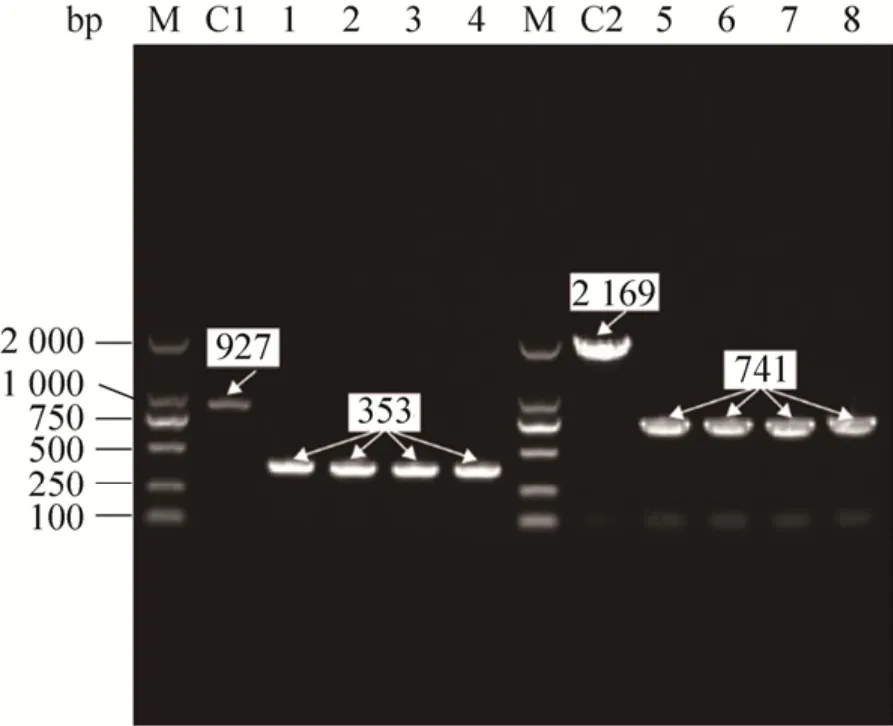
图4 ubiX、dld基因敲除菌落PCR验证电泳图Fig.4 Agarose gel electrophoresis of PCR identification of ubiX knockout in MG1655 and dld knockout in MG1655ΔubiX.M: marker; C1: MG1655 control group; C2: MG1655ΔubiX control group; 1–4:MG1655ΔubiX; 5–8: MG1655ΔubiXΔdld.
三种宿主菌的乳酸积累如图5C所示,JX04和MG1655的乳酸积累均在摇瓶培养的15 h左右达到峰值。其中,单缺失菌JX04的乳酸峰值为0.21 g/L,是野生型MG1655的2倍。这表明弱化呼吸链可以有效积累乳酸。与野生型和单缺失菌不同,双缺失菌JX041在摇瓶培养后期的乳酸浓度呈上升状态,摇瓶培养终点时乳酸积累达0.28 g/L。这表明D-乳酸脱氢酶基因的敲除有效抑制了乳酸在发酵后期的利用。值得一提的是,在摇瓶培养结束时,两种缺失菌积累的乙酸含量均为0.8 g/L,是野生型的61.5%。这表明,敲除ubiX基因在有效积累乳酸的同时,减少了乙酸副产物的生成。即碳代谢流由积累乙酸的方向转向生成乳酸的方向。
2.4 弱化呼吸链水平对聚羟基丁酸乳酸酯合成的影响
将包含了pTrc99aABC和pBADpctth质粒的野生菌、单缺失菌和双缺失菌分别命名为MG-01、JX04-01和JX041-01。在M9培养基中添加0.1 mmol/L IPTG、50 mmol/LL-阿拉伯糖和20 g/L葡萄糖,摇瓶发酵培养48 h,以评价重组菌的性能。生长方面,如图6A所示,单缺失菌JX04-01菌体干重为2.5 g/L,双缺失菌JX041-01菌体的干重为2.6 g/L,分别为MG-01的62.5%和65.0%。菌体干重的差异一方面可能是由于加入双质粒后,外源聚合途径的引入以及聚合物合成所需要的底物和能量使细胞代谢负担加大,弱化呼吸链造成的细胞能量差别效应也随之加大,导致了JX04-01和JX041-01生长受到一定的限制。另一方面,大肠杆菌代谢过程中,副产物乙酸的积累会严重影响重组大肠杆菌的蛋白合成与生长。MG-01在聚合物生产过程中积累的乙酸被重新利用,在发酵后期乙酸浓度降低为0 g/L。与缺失菌相比,MG-01在发酵过程中可以保持较低的乙酸浓度和更适宜的pH值,因此其菌体干重高于JX04-01和JX041-01。乳酸积累方面,如图6C所示,加入双质粒后,双缺失菌JX041-01的乳酸积累在发酵后期可达1.1 g/L。
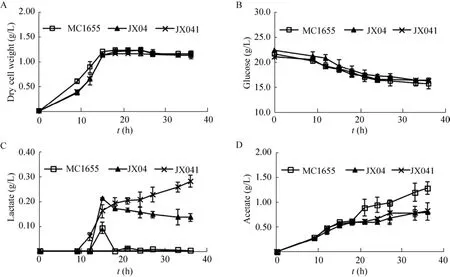
图5 三种宿主菌的生长和代谢Fig.5 Time-courses of cell density (A), glucose (B), lactate (C), and acetate (D) for three different host strains.
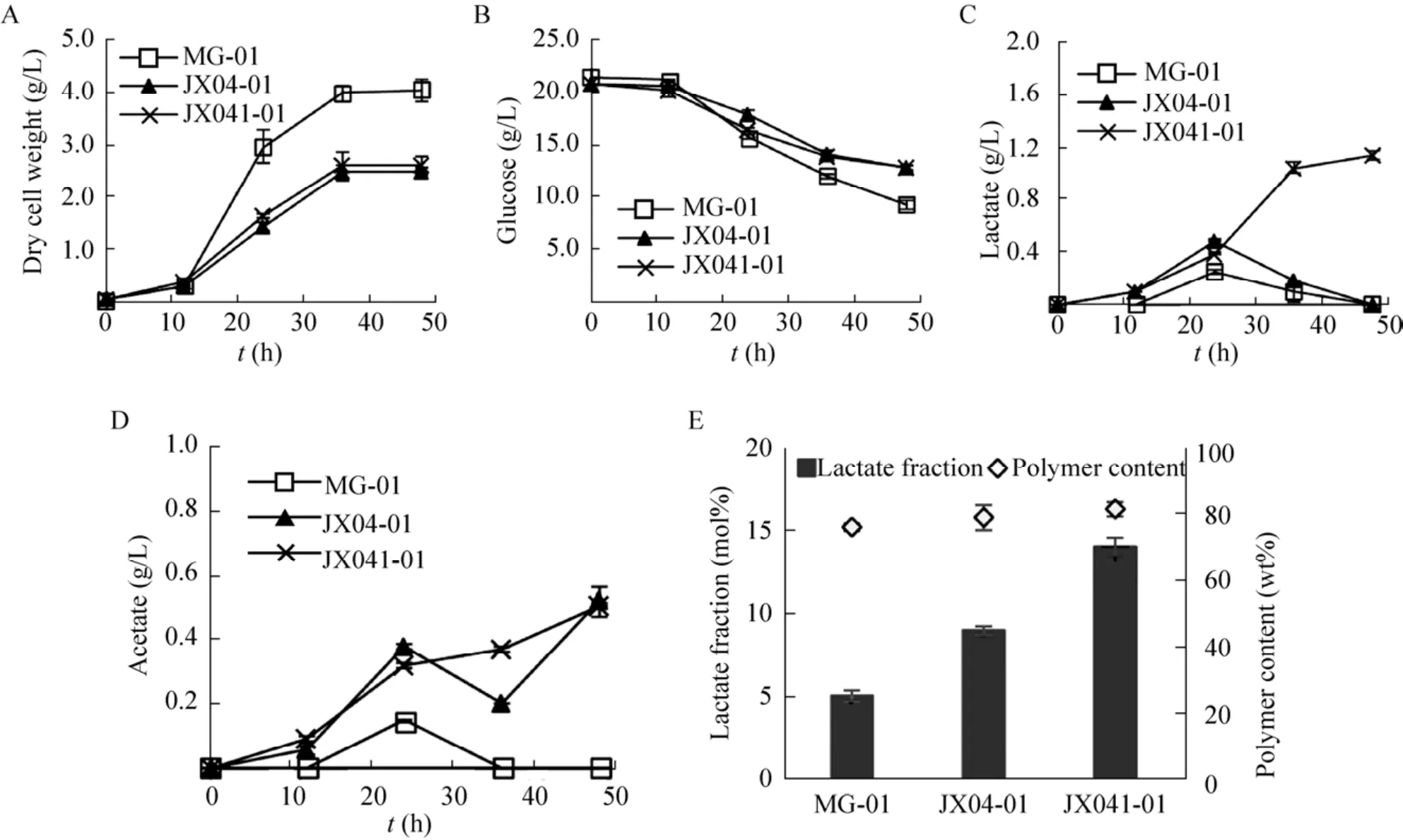
图6 3种重组菌的生长、代谢和聚合物生产情况Fig.6 Time-courses of cell density (A), glucose (B), lactate (C), acetate (D) and polymer production (E) for three recombinant strains.
聚合物生产方面,如图6E所示,在单缺失菌JX04-01中生产P(3HB-co-LA),乳酸组分的摩尔百分比可由5.1%提高至9.1%。在双缺失菌中,共聚物中的乳酸组分的摩尔百分比可进一步提高至14.1%,是野生型中的2.8倍。这表明,胞内乳酸含量的积累有益于提高聚合物中乳酸组分的摩尔百分比。胞内的聚合物含量在3种重组菌中无明显变化,保持在76.3 wt%–81.7 wt%之间。同时在双缺失菌中,聚合物产量可达到2.1 g/L,为野生型的68.9%。实验结果表明,弱化呼吸链水平同时敲除dld基因的策略可有效提高聚合物中乳酸组分的摩尔百分比,聚合物在胞内的含量无明显变化。
3 结论
本研究通过在大肠杆菌中过表达β-酮硫解酶、乙酰乙酰CoA还原酶、丙酰CoA转移酶突变体和PHA合成酶突变体,实现了由葡萄糖一步法合成P(3HB-co-LA)。在最初合成的聚合物中,乳酸组分的摩尔百分比仅为1.6%,为了提高共聚物中乳酸的含量,通过增加L-阿拉伯糖浓度来增强Pctth酶的表达,通过设置较低的IPTG浓度梯度,在限制碳代谢流流向3HB-CoA方向的同时维持PHA聚合酶的表达,从而将聚合物中乳酸组分的摩尔百分比提高到5.1%,此时聚合物含量为76.2 wt%。
呼吸链中辅酶Q8量的变化能够引起整个代谢流的重新分配。在敲除黄素异戊烯基转移酶基因 (ubiX) 后,辅酶Q8的生物合成部分受阻,碳代谢流向乳酸方向积累。聚合物中乳酸组分的摩尔百分比提高到9.1%。在此基础上进一步敲除D-乳酸脱氢酶基因 (dld),减少了乳酸在发酵后期催化成丙酮酸,聚合物中的乳酸组分的摩尔百分比提高到14.1%,聚合物含量可达81.7 wt%,聚合物产量为2.1 g/L。实验结果表明,弱化呼吸链水平可有效提高P(3HB-co-LA) 中乳酸组分的摩尔百分比。
致 谢清华大学陈国强教授为本研究提供丙酰CoA转移酶突变体基因(pctth),在此表示衷心的感谢!
