H5亚型流感病毒HA头部球状结构域在毕赤酵母中的高效表达及其免疫原性分析
2019-01-30范文辉王萌刘丽蓉张鹤张爽凌红丽刘文军李晶
范文辉,王萌,2,刘丽蓉,2,张鹤,张爽,凌红丽,刘文军,2,李晶,2
1 中国科学院微生物研究所 中国科学院病原微生物与免疫学重点实验室,北京 100101
2 中国科学院大学,北京 100049
3 青岛蔚蓝生物制品有限公司,山东 青岛 266114
流感病毒 (Influenza virus) 属于正粘病毒科,是单股负链分节段的RNA病毒。根据核蛋白(NP) 和基质蛋白 (M1) 上抗原决定簇的不同,流感病毒可分为A、B、C、D四型[1-3],其中A型和B型可给人类的健康带来威胁,尤其是A型,每年因全球季节性流感和散发性流感而导致大约30万–50万人死亡,死亡率高达60%[4-5]。除了感染人类外,A型流感病毒还可以引起禽类、猪及其他哺乳动物流感的发生[6]。在鸡群中流行的A型流感病毒包括H5N1、H5N2、H7N9及H9N2等亚型,其中,H5N1和H7N9已引起了全世界的关注,因为这些亚型不但可以引起人类感染发病并造成较高的死亡率,且有潜力发生变异,更容易出现跨物种传播[7]。根据流感病毒对禽类的致病力不同,可将其分为高致病性禽流感病毒 (HPAI)和低致病性禽流感病毒 (LPAI)[8]。1997年香港发生的直接由鸡群传染给人的高致病性禽流感,造成了18人感染6人死亡,其病原即为高致病性禽流感病毒 (H5N1亚型)[9-10]。最近,由HPAI导致的禽流感在韩国和日本也有发生,HPAI作为一种人畜共患病病原,不但给养殖业带来了巨大的经济损失,而且对人类的公共卫生安全也造成了严重的威胁[11],因此,对HPAI的防控显得尤为重要。
禽流感的防控一直是全世界关注的焦点,也是世界性难题。目前防治禽流感发生的主要手段为疫苗接种[12],常用的H5亚型流感疫苗为全病毒灭活疫苗,如我国市售的Re-1、Re-4、Re-5、Re-6、Re-7、Re-8和Re-10株等,但该类型的疫苗在生产过程中涉及到了活病毒的操作,所以存在生物安全风险。除此之外,还有重组活载体疫苗、DNA疫苗等,由于重组载体疫苗存在影响二次免疫,DNA疫苗免疫期长且需多次免疫,不适用于紧急预防,所以市场上未见大量应用,因此研发出新型高效的H5亚型亚单位疫苗已是迫在眉睫[13-14]。亚单位疫苗是利用微生物的某种表面结构成分 (抗原) 制成无核酸且能诱发机体产生抗体的疫苗,与常规疫苗相比生产简单、快速且安全[15]。HA蛋白是流感病毒表面的主要保护性抗原,也是研究亚单位疫苗的主要靶标抗原。研究人员认为HA蛋白头部球状结构是禽流感主要的保护性抗原。HA抗体滴度的高低从某种程度上能够反映机体对于禽流感病毒的抵抗力。随着基因工程技术的飞速发展,研究人员将HA基因克隆至真核表达载体上,转化至真核生物或细胞中进行表达。毕赤酵母表达系统具有蛋白翻译后的修饰功能,因此该系统已被广泛应用于异源蛋白的高效表达,表达产物具有良好的免疫原性[16]。
本研究利用毕赤酵母表达系统,将编码HA蛋白头部球状结构的基因插入至pPICZαA表达载体,并电击转化至毕赤酵母,筛选得到高效表达重组菌,然后进行发酵罐高密度发酵,浓缩纯化得到目的蛋白,加入佐剂,研制成亚单位疫苗进行免疫效果评价,为H5亚型流感的防控提供理论依据。
1 材料与方法
1.1 质粒、菌株及实验动物
大肠杆菌 TOP10、毕赤酵母X33菌株及pPICZαA 空载、MDCK细胞由本实验室保存,SPF鸡胚 (10日龄)、SPF鸡 (1日龄、21日龄) 购自 (北京) 梅里亚动物保健有限公司;5周龄雌性BALB/c小鼠、4月龄雌性日本大耳白兔购自 (北京) 梅里亚动物保健有限公司。
1.2 主要试剂
Pfu酶、Taq酶、限制性内切酶BamHⅠ、XhoⅠ、T4 DNA连接酶购自宝生物工程 (大连)有限公司;质粒提取试剂盒、BCA蛋白定量试剂盒、TMB底物显色液购自天根生化科技 (北京)有限公司;96孔酶标板购自上海源叶生物科技有限公司;Ni-NTA His Bind Resin购自北京全式金生物技术有限公司;蛋白预染 marker购自宝林科(北京) 生物科技有限公司;辣根过氧化物酶(HRP) 标记的羊抗鸡IgG购自达科为生物技术有限公司;小鼠抗6×His标签单克隆抗体购自博奥瑞京 (北京) 科技发展有限公司(Anti-His Tag Mouse Monoclonal Antibody,货号:ABI001t);白油购自郑州索飞经贸有限公司 (货号:VG5852674P);H5N1阳性血清及SPF鸡阴性血清购自哈尔滨维科生物技术开发公司。甲醇购自上海晶纯生化科技股份有限公司;市售疫苗为广东温氏大华农生物科技有限公司 (重组禽流感病毒灭活疫苗,H5N1亚型,Re-6株,批号:兽药临字190022297);所有引物均由深圳华大基因科技有限公司合成。
1.3 表达载体的构建
参照 GenBank (登录号 KC261467.1) 中H5N1亚型流感病毒血凝素基因的头部球状区序列 (60–300 aa),对其进行酵母表达密码子优化,使其利于在毕赤酵母中表达,将优化后的目的片段连入pPICZαA载体,获得重组质粒pPICZαA-H5HA。
1.4 重组质粒pPICZαA-H5HA线性化
将带有重组表达质粒pPICZαA-H5HA的大肠杆菌TOP10置于LB液体培养基中,培养12–15 h,提取pPICZαA-H5HA质粒。利用SacⅠ酶切pPICZαA-H5HA质粒使其线性化,获得线性化质粒。
1.5 毕赤酵母X33的电转化
向90 μL X33感受态细胞内加入10 μL线性化的pPICZαA-H5HA质粒,混匀后将其加入预冷的石英电转化杯中,冰浴5 min后放入电转仪的槽中进行电击转化。将转化后的混合液转入离心管后置于30 ℃孵箱中,静置1 h。然后将离心管中的混合液以2 500 r/min的转速离心2 min,用200 μL上清重悬细胞沉淀,然后将重悬细胞均匀涂布于含100 μg/mL Zeocin的YPDS平板上,30 ℃孵育3–5 d观察,挑取单菌落进行扩大培养、鉴定。
1.6 重组酵母的诱导表达和目的蛋白鉴定
将鉴定为阳性的菌液取500 μL加入到含25 mL BMGY培养基的250 mL摇瓶中,30 ℃、300 r/min培养至OD600为2–6。将培养液离心(5 min,3 000 r/min),弃上清,将菌体用15 mL BMMY重悬,调整OD600为1.0左右并将菌体转移至150 mL的摇瓶中,置于30 ℃、300 r/min条件下继续培养。每间隔24 h向培养基中添加100%的甲醇溶液至终浓度为0.5%–1.0%进行诱导。分别于诱导后0 h、24 h、48 h、72 h取样进行SDS-PAGE和Western blotting分析,鉴定目的蛋白表达情况及最佳诱导时间。
1.7 重组蛋白的纯化及候选疫苗制备
将发酵液以12 000 r/min离心10 min,去除上清中的杂质,然后用10 kDa的浓缩管进行浓缩。将浓缩后上清用镍柱进行亲和层析纯化,然后再利用Superdex 2000层析柱进行分子筛纯化,收集目的蛋白H5HA所在的洗脱峰,SDS-PAGE检测蛋白纯度。
将纯化后H5HA蛋白与白油混合:首先在H5HA蛋白中加入终浓度为4%的吐温-80,然后再加入等体积的白油,充分乳化制成候选疫苗LW001 (含20 μg/200 μL H5HA) 和候选疫苗LW002 (含50 μg/200 μL H5HA),用于注射免疫。将纯化后 H5HA 蛋白与寡聚脱氧核苷酸(CpG-ODNs)[17-18]混合,向每200 μL的H5HA蛋白中加入50 μg的CpG-ODNs,并将二者混合均匀后制成候选疫苗LW003 (含20 μg/200 μL H5HA)和候选疫苗LW004 (含50 μg/200 μL H5HA),用于滴鼻免疫。同时设置市售灭活疫苗及PBS阴性对照组。
1.8 SPF鸡免疫试验
将SPF鸡随机分为8组,每组6羽,试验分组见表1,初次免疫14 d后加强免疫1次,每羽鸡免疫剂量为200 μL。于14 d和28 d经翅静脉采血并分离得到血清,进行血凝抑制 (HI) 效价及ELISA效价检测。
1.9 间接ELISA检测血清IgG
用大肠杆菌表达的纯化后的H5HA蛋白作为包被抗原 (200 ng/孔,100 μL孔),pH 9.6的碳酸盐作为包被液,4 ℃过夜包被。包被后用洗涤液 (NaCl 8 g/L,KCl 0.2 g/L,Na2HPO4·12H2O 3.58 g/L,KH2PO40.24 g/L,Tween-20 0.05%,pH 7.2) 洗涤3次,之后每孔加入200 μL复合封闭液 (NaCl 8 g/L,KCl 0.2 g/L,Na2HPO4·12H2O 3.58 g/L,KH2PO40.24 g/L,山羊血清 50 mL/L,明胶溶液 5 mL/L,酪蛋白 2 g/L,蔗糖 10 g/L,pH 7.2),37 ℃封闭2 h后洗涤3次。加入用复合抗体稀释液 (NaCl 8 g/L,KCl 0.2 g/L,Na2HPO4·12H2O 3.58 g/L,KH2PO40.24 g/L,山羊血清 20 mL/L,酪蛋白1 g/L,蔗糖 5 g/L,吐温-20 0.05%,pH 7.2) 稀释的待检血清,每孔100 μL,37 ℃孵育1 h后洗涤。加入HRP标记的羊抗鸡IgG,每孔100 μL,37 ℃孵育1 h后洗涤5次。加入显色液和终止液。最后用酶标仪测定450 nm下的吸光值 (OD450值)。
1.10 血凝抑制试验
利用流感病毒血凝抑制试验方法[19],测定免疫后14 d及28 d血清中抗体效价,评价免疫效果。当被检血清HI效价大于等于4 log2时,可判定为H5亚型流感病毒抗体阳性。
1.11 动物安全性试验
选取1日龄雏鸡10羽,于腿部肌肉分别注射候选疫苗 (LW001和LW002) 0.1 mL;5周龄雌性BALB/c小鼠10只,于腿部肌肉分别注射候选疫苗0.1 mL (LW001和LW002);4月龄健康的雌性日本大耳白种兔6只,腿部肌肉注射候选疫苗0.4 mL (LW001和LW002);7日龄雏鸡10羽,滴鼻接种候选疫苗 (LW003和LW004) 0.1 mL;5周龄雌性BALB/c小鼠10只,滴鼻免疫候选疫苗0.1 mL (LW003和LW004);4月龄健康的雌性日本大耳白种兔6只,滴鼻免疫候选疫苗0.4 mL(LW003和LW004) 观察14 d,记录局部反应和临床症状。
1.12 血清-病毒中和试验
用含10%胎牛血清的DMEM将MDCK细胞分至96孔细胞培养板,100 μL/孔,5% CO2、37 ℃条件下培养至90%汇合度时待用;将SPF鸡血清于56 ℃灭活30 min,并进行2倍倍比稀释后与含100 TCID50H5N1流感病毒的无血清DMEM均匀混合后,37 ℃孵育1 h;弃去96孔板中细胞培养基,加入血清-病毒混合物100 μL/孔,置于培养箱中吸附1 h;弃去96孔板中的血清-病毒混合物,吸干各孔中的残留液后,加入含1% FBS的DMEM,培养3 d;然后于光学显微镜下观察细胞病变 (CPE),记录病变孔数目,运用Reed-Muench法计算中和抗体效价。H5亚型流感病毒强毒感染试验均在中国科学院武汉病毒研究所生物安全三级实验室操作。
2 结果与分析
2.1 融合HA基因的PCR扩增结果
将人工合成的H5亚型流感病毒HA蛋白头部球状结构域基因克隆至pPICZαA,构建重组真核表达质粒pPICZαA-H5HA并将其电击转化至毕赤酵母中后涂布抗性平板,随机挑取5个单克隆进行PCR扩增鉴定。PCR扩增产物经1%琼脂糖凝胶电泳分析,在750 bp处出现特异性片段(图1),与预期的结果相符。同时,对重组质粒pPICZαA-H5HA进行测序。测序结果表明,目的基因序列正确,且未发生碱基突变,重组表达载体构建成功。
2.2 目的蛋白的表达、纯化及鉴定
分别收取甲醇诱导前与诱导后24、48、72 h酵母上清进行SDS-PAGE。因为在酵母发酵过程中,随着酵母培养时间的延长,培养液会逐渐减少且污染机会大大增加,因此选择72 h作为最佳诱导时间。将诱导72 h后的培养液离心后上清用浓缩管浓缩,再用镍柱亲和层析及Superdex 2000分子筛层析进行纯化。图2A为诱导不同时间后发酵液上清中目的蛋白的表达情况,由结果可见,未添加甲醇进行诱导时,目的蛋白不表达,添加甲醇诱导后,目的蛋白开始表达,且表达量在诱导后的24–72 h内随着诱导时间的延长,表达量逐渐升高,以72 h时发酵液上清中目的蛋白含量达到最高,达到0.2 mg/mL,且分子量大小符合预期,约为37 kDa。图2B为纯化后的目的蛋白H5HA,由结果可见,纯化后的目的蛋白条带单一、纯度较高。

图1 重组酵母菌的PCR产物鉴定Fig.1 Identification of recombinant yeasts by PCR.M:DNA marker; 1: product using plasmid pPICZαA-H5HA as amplification template; 2: product using empty plasmid pPICZαA as amplification template; 3–5: product using three different recombinant yeast cells as amplification template.
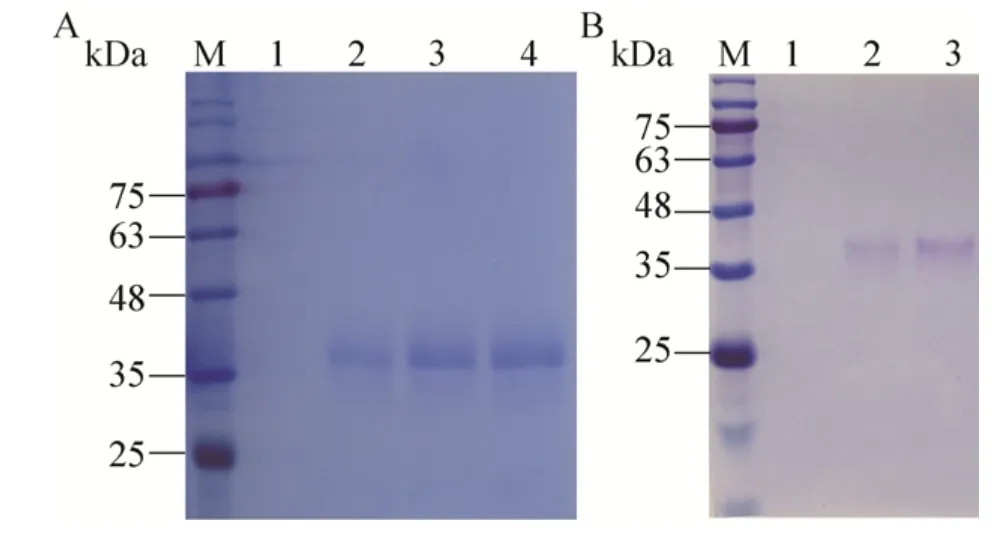
图2 重组蛋白H5HA表达及纯化的SDS-PAGE鉴定Fig.2 Identification of expression and purification of H5HA by SDS-PAGE.(A) M: marker; 1: the supernatant before induction; 2–4: the supernatant after 24 h, 48 h and 72 h induction, respectively.(B) M: marker; 1:supernatant before induction; 2: supernatant after 72 h induction; 3: purified H5HA protein.
目的蛋白带有6×His标签,因此可采用抗6×His标签的抗体检测H5HA蛋白的特异性。Western blotting分析结果显示,目的蛋白能够和抗6×His标签的抗体产生特异性反应,分子量大小正确且条带单一,说明目的蛋白具有良好的特异性 (图3)。
2.3 免疫后SPF鸡血清中IgG抗体水平
用间接 ELISA方法检测各组SPF鸡初次免疫后14 d与二次免疫后14 d时血清中IgG的含量,如图4所示,横坐标为免疫时间,纵坐标为血清的OD450值。血清中IgG的含量越高,OD450值也越高。结果显示,肌肉注射50 μg/羽免疫组(Group 2) 初次免疫及二次免疫后血清中IgG水平明显高于对照组血清的IgG水平,与对照组相比差异极显著 (P<0.01)。肌肉注射25 μg/羽免疫组 (Group 1) 初次免疫及二次免疫后血清中IgG水平也高于对照组血清的IgG水平,与对照组相比差异显著 (P<0.05)。肌肉注射50 μg/羽免疫组(Group 2) 初次免疫及二次免疫后血清中IgG水平与同条件下免疫市售疫苗免疫组 (Group 3) 相比,其差异不显著,表明酵母表达的H5HA蛋白具有较高的免疫原性。

图3 H5HA蛋白的Western blotting分析Fig.3 Western blotting analysis of the induced recombinant H5HA protein.M: marker; 1: products from the induced; 2: the supernatant before induction.
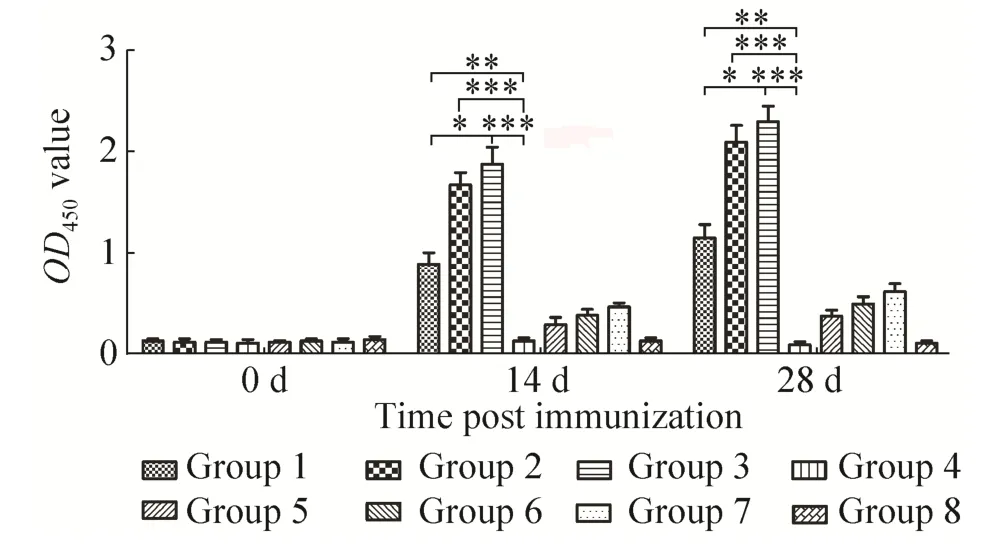
图4 各组SPF鸡血清不同时间点的IgG含量Fig.4 IgG level induced by H5HA in SPF chickens.*P<0.05, **P<0.01, ***P<0.001.
2.4 免疫后SPF鸡血清HI效价
根据HI试验的操作方法,测定SPF鸡初次免疫后14 d及二免后14 d血清HI效价,结果重复3次,取平均值。结果表明,HI试验的结果与间接ELISA的结果相符,当重组目的蛋白剂量为50 μg/羽,使用白油作为佐剂,且采用肌肉注射时HI能够达到较高水平,仅次于同种免疫方式下的市售灭活疫苗 (表2)。
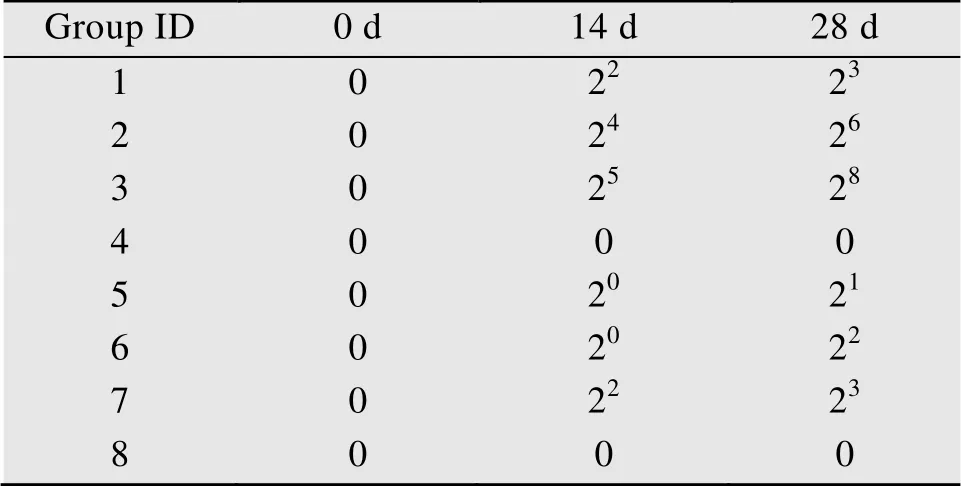
表2 免疫H5HA的各组SPF鸡的HI效价Table 2 HI titers induced by H5HA in SPF chicken
2.5 动物安全性试验检测
为了检测亚单位疫苗实验室制品的安全性,分别给健康的雏鸡、BALB/c小鼠及日本大耳白种兔接种候选疫苗,结果显示,免疫的动物均无红肿、硬结和流感的临床症状 (表3)。
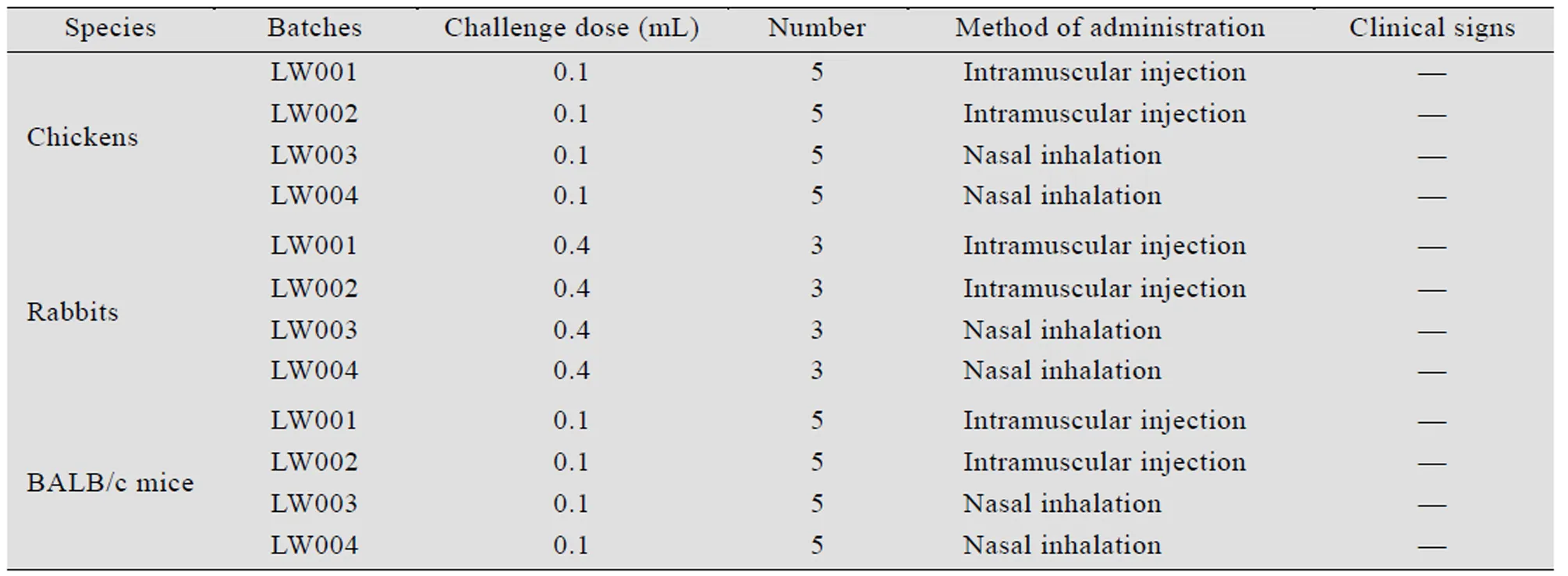
表3 亚单位疫苗实验室制品的安全性检测Table 3 The safety of different batches of H5HA subunit vaccines
2.6 血清-病毒中和试验结果
根据中和试验的操作方法,对SPF鸡初次免疫后14 d和二免后14 d的血清进行中和抗体效价测定,结果重复3次,取平均值。结果显示,病毒中和试验的结果与间接ELISA及HI试验的结果相符。当重组目的蛋白剂量为50 μg/羽,使用白油作为佐剂,且采用肌肉注射时血清中的中和抗体效价为1∶218,与同等免疫条件下的市售灭活疫苗相比差异不显著 (图5)。
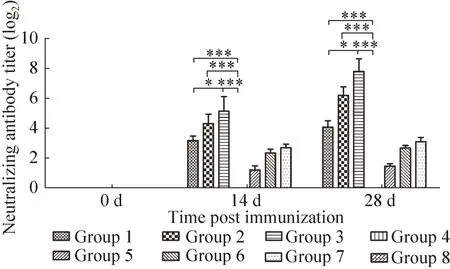
图5 各组SPF鸡血清不同时间点的中和抗体效价Fig.5 Neutralizing antibody titer induced by H5HA in SPF chickens.*P<0.05, **P<0.01, ***P<0.001.
3 讨论
A型流感病毒作为人畜共患的病原,每年都会引起流感的暴发,引起较高的发病率和死亡率[20],其宿主范围广泛,包括人、猪、马、海洋哺乳动物、各类家禽野鸟等[21]。在长期的进化中,广泛的宿主为A型流感病毒提供了更多点突变及重组重配机会,形成了新的人畜共患毒株,给人类及畜禽健康带来严重威胁。
接种疫苗是预防流感的有效途径,也是目前防控流感的主要手段。我国常用的H5亚型流感疫苗为灭活疫苗,随着不同毒株的流行,曾使用过Re-1、Re-4、Re-5、Re-6、Re-7、Re-8和Re-10株等市售疫苗,但该类疫苗在生产过程中涉及到了活病毒的操作,所以存在生物安全风险,因此研发能诱导机体产生高中和活性抗体的亚单位疫苗已成为目前研究的热点。亚单位疫苗的成分一般为病毒的主要表面蛋白,不涉及活病毒操作,且免疫效果良好,是一种安全、有效的疫苗。
酵母表达系统是目前应用较为广泛的真核表达系统,不但具有翻译后修饰、加工、折叠等优点,而且酵母适合大规模发酵培养、生产成本低,已被广泛应用于亚单位疫苗、蛋白药物、食品保健等研究中[22],目前已有30多种生物制品 (经FDA许可) 由酵母表达系统生产,包括HBV的表面抗原亚单位疫苗等[23-26]。
HA是A型流感病毒表面主要糖蛋白之一,其通过与宿主靶细胞上的唾液酸受体结合介导病毒的侵入[27]。由于禽流感病毒的HA蛋白能够诱导机体产生中和抗体,HA蛋白头部球状结构是禽流感病毒主要的保护性抗原区域。HA诱导的抗体效价的高低从某种程度上能够反映机体对于禽流感病毒的抵抗力[28-29]。目前已有利用酵母表达的H5N1亚型流感病毒HA蛋白作为亚单位疫苗的报道[14,30-31],结果均表明,重组表达的HA蛋白免疫动物后血清中抗体的ELISA效价及血凝抑制效价均较高,如Murugan等利用酵母表达的HA蛋白进行小鼠试验发现,免疫后49 d,10 μg剂量组的血清抗体效价 (间接ELISA法检测) 可高达1∶700以上,同时血凝抑制效价高达1∶200以上[14]。另外,Bright等利用杆状病毒-昆虫细胞系统表达了由H5N1的HA、NA及M1组装而成的VLPs,并将其免疫小鼠,结果表明,VLPs诱发小鼠体内较高的T细胞及B细胞免疫应答,保护了小鼠免受致死剂量的重组H5N1流感病毒的攻击,但该研究未开展靶动物验证试验[32]。
本研究结果表明,重组H5HA蛋白以分泌表达的方式大量存在于发酵液中,蛋白浓度可达0.2 mg/mL,且纯度较高。另外,本研究将重组H5HA蛋白与佐剂联用制成亚单位疫苗,用SPF鸡进行免疫原性评价的结果显示,当重组H5HA蛋白免疫剂量为50 μg/羽,使用白油作为佐剂且采用肌肉注射时,血清的HI效价能达到较高水平,具有较好的免疫原性,仅次于市售灭活疫苗。血清-病毒中和抗体效价为1∶218,与市售灭活疫苗相比,差异不显著。
本研究获得了重组目的蛋白H5HA,实现了H5N1亚型流感病毒HA抗原基因在酵母表达系统中的高效表达,可作为H5N1流感病毒亚单位疫苗和诊断试剂的候选抗原。但重组蛋白H5HA作为亚单位疫苗免疫靶动物,抗体水平与市售灭活疫苗相比还有待提高。因此,本研究后续将从佐剂种类筛选、剂量筛选、与抗原混匀条件等方面继续优化工艺,同时补充稳定性试验、保存期试验、批间重复性试验等,为重组蛋白H5HA作为亚单位疫苗的使用提供理论支持。
