环氧基修饰磁性微球固定化磷脂酶A1
2019-01-28操丽丽潘丽军侯志刚水龙龙李进红姜绍通
鲍 赛,操丽丽,庞 敏,潘丽军,侯志刚,水龙龙,李进红,姜绍通
(合肥工业大学食品科学与工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009)
磷脂酶A1(phospholipase A1,PLA1)(Lecitase®Ultra)是一类能特异性水解磷脂Sn-1位酰基生成溶血磷脂和脂肪酸的酶,在油脂化学工业中发挥重要作用[1-2]。然而,游离PLA1存在价格昂贵、稳定性差和难以从反应体系分离与回收等缺点,限制了它的工业化应用[3]。对PLA1固定化能很好地解决上述问题。酶的固定化技术是指利用物理或化学手段将酶限制或束缚在载体上,但酶的催化特性得以保留和稳定性得以提高的一门技术[4]。
Fe3O4磁性微球由于具备超顺磁性、高比表面积、低毒性以及优良的生物相容性等优势而成为酶固定化的重要载体[5-6]。然而,Fe3O4磁性微球表面除少量羟基外没有活泼的官能团与酶分子发生共价反应,且裸露的Fe3O4磁性微球在空气中易被氧化,在Fe3O4磁性微球表面进行化学修饰引入合适的活泼基团能改进这些不足,更好地用于酶的固定化[7]。
环氧基团在中性条件下非常稳定,即使是在潮湿的环境中也可以长期贮存[8]。据报道,它们在碱性或酸性条件下,能通过多点共价固定化酶[9]。因此,环氧基修饰的Fe3O4磁性微球是一种非常理想的固定化酶载体,已经被广泛应用于各种酶的固定化,如脂肪酶[10]、马肝醇脱氢酶[11]和青霉素G酰化酶[12],但固定化PLA1还鲜有探讨。本研究利用自制的环氧基修饰的Fe3O4磁性微球为载体固定PLA1,采用响应面法优化PLA1的固定化条件,并考察其酶学性质和载体的结构组成特性,以期为后续研究酶法脱胶和工业化应用提供理论依据。
1 材料与方法
1.1 材料与试剂
PLA1(Lecitase®Ultra) 丹麦诺维信公司;γ-(2,3-环氧丙氧)丙基三甲氧基硅烷(γ-glycidoxypropyltrimethoxysilane,GPTMS) 上海阿拉丁有限公司;大豆卵磷脂(粉末状) 上海蓝季科技发展有限公司;FeCl2·4H2O、无水FeCl3、乙醇、磷酸氢二钠、柠檬酸、聚乙烯醇、氢氧化钠、氟化钠、丙酮、考马斯亮蓝(均为分析纯)国药集团化学试剂有限公司。
1.2 仪器与设备
Nicolet67傅里叶红外光谱仪 美国Thermo Nicolet公司;D/MAX2500V X射线衍射仪 日本理学株式会社;SU8020冷场发射扫描电子显微镜(scanning electron microscopy,SEM) 日本日立公司;JEM-1011透射电子显微镜(transmission electron microscopy,TEM)日本电子公司;T6新世纪型紫外-可见分光光度计北京普析通用仪器有限责任公司;DZJ-4B自动电位滴定仪上海仪电科学仪器股份有限公司;DZF-6053真空干燥箱上海一恒科学仪器有限公司;FA25高剪切分散乳化机上海弗鲁克流体机械制造有限公司;HH-S数显恒温水浴锅 江苏金坛金城国胜实验仪器厂;NSKY-110WX型水浴摇床 上海苏坤实业有限公司。
1.3 方法
1.3.1 Fe3O4磁性微球的制备
采用传统的共沉淀法制备Fe3O4磁性微球[13],整个制备过程在氮气环境中进行。首先,将FeCl2·4H2O和无水FeCl3按物质的量比1∶2加入100 mL的去离子水中。然后,在室温下逐滴加入7 mL 30% NaOH溶液同时剧烈搅拌,直至产生黑色沉淀。最后,磁分离,用去离子水洗至pH 7.0,室温下真空干燥12 h。
1.3.2 GPTMS修饰Fe3O4磁性微球[14]
称0.5 g制备的Fe3O4磁性微球于20 mL超纯水中,超声分散5 min,称为A液;称2.5 g GPTMS于20 mL的超纯水中,超声分散5 min,并用4%的NaOH溶液调节pH值至中性,称为B液。将A液和B液全部加入100 mL的三口烧瓶中,超声10 min,再加入5 mL 1%氟化钠溶液,室温抽真空减压3 h,磁分离,用丙酮洗涤若干次后,室温真空干燥12 h得环氧基修饰的Fe3O4磁性微球(Fe3O4@GPTMS)。
1.3.3 Fe3O4@GPTMS固定化PLA1
为获得高酶活力和高固定化率的固定化酶制剂,在不同固定化条件如缓冲液pH值、酶液添加量和固定化时间下进行单因素试验。分别取1~6 mL PLA1和1 g Fe3O4@GPTMS于50 mL缓冲液(0.1 mol/L柠檬酸溶液、0.2 mol/L磷酸氢二钠溶液按不同比例配成pH值分别为3.0~6.0的缓冲液)中,在室温(20 ℃)条件下用摇床振荡固定1~6 h,倾出上清液,用缓冲液冲洗若干次至洗液中无蛋白被检测出。将固定化酶、上清液和洗液保存于4 ℃冰箱中。
1.3.4 响应面试验设计
基于单因素试验结果,以固定化酶活力为指标,通过Box-Behnken设计优化固定化PLA1的条件参数。试验因素与水平设计见表1。

表1 固定化条件Box-Behnken试验因素与水平Table1 Factors and their levels used for Box-Behnken design for optimization of immobilization conditions
1.3.5 固定化PLA1的固定化率及酶活力测定
依据Bradford[15]的方法测定蛋白含量,通过测定蛋白含量得到固定化率,见下式。参照文献[16-17]测定游离PLA1和固定化PLA1活力,相对酶活力是指在同组实验中,最大值为100%时其他值与最大值的百分比。
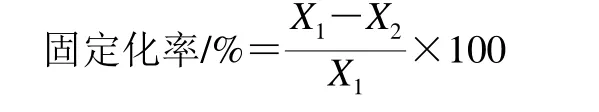
式中:X1为固定化前加入酶液的蛋白含量/mg;X2为洗液和上清液中蛋白含量/mg。
1.3.6 酶学性质分析
1.3.6.1 最适作用pH值和最适作用温度
分别在不同pH值(4.5、5.0、5.5、6.0、6.5、7.0)和不同温度(40、45、50、55、60、65 ℃)条件下,以1.3.5节的方法测定游离PLA1和固定化PLA1的相对酶活力。
1.3.6.2 贮藏稳定性
游离PLA1和固定化PLA1分别在25 ℃孵育20 d,每隔2 d定时测剩余酶活力。
1.3.6.3 操作稳定性
参考Yu Dianyu等[18]的研究,将固定化PLA1置于装有菜籽毛油的三角烧瓶中,在50 ℃的水浴锅中进行机械搅拌3 h,回收固定化PLA1,重复操作8 个批次。每次循环后,用pH 4.0的缓冲液冲洗固定化PLA1。计算每个循环后的残余酶活力与初始酶活力(100%)百分比。
1.3.7 Fe3O4和Fe3O4@GPTMS磁性微球的表征
采用X射线衍射(X-ray diffraction,XRD)、衰减全反射傅里叶变换红外光谱(attenuated total reflection Fourier-transform infrared spectroscopy,ATR-FTIR)、SEM和TEM对Fe3O4和Fe3O4@GPTMS磁性微球进行检测和分析。样品进行XRD测定,CuKα辐射;样品进行ATR-FTIR测定,扫描范围为500~4 000 cm-1;样品进行SEM分析,加速电压为15.0 kV,放大倍数为100 000 倍,喷金后在电镜下观察其表观形貌;样品进行TEM分析,加速电压100 kV,放大倍数150 000 倍,喷金后在电镜下观察其形貌和粒径分布。
2 结果与分析
2.1 固定化条件的优化
2.1.1 单因素试验结果
2.1.1.1 最适缓冲液pH值的确定

图1 pH值对酶固定化效果的影响Fig.1 Effect of pH on phospholipase immobilization
由图1可知,相对酶活力及固定化率受缓冲液pH值的影响较大。在一定的固定化条件下,固定化率随着pH值的升高而减小,而相对酶活力随着pH值的升高先逐渐增大后逐渐减小。选择pH 4.0,酶活力达到最大,固定化率为67.4%。这可能是由于pH值越远离7.0,环氧基团与酶结合能力越强,固定化率越大[19]。但酶作为一种蛋白质,在过酸或者过碱的环境中,酶容易变性失活[20]。
2.1.1.2 最适酶液添加量的确定

图2 酶液添加量对酶固定化效果的影响Fig.2 Effect of enzyme dosage on phospholipase immobilization
由图2可知,固定化率随着酶液的增加而逐渐减小,而相对酶活力随着酶液的增加而逐渐增加,当酶液添加量达到载体所能固定的最大酶量时,相对酶活力趋于稳定,不再发生变化。这主要是由于随着酶液的增加,载体上游离基团越来越少导致固定化率降低,而载体上结合的酶分子越来越多,酶活力增加,当酶在载体上的负载量达到最大值,相对酶活力也达到最大值,不再发生变化[21]。酶液添加量选3.0 mL,此时,酶活力最大,固定化率为67.4%。
2.1.1.3 最适固定化时间的确定

图3 固定化时间对酶固定化效果的影响Fig.3 Effect of reaction time on phospholipase immobilization
如图3所示,随着固定化时间的延长,固定化率逐渐增大,在2 h趋于稳定,而相对酶活力先增加,在2 h后略微有所下降。这是由于载体的量是固定的,随着固定化时间的延长,载体上的活性基团逐渐被酶结合,在2 h时载体结合酶量达到饱和,固定化率达到最大值,不再发生变化,而当固定化时间超过2 h后,酶蛋白失活导致相对酶活力略微降低[20]。因此,最适固定化时间为2 h,酶活力最大,固定化率为61.1%。
2.1.2 响应面优化固定化条件
2.1.2.1 响应面试验结果

表2 响应面试验设计与结果Table2 Experimental design and results for response surface analysis
利用Design-Expert 8.0.6软件对表2中数据进行多项式回归拟合,结果如表3所示。

表3 回归模型的方差分析Table3 Analysis of variance of the regression equation
由表3可以看出,回归模型高度显著(P<0.000 1),校正系数R2为0.918 2,失拟项P值为0.637 8,回归方程具有很高的拟合度和可信度,可用此模型对固定化条件进行分析和预测。校正决定系数为0.969 6,即此回归方程可以解释96.96%的酶活力数据的可变性。C、A2、B2、C2影响极显著(P<0.01),A和BC对响应面的影响比较显著(P<0.1),AB、AC对响应值无影响。各个试验因素对酶活力的影响依次为:C(酶液添加量)>A(缓冲液pH值)>B(反应时间)。
获得的回归方程模型为:Y=3 528-58.75A-35B+301.25C-82.5BC-686.5A2-284B2-271.5C2。
根据回归方程,确定PLA1固定化的最佳条件为缓冲液pH 3.98、反应时间1.85 h、酶液添加量3.58 mL/g,预测酶活力为3 618.14 U/g。
2.1.2.2 最优值的确定
为验证所获得结果的可靠性,进行3 次重复验证实验,对响应面的结果进行验证,确定缓冲液pH 4.0、反应时间1.9 h、酶液添加量3.6 mL/g,此条件下进行固定化得到的酶活力为3 675 U/g,该值落在响应值Y的预测区内[3 437.23,3 799.00]内,说明该模型具有很好的拟合度。
2.2 酶学性质分析
2.2.1 最适作用pH值和最适作用温度

图4 pH值(A)和温度(B)对游离酶和固定化酶活力影响Fig.4 Effects of pH (A) and temperature (B) on the activities of free and immobilized enzyme
分别考察在pH 4.5~7.0、温度40~65℃范围内,pH值和温度对游离PLA1和固定化PLA1活力的影响。如图4A所示,游离PLA1的最适作用pH值为5.0,固定化PLA1的最适作用pH值为6.0,固定化后,最适作用pH值向碱性方向偏移了1.0。此外,固定化PLA1比游离PLA1具有更宽的作用范围。可能是由于酶分子与载体材料的性质不同,固定化酶复合物通过增强pH值耐受性避免构象变化[21]。
如图4B所示,游离PLA1和固定化PLA1的最适作用温度分别为50、55 ℃,固定化后,最适作用温度提高了5 ℃。在较高的温度范围内,固定化PLA1比游离PLA1具有更高的相对活性。这可能是由于酶被固定在载体上限制了酶分子在高温下的构象迁移,从而有效地阻止了酶的失活[22-23]。
2.2.2 贮藏稳定性

图5 游离酶和固定化酶的贮藏稳定性Fig.5 Storage stability of free and immobilized enzyme
如图5所示,在室温下放置8 d,游离PLA1剩余酶活力为58.9%,而固定化PLA1剩余酶活力仍为80%以上;在室温放置20 d后,游离PLA1活力损失90%左右,而固定化PLA1为初始酶活力的50%以上。这可能是由于固定化后酶的空间三维结构发生变化,分子间的氢键和静电相互作用增强,酶分子的催化活性中心构象得以完整保存[24-25]。因此,固定化后,酶具备更长的贮藏周期,这将延长酶的使用寿命,拓宽酶的应用前景。
2.2.3 操作稳定性
固定化酶能多次重复使用,提高酶的可重复使用性是降低酶单次使用成本的重要途径之一[10]。如图6所示,相同的酶活力测定条件下,在重复菜籽油脱胶8 个批次后,仍保留81.1%的酶活力,固定化PLA1具有优良的操作稳定性。这主要是由于酶与载体上的环氧基共价连接,稳定性较强,使每次循环过程中较少的酶脱落[26]。

图6 固定化酶的重复使用性Fig.6 Reusability of immobilized enzyme
2.3 Fe3O4和Fe3O4@GPTMS磁性微球的表征
2.3.1 XRD分析


图7 XRD图Fig.7 XRD pattern
如图7所示,Fe3O4磁性微球的6 个特征峰(2θ为30.18°、35.48°、43.32°、53.68°、57.26°和62.84°)在Fe3O4@GPTMS磁性微球中也可以观察到,且各峰的位置和相对强度与标准Fe3O4的XRD图谱有很好的对应关系,表明制备的Fe3O4磁性微球为反式尖晶石结构,且经过环氧基修饰后,结构保持不变[27]。
2.3.2 ATR-FTIR分析

图8 Fe3O4和Fe3O4@GPTMS磁性微球的衰减全反射傅里叶红外吸收光谱图Fig.8 ATR-FTIR spectra of Fe3O4 and Fe3O4@GPTMS magnetic microspheres
如图8所示,Fe3O4磁性微球的ATR-FTIR图谱在567 cm-1附近出现吸收峰,表明Fe—O发生伸缩振动,在3 360 cm-1附近出现吸收峰表明O—H键发生伸缩振动,这说明已经成功地合成了Fe3O4磁性微球。与Fe3O4磁性微球的ATR-FTIR图谱对比发现,Fe3O4@GPTMS磁性微球的图谱在1 040 cm-1附近出现Si—O键的吸收峰,且分别在2 970 cm-1和2 870 cm-1处多了一个吸收峰,这分别与—CH3和—CH2键的拉伸有关,表明Fe3O4磁性微球表面成功接合环氧基团[28]。
2.3.3 SEM和TEM分析
由图9a、b可知,Fe3O4磁性微球和Fe3O4@GPTMS磁性微球颗粒大小均匀,近似球形,有团聚现象,这可能是由于粒子间的磁偶极相互作用[29]。由图9c、d可知,Fe3O4磁性微球和Fe3O4@GPTMS磁性微球粒径在10~30 nm之间,成功制备出纳米尺寸的磁性微球。与Fe3O4相比,Fe3O4@GPTMS的形貌和尺寸分布几乎没有改变,这表明环氧基修饰没有显著改变Fe3O4磁性微球的形貌和尺寸分布[21]。且可以通过SEM和XRD图得出修饰后的Fe3O4磁性微球仍保留Fe3O4磁性微球的结构特征[30]。

图 9 SEM和TEM图Fig.9 SEM and TEM images
3 结 论
以自制的环氧基修饰的Fe3O4磁性微球对PLA1进行固定化,XRD、ATR-FTIR、SEM和TEM分析表明成功制备出纳米尺寸的载体,且环氧基被修饰在其表面。通过响应面试验优化得到固定化PLA1的最佳条件为:1 g环氧基修饰的Fe3O4磁性微球和3.6 mL酶液在pH 4.0的缓冲液中,室温条件下振荡固定1.9 h。在此条件下,得到的酶活力为3 675 U/g,固定化率为61.1%。与游离PLA1相比,固定化PLA1的最适作用pH值从5.0移动到6.0,向碱性方向偏移1.0;最适作用温度从50 ℃提高到55 ℃,提高了5 ℃,且pH值和温度的作用范围更广,耐碱性和耐热性更好。固定化PLA1的贮藏稳定性也得到很大程度的提高。将固定化PLA1用于菜籽油脱胶实验,重复使用8 个批次后,仍保留81.1%的酶活力,表现出优异的可重复使用性。
利用磁场,本实验制备的固定化PLA1极易从反应体系分离与回收,且稳定性好,操作简单,适用于工业化生产。研究结果表明,环氧基修饰的磁性微球固定化酶是一种有效的生物催化剂,极具应用潜力。
