嫁接体植株中核酸与蛋白质的砧穗交流
2019-01-25谢露露尚庆茂
谢露露,尚庆茂
(中国农业科学院 蔬菜花卉研究所,北京 100081)
嫁接指将一个植株从茎或下胚轴处切断获得的芽或枝,与另一个植株带有根系的部分于切口处贴接,使其愈合并生长成新的嫁接体植株。芽或枝的部分称为接穗(scion),带有根系的部分称为砧木(stock),接穗和砧木愈合的部位称为嫁接结合部(graft union)。嫁接结合部具有连通砧木与接穗的维管组织,保证嫁接体植株砧穗两部分的共同生长和发育。或许受到自然界中不同植物个体之间融合生长现象的启迪,在公元2000多年前,我们民众就已经能够使用嫁接技术和表型筛选,获得具有更优良性状的作物[1]。现如今,嫁接已被作为一种常规手段广泛应用于蔬菜的繁育。较之蔬菜品种单独种植,优良的嫁接体植株具有产量和品质提高、生物或非生物胁迫抗性增强、株型优化、开花或块茎化习性优化等增益效果[2-4]。然而并非任意品种之间的嫁接均能获得理想的性状改良。在生产应用中,经常会发生一个性状获得改良的同时另一性状退化,或是改良效果不明显等现象。对优良砧穗组合的筛选还存在很大的盲目性。为了探讨表型变化的规律,砧穗间物质交流的类型和方式被广泛研究。之前的观点认为,只有糖类、无机盐离子、小分子代谢物和内源性植物激素可经由韧皮部在植物体内被系统性地转运,而近10余年的研究证实,大分子物质如蛋白质和RNA也可在细胞间转运和韧皮部运输[5-6]。随后又发现甚至DNA也可以在嫁接面局部发生转移[7]。DNA、RNA、蛋白质等大分子物质在砧穗间的交流,很可能对性状改变起到更为关键的作用。本文结合最新进展,按照物质类型和砧穗间交流方式进行归纳和梳理(表1)。
1 DNA在嫁接面局部的水平转移
近期研究表明,砧穗之间存在基因水平转移(Horizontal gene transfer,HGT)现象。Stegemann及其合作者将核基因组和叶绿体基因组分别标记抗性基因和荧光标识的2个烟草转基因株系以斜切45°的方式嫁接,待嫁接体形成后在嫁接结合部连续横切,再将由此获得的茎组织薄片在含有2种抗生素选择压力的培养皿上培养。培养皿上分化出来的植株兼具2种抗性基因和2种荧光标识,而远离嫁接部位的茎组织薄片则不能分化出植株,这个现象说明了砧穗嫁接面附近区域发生的基因水平转移事件[7]。随后他们又将标记叶绿体基因组的烟草(Nicotianatabacum)作为砧木,标记核基因组的烟草属另外2个种N.glauca和N.benthamiana作为接穗,同样是利用嫁接结合部切片和双抗选择压下的组织培养获得抗性植株。结果显示,该植株的表型在幼苗期和成体期均与接穗物种的表型几乎相同。DNA分子标记和特征片段测序结果表明,双抗培养基筛选出来的植株捕获了来自砧木的完整叶绿体基因组[8]。为了继续验证核基因组是否也有转移,将N.tabacum(核型2n=48)2个株系的核基因组分别标记,获得了包含2套核基因组标记的核基因转移(Nuclear gene transfer,NGT)株系,该NGT株系可以自交形成种子,自交后代染色体数目多为96,且表型变异很大。有趣的是,如果将N.tabacum与染色体数目不同的N.glauca(核型2n=24)嫁接获得NGT株系后,则自交后代的染色体数目稳定在72条,且群体内表型一致,抗性基因呈现孟德尔分离比。嫁接部位由疑似细胞融合(Cytomixis)机制产生的异源多倍体具有无繁殖障碍和稳定遗传等特点,表明经由基因水平转移介导的非有性(Asexual)途径能够形成嫁接杂合体(Graft hybrid)的事实[9]。
由以上试验可知,砧穗间的DNA交流形式既包括完整叶绿体基因组,又包括核基因组。然而交流仅发生在嫁接面部位,即使有从嫁接结合部小概率长成的具有嫁接杂合体性质的芽或侧枝,嫁接体植株上绝大部分组织仍然不具备从嫁接搭档那里捕获的DNA。尽管如此,却不能完全排除DNA转移对表型的影响。研究表明,基因水平转移普遍存在于陆地植物的表型演化历程,植物基因组中保留的异源基因在一些基本功能中发挥作用,如木质部形成、植物防御、氮循环以及淀粉、多胺、植物激素和谷胱甘肽等的生物合成等[10]。而嫁接结合部作为砧木和接穗在形态和生理上的缓冲区,DNA所承载遗传信息的局部转移会对砧穗双方的表型产生怎样的影响,还需要进一步证实。
2 蛋白质在砧穗间的长距离运输
遍布植物体的韧皮部筛管是由首尾相接的筛分子(Sieve elements,SE)-伴胞(Companion cell,CC)复合体构成。筛管中的韧皮部运输流(Phloem translocation stream),是物质在植物体内各个组织间长距离系统性运输(Long-distance systemic transportation)的唯一途径。韧皮部的SE和CC连接处,有特化的孔间单元(Pore plasmodesmal units,PPUs)结构。由于这种结构的存在,胞间连丝的尺寸排阻极限(Size exclusion limit,SEL)可达到远超普通细胞间SEL的程度,为1 ku以上,最大为67 ku[11]。这样的SEL足够蛋白质和分子质量较小的RNA通过[5]。可以在韧皮部运输的物质,当砧穗正常愈合后,均可以在砧穗间穿梭。利用嫁接系统完成的长距离运输试验,为大分子物质的砧穗间穿梭提供了大量证据。
从韧皮部汁液(Phloem sap)中鉴定出来的蛋白质数量众多[11]。绿色荧光蛋白(Green fluorescent protein,GFP)和所有分子质量低于SEL阈值的GFP融合蛋白均能够通过CC-SE边界[5,12]。说明蛋白质在进入韧皮部时的方式是非选择性的。另外有证据表明,较之内质网锚定核糖体上翻译出的蛋白质,胞质游离核糖体上翻译出来的蛋白质更容易进入SE。而编码亚细胞定位信号的多肽链不足以指导蛋白质的韧皮部运输。这说明,韧皮部蛋白质中很大一部分是由于非特异性流失而造成的[13]。
韧皮部运输流中的蛋白质至少具有2种功能形式:信号传递和辅助运输。起信号传递作用的蛋白在植物体内的长距离运输,履行系统性防御或者发育信号传递的功能。例如成花素(Florigen)被认为是光信号接收部位和茎顶端开花效应部位之间的信号传递分子。在南瓜属(Cucubita)2个种的异源嫁接试验中,成花素的身份被确定为FT(Flowering locus T)蛋白。将长日照条件下生长的短日照植物白籽南瓜(C.moschata)与已经开花的印度南瓜(C.maxima)嫁接,则白籽南瓜接穗被诱导开花,伴随接穗韧皮部汁液中大量存在的Cm-FTL1(Flowering locus T-like1)和Cm-FTL2蛋白,而非它们的mRNA[14]。FT蛋白不仅是诱导开花的信号蛋白,还能够诱导马铃薯(Solanumtuberosum)地下茎的块茎化(Tuberization)。如果将水稻的FT同源基因Hd3a在马铃薯中表达,并将转基因植株作为接穗与野生型嫁接,则能够诱导原本在长日照条件下生长不形成块茎的野生型砧木形成块茎[15]。另外,亲环蛋白(Cyclophilin)也代表了一类可长距离运输的蛋白质信号分子。在番茄(Solanumlycopesicum)中,将野生型接穗与亲环蛋白SlCyp1突变的砧木嫁接后,可以恢复突变体的根系发育和对生长素的敏感性[16]。
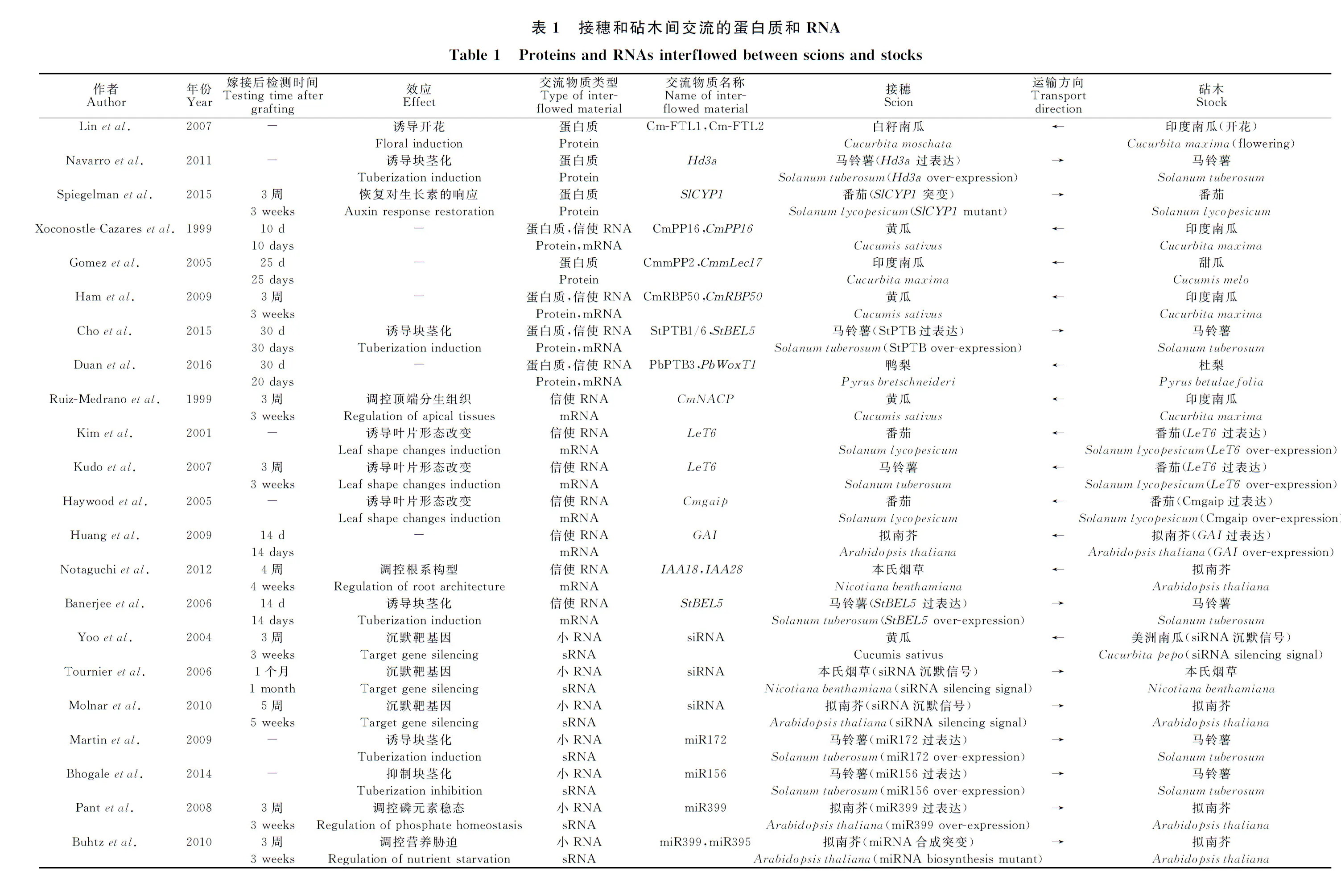
在韧皮部中还鉴定到一些行驶辅助运输功能的蛋白质,被认为是大分子物质系统性长距离运输机制的组成部分。这类蛋白结合RNA分子,同时能够增大胞间连丝(Plasmodesmata,PD)的CEL,从而辅助RNA的选择性运输[5]。如印度南瓜中的CmPP16(Phloem protein 16),与病毒移动蛋白(Movement proteins,MPs)同源,存在于SE中,能结合包括自身mRNA在内的若干种RNA分子[17]。编码细胞色素b5还原酶(Cytochrome b5 reductase,Cb5R)的CmPP36也结合RNA,但在韧皮部汁液中鉴定到的CmPP36蛋白,是其完整编码序列去除N端一段跨膜序列后的形态,人为去除N端序列后,可以实现CmPP36蛋白的韧皮部转运,从而推测蛋白质进入韧皮部时可能存在蛋白质水解过程[18]。此外,韧皮部凝集素(Lectin)类蛋白CmmPP2和CmmLec17在CC中合成,经PD转运至SE,能够结合韧皮部RNA和病毒RNA。甜瓜(Cucumismelo)砧木和印度南瓜接穗嫁接后,甜瓜CmmLec17蛋白在嫁接后25 d在印度南瓜接穗中被检测到[19]。另一类RNA结合蛋白,PTB(Polypyrimidine tract-binding)类蛋白倾向于结合在RNA的尿嘧啶(U)和胞嘧啶(C)富集区域,介导RNA的运输,如印度南瓜CmRBP50(RNA binding protein 50)蛋白和自身转录本的运输[20]、马铃薯中的StPTB1/6 介导StBEL5(BEL1-like 5)转录本的运输[21]、杜梨(Pyrusbetulaefolia)中的PbPTB3蛋白介导PbWoxT1(Wox transport 1)转录本的运输[22]。
3 信使RNA在砧穗间的长距离运输
在韧皮部汁液中发现可迁移的mRNA(Transmissible mRNAs),曾让人们感到出乎意料[6]。通过葫芦科和茄科物种的异源嫁接试验,发现多个可迁移mRNA,如CmNACP(NAC domain protein)从南瓜砧木迁移至黄瓜(Cucumissativus)接穗,参与黄瓜顶端分生组织的发育调控[6]。从番茄的Me(Mouseear)自然突变体中迁移出的过量LeT6(KNOTTED-1-like homeobox)基因转录本导致番茄和马铃薯接穗的叶片形态发生明显改变[23-24]。拟南芥(Arabidopsisthaliana)gai-1(gibberellicacidinsensitive1)突变体中的GAI基因缺失了DELLA结构域序列,因而存在GA信号途径的异常。将带有ΔDELLA-gai基因的拟南芥或者遗传转化Cmgaip基因的番茄作为砧木,与各自的野生型植株进行嫁接,均导致野生型接穗呈现植株矮小的赤霉素缺陷表型,gai转录本的长距离运输是其内在原因[25]。在拟南芥和本氏烟草(Nicotianabenthamiana)的远缘嫁接试验中,拟南芥生长素响应蛋白(Indoleacetic acid-inducible protein)IAA18/28转录本在本氏烟草接穗中被检测到。由于此类蛋白定位于根系,被认为与根系形态的发育调控有关[26]。以上均是mRNA从砧木运输至接穗的例证,关于块茎化诱导的试验表明,mRNA同样可以由接穗运输至砧木。例如在马铃薯中过表达StBEL5(BEL1-like 5)的接穗能够诱导砧木的块茎形成[27]。
除了已经被验证功能的可迁移mRNA,最近几项有关拟南芥、葡萄(Vitisvinifera)、葫芦科异源嫁接系统的研究,利用高通量测序技术从组学角度阐释了mRNA的迁移[28-30]。将拟南芥2种生态型互相嫁接,以单核苷酸位点多态性(Single nucleotide polymorphism,SNP)为标签来区分不同来源的转录本,筛选出数以千计的可迁移mRNA。可迁移mRNA普遍具有明确的迁移方向和目标组织[28]。蛋白质组还显示,可迁移mRNA是在运至目标组织之后才被翻译为蛋白质[28]。使用黄瓜与西瓜(Citrulluslanatus)的异源嫁接体系,并加以营养胁迫处理后,可迁移mRNA在嫁接搭档不同组织间的重复性很低,再次说明源组织中的mRNA被有针对性地运往特定的库组织[30]。可迁移mRNA的类群和迁移方式与嫁接体所处的发育阶段和外部环境密不可分。比如成体期中的可迁移mRNA数量比幼体期中的少得多[29]。同是营养缺乏胁迫,缺氮和缺磷时鉴定到的可迁移mRNA的种类和数量较之全营养条件明显不同[28]。磷短期缺乏处理(24 h)后,可迁移mRNA中富集有已知直接参与磷信号转导和同化过程的转录本,如VPT(Vacuolar phosphate transporter 1)、PHO2(Phosphate 2)、CAX3(Cation exchanger 3)等,以及胁迫反应通用的一些编码各类激素受体和信号通路的转录本[30]。
mRNA的运输除了需要起辅助运输作用的蛋白质,还与mRNA自身的序列和结构密切相关。在拟南芥中,仅是GFP的转录本不能进入韧皮部,而当GFP与GAI的序列融合时,则能被长距离运输。推测这与GAI上带有的特征性基序(motif)和二级结构有关[31]。在马铃薯中,韧皮部迁移转录本StBEL5的3′UTR区域对维持mRNA的稳定性和向根运输是必要的[32]。进一步研究表明,较高比例的可迁移mRNA在编码区和UTR区具有类似tRNA的茎环结构(tRNA-like structure,TLS),这种TLS结构负责驱动mRNA的迁移[33]。另外,RNA序列上多聚UC(Uracil cytosine)元件的存在有利于PTB类RNA结合蛋白的结合[21]。
4 小RNA在砧穗间的长距离运输
在mRNA被证实经韧皮部运输之后,小RNA群体的长距离运输也被证实。从韧皮部汁液中检测到的小RNA(sRNA)包括小干扰RNA(Short interfering RNA,siRNA)和微小RNA(microRNA,miRNA)[34]。siRNA和miRNA是由双链RNA经Dicer酶家族成员切割而形成的长度为21~26 nt单链RNA[35-36]。砧穗完全愈合后sRNA可经由韧皮部在嫁接结合部上下自由移动。可移动的sRNA以结合并裂解mRNA的形式使嫁接搭档的基因被转录后沉默(Post-transcriptional gene silencing,PTGS),或是以RNA介导的DNA甲基化(RNA-directed DNA methylation,RDDM)途径改变DNA的表观遗传修饰,使基因被转录沉默(Transcriptional gene silencing,TGS)[37]。
转基因美洲南瓜(Cucubitapepo)作为砧木,野生型黄瓜作为接穗的嫁接中,砧木中的CP(coatprotein)基因特异性siRNA能够通过长距离运输沉默接穗中的CP转录本[34]。将分别具有GFP特异性siRNA沉默信号和非沉默的2个GFP转基因烟草株系正反嫁接,结合GFP荧光和韧皮部同位素示踪,显示出siRNA介导的沉默信号跟随韧皮部运输流从源(Source)组织被稳定运往库(Sink)组织[38]。利用拟南芥的嫁接试验证实,24 nt siRNA可介导受体细胞中全基因组的DNA甲基化[39-40]。由于长距离运输的siRNA同样会出现在繁殖器官的顶端生长点或花粉细胞中,诱导DNA表观遗传层面的改变,因此有可能将嫁接体的性状遗传至后代个体[41]。
miRNA通常以负调控因子身份作用于转录因子,参与发育进程或环境响应的调控。例如,miR156和miR172的系统性运输调控植物从幼体到成体的发育转换。在马铃薯中,过表达miR172的植株表现出花期提前和块根形成提前,miR172过表达接穗与野生型砧木杂交,能够诱导野生型砧木的块根形成量增多[42]。过表达miR156的植株表现为植株构型改变和块根产量降低,miR156过表达接穗和野生型砧木嫁接后,砧木的叶片形态发生改变[43]。油菜(Brassicanapus)、印度南瓜中的研究结果显示,当植株面临磷缺乏胁迫时,韧皮部汁液中miR399大量积累,通过转录后沉默机制抑制磷吸收负调因子PHO2(Phosphate 2),提高植物对磷的吸收[44-45]。拟南芥微嫁接试验显示miR399过表达接穗能够诱导野生型根系中产生大量成熟态miR399,如果砧穗互换,则在接穗中检测不到或仅检测出痕量的成熟态miR399[45]。在受到硫缺乏胁迫时的油菜韧皮部汁液中,miR395和miR171均明显上调[46]。miR399和miR395在植物面临营养胁迫时,从接穗传递至砧木,而不是相反方向,miR171则不移动[46]。从而表明miRNA不仅可以在砧穗间长距离运输,改变嫁接搭档的表型和生理状况,而且移动具有明显的方向性。
即使sRNA的分子量很小,它们在细胞间并不能自由扩散,而是需要特异性sRNA结合蛋白(Small RNA binding protein,SRPB)的辅助[34]。sRNA在源组织中合成后,被运往库组织的运输形式可以是初级形态,也可以是成熟形态[40]。
5 小 结
综上所述,DNA的交换局限于嫁接面,目前没有证据表明它们对接穗或砧木的整体表型产生影响;蛋白质的运输则更多起到辅助作用,即使作为信号分子存在,也如同小分子代谢物或内源性植物激素的作用,并不携带遗传信息。而RNA在砧穗间的互作是非常值得关注的。mRNA的大规模系统性运输,以及sRNA的远程调控和表观遗传修饰作用,对嫁接体植株的表型变异影响显著。大分子物质在韧皮部运输流中的长距离运输,尤其是RNA的运输,及其所引起的表观遗传层面的变化,应该受到更加广泛的关注。期待该领域后续的研究和进展,为砧穗组合效果和嫁接体生长发育的精准预测开辟捷径,从而深入挖掘嫁接技术的潜力,使之更好地促进农业发展和农民收益。
