基于同轴流技术的肝组织生物3D打印研究
2019-01-21杜显彬徐铭恩周永勇
杜显彬 徐铭恩,* 王 玲, 周永勇
1(杭州电子科技大学生命信息与仪器工程学院,杭州 310018)2(浙江省医学信息与生物三维打印重点实验室,杭州 310018)3(浙江省杭州捷诺飞生物科技股份有限公司,杭州 310018)
引言
再生医学和组织工程领域在过去几十年里取得了重大进步,人造组织如皮肤[1-2],软骨[3-4]和角膜[5]等已经获得成功。由于这些组织有简单的几何形状、低的细胞耗氧,所以对血管化的要求较低。然而,制造厚的、复杂的组织或器官,如心、肝、肾等,由于缺乏供应营养和氧气的血管系统,其尺寸和功能受到了限制[6]。有限的氧气扩散速度,使细胞无法远离血管200 μm存活[7]。没有血管系统,厚的组织或器官不能进行营养物质获取、气体交换和废物清除,会产生不均匀的细胞分布和有限的细胞活动产物[8]。因此,组织内相连的三维血管网络对实现人造组织的功能起着至关重要的作用[9-11]。对工程组织内部的通道进行灌流,可以为细胞提供足够的氧气和营养物质,同时清除细胞代谢废物,避免坏死组织的形成[12]。
近年来,生物三维打印成为研究的热点,通过控制细胞和生物材料的沉积,制造三维血管网络[13-15]。常见的方法是基于牺牲材料的打印,模板墨水首先嵌入在一个水凝胶模型中,随后去除牺牲模板墨水,获得空心的类血管结构[16-20]。制造血管通道后,通过灌注内皮细胞悬液,使内腔附着内皮细胞。但是,这个方法涉及复杂的牺牲材料打印以及去除过程。Dai等在纤维蛋白中促进了内皮细胞的生长,成功地实现了血管生成[21]。研究已经证明,血管网络能提高细胞在组织中的生存能力,通道附近的区域和远离通道的区域相比,细胞存活率表现出显著差异。研究同时表明,内腔表面覆盖着内皮细胞的血管通道,有助于血浆蛋白质和右旋糖酐分子的扩散。
Norotte等使用组织小球在模具内打印,琼脂糖作为临时支架来制造内腔,随后组织小球相互融合,构建的血管直径在0.9~2.5 mm之间[22]。Xu等提出了一种喷墨式生物打印系统,通过融合封装进成纤维细胞的液滴,垂直制造Z形管道[23]。Yan等利用激光辅助式的微滴打印机,在氯化钙交联池中沉积海藻酸钠液滴,打印了直径约3 mm的海藻酸钠短管[24]。然而,这些血管制造方法步骤复杂且可控性低。
生物打印血管网络的另一种方式是使用同轴打印装置。同轴喷头可以利用快速交联的水凝胶生物墨水直接制造中空细丝,生成光滑、连续、任意长度的内腔[25-26]。爱荷华大学的Zhang等在中空细丝中封装了成纤维细胞,并嵌入一个大的组织结构中[26]。相比分散在水凝胶中的细胞,管道周围的细胞有更高的存活率。在国内,上海大学的李瑜等研究了同轴挤出的材料浓度对中空纤维凝胶率与溶胀度的影响[27]。刘媛媛等对中空纤维建立了理论模型,定量分析了中空纤维在三维搭接中的拉伸变形,并进行了三维支架的制备试验及性能测试与分析[28]。
本研究利用同轴喷头制造封装进肝细胞的中空细丝,结合生物3D打印系统,叠层制造含微通道网络的肝组织。首先研究了细丝制造参数(如材料挤出速率、材料浓度)对中空细丝尺寸和出丝速度的影响,随后打印了含完整微通道网络的仿生肝组织,并检测了打印过程对细胞的存活率的影响,最后对肝组织进行分组培养,灌流组和非灌流组形成对比,检测了两种培养方式下细胞存活率的变化。
1 方法
1.1 实验材料
海藻酸钠粉末(FMC,USA)用紫外灯照射30 min,溶解在去离子水中,用磁力搅拌机300转的速度搅拌12 h,制备2%~7%(W/V)的海藻酸钠溶液。用去离子水溶解氯化钙粉末(Sigma,USA),配置2%~7%(W/V)的氯化钙溶液,氯化钙溶液经0.22 μm滤器过滤后,在室温下保存。
1.2 实验设备
将同轴喷头固定于生物3D打印机(Bio-Printer Pro,Regenovo Biorechnology Co.,Ltd)的移动轴上,由打印机的软件系统控制打印机的运动。
挤出系统主要由两台注射泵和同轴喷头组成,如图1所示。两台独立串联控制的注射泵(瑞创RSP01-BD)用于定流量分配海藻酸钠溶液和氯化钙溶液(见图1(a)),同轴喷头主要由内供料管、外供料管、内针、外针组成。外针长于内针约1 mm,有利于中空细丝的稳定成形。装有海藻酸钠溶液的料筒与内供料管之间使用聚四氟乙烯管连接,装有氯化钙溶液的料筒与外供料管之间使用聚四氟乙烯管连接。本次实验,外针使用17号针(外径1.47 mm,内径1.07 mm),内针使用23号针(外径0.63 mm,内径0.34 mm)。
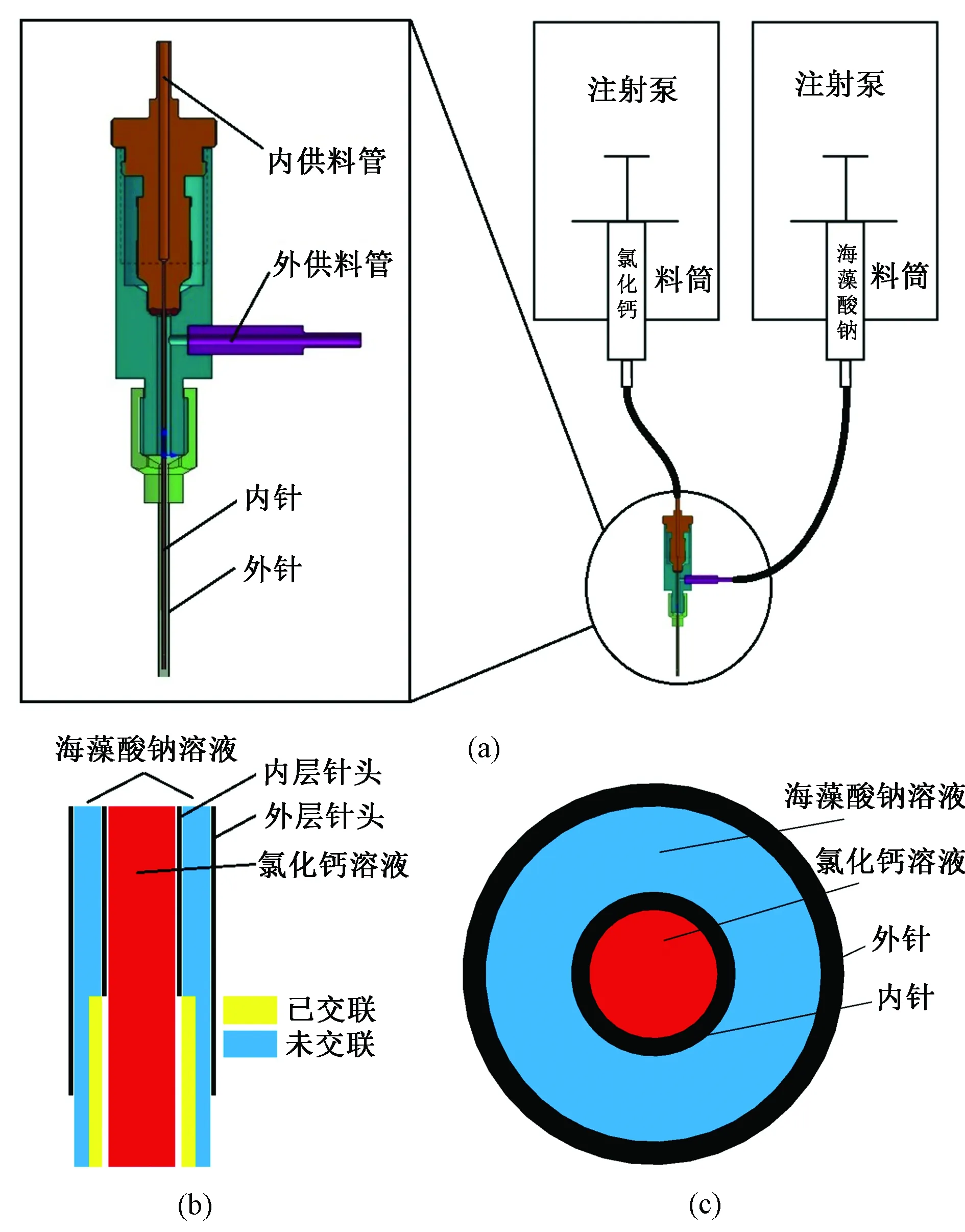
图1 同轴挤出系统。(a)挤出系统示意;(b)交联原理;(c)同轴喷头截面Fig.1 Coaxial extrusion system. (a)Extrusion system representative image;(b)Crosslinking schematic;(c)Coaxial nozzle cross section
1.3 打印路径
由于同轴喷头的特殊性,形成中空细丝的过程无法间断,因此打印路径必须连续。设计的长方体打印路径如图2所示,第二层的起点连接第一层的终点,第三层的起点连接第二层的终点,以此类推。模型的打印路径连续,打印过程无需断丝,且保证了内部通道的完整性。

图2 打印路径示意Fig.2 The schematic diagram of printing path
1.4 制造过程
打印时,同轴喷头被固定在生物3D打印机的移动轴上,待同轴喷头稳定出丝后,打印机移动轴带动同轴喷头按照预先规划好的打印路径运动,实现3D结构的叠层制造。氯化钙溶液用注射泵输送至同轴喷头内针,海藻酸钠溶液通过注射泵输送至同轴喷头外针和内针之间的夹层。海藻酸钠溶液与其他二价阳离子(如钙离子、镁离子等)混合时,会发生离子交换,快速形成有一定机械强度的凝胶[29]。图1(b)为水凝胶和交联剂发生交联反应的原理,图1(c)为同轴喷头的横截面。同轴喷头外针中的水凝胶溶液被交联,形成管壁,内针中的交联剂形成管道中空部分。要使交联剂的离子完全渗透进水凝胶需要一定的时间,取决于交联剂离子的浓度、壁厚、海藻酸溶液浓度等。因此,刚挤出的中空细丝内层先被交联,而外层未交联,利用细丝未交联的外层,实现细丝之间的融合。
1.5 细胞培养
将人肝癌细胞C3A(购自美国模式菌种收集中心(ATCC))转移到装有DMEM培养基的离心管内,1 000 r/min的离心条件下离心5 min。舍弃离心后的上清培养液,加入一定量的DMEM培养基,置于二氧化碳培养箱中培养。待细胞贴壁后,每48 h换一次培养基,细胞生长至汇合后,加入适量0.25%的胰蛋白酶溶液,显微镜下观察细胞边界变得清晰时,从培养皿上分离细胞。室温下1 000 r/min离心5 min,舍弃上层清液,然后加入适量完全培养基,用移液器轻轻吹打成单细胞悬液。将消毒的海藻酸钠溶液与C3A单细胞悬液均匀混合,制造海藻酸钠浓度为6%、细胞浓度为约106cells/mL的混合液。
1.6 灌流培养
为了验证打印的微通道能用于灌流并为组织内部的细胞提供营养和氧气,设计了灌流系统,对含微通道结构的支架进行灌流培养。首先,对打印的支架进行了处理,完整的支架模型如图3(a)所示;其次,对支架的两侧进行切除,得到的结构如图3(b)所示,切割后的结构俯视图和侧视图如图3(c)、(d)所示。灌流器的结构如图4(a)、(b)所示,灌流器主要由气体交换口、模具、橡胶密封圈、玻璃盖板、注液口组成。灌流系统原理如图4(c)所示,将切割后的结构嵌入灌流器的凹槽中,凹槽与切割后的结构大小一致。注射器中吸入细胞培养基,并与灌流器的注液口通过聚四氟乙烯管连接。利用注射泵进行循环排液和抽液,培养基流过纵向通道,实现对纵向微通道的灌流。

图3 微通道支架的模型。 (a)完整的支架模型;(b)切割后的支架模型;(c)切割后支架俯视图;(d)切割后支架侧视图Fig.3 Model of microchannel scaffold. (a)Whole scaffold model;(b)Scaffold that has been cut;(c)Vertical view;(d)Side view

图4 灌流设备示意。(a)灌流器透视图;(b)灌流器侧视图;(c)灌流系统原理Fig.4 The schematic diagram of the perfusion equipment. (a)Perspective of the perfusion device;(b)Side view of the perfusion device;(c)The schematic diagram of the perfusion system
1.7 细胞活性检测
将肝细胞封装进海藻酸钠中进行打印。细胞活死染色剂被用于本次实验的细胞生存能力分析,在荧光显微镜下观察染色后的中空细丝,活细胞发出绿色荧光,死细胞发出红色荧光。
2 结果
使用同轴喷头制造中空细丝,海藻酸钠溶液从外针和内针的夹层中挤出,氯化钙溶液从内针中挤出,同轴挤出系统实物如图5(a)所示。结果显示,浓度2%以下的海藻酸溶液由于浓度较低,中空管道容易坍塌,不利于管道的成形。而浓度7%以上的海藻酸钠溶液浓度较高,注射泵需要较大的推力才能挤出,导致出现较大的剪切应力,不利于细胞的存活,因此实验选用的海藻酸钠浓度为2%~7%。

图5 中空细丝的形成。(a)挤出系统实物;(b)显微镜下观察中空细丝的内径和外径;(c)灌流测试;(d)和(e)液体流过中空细丝Fig.5 Printed hollow filaments. (a)Extrusion system;(b)The filament under an inverted microscope;(c)Perfusion test;(d)and(e)The liquid flows through the hollow filaments
将中空细丝放在显微镜下观察(见图5(b)),细丝具有光滑统一的内腔,管壁厚度均匀,管子内径约为0.64 mm,外径约为0.92 mm。如图5(c)所示,利用注射器向中空细丝中注射蓝色溶液,蓝色溶液顺利流过了导管,没有发生泄漏和堵塞,图5(d)、(e)为显微镜下观察到液体流过中空细丝的过程。

图6 材料浓度对细丝尺寸的影响。(a)氯化钙溶液浓度对细丝尺寸的影响;(b)海藻酸钠溶液浓度对细丝尺寸的影响Fig.6 Effect of concentration on hollow filament size. (a)Effect of concentration of calcium chloride on hollow filament size;(b)Effect of Concentration of sodium alginate on hollow filament size
中空细丝的尺寸直接影响立体结构的打印效果,因此预先研究了各制造参数对中空细丝的影响。研究参数包括海藻酸钠的挤出速率、海藻酸钠的浓度、氯化钙溶液的挤出速率、氯化钙溶液的浓度等。图6(a)是使用6%海藻酸钠溶液和不同浓度氯化钙溶液的实验结果。实验结果显示,氯化钙溶液的浓度对中空细丝尺寸没有明显的影响。图6(b)是使用4%氯化钙溶液和不同浓度海藻酸钠溶液的实验结果。实验结果显示,随着海藻酸钠浓度的增加,中空细丝的内径和外径增加,中空细丝的壁厚与海藻酸钠的浓度无明显关系。
随后,研究了海藻酸钠和氯化钙溶液的挤出速率对中空细丝尺寸的影响。图7(a)显示,氯化钙交联剂的流量增加时,细丝的内径增加,外径基本不变,从而产生了更薄的管壁。当海藻酸钠挤出速率小于5 μL/s时,无法形成中空细丝。图7(b)显示,海藻酸钠溶液的流量增加时,细丝的内径减小,外径略微增加,从而产生了更厚的管壁。
在3D打印过程中,打印速度应与出丝速度相匹配,避免细丝的堆积或者过度拉伸,有利于中空细丝的稳定成形。因此,研究了材料的挤出速率对正常出丝速度的影响,如图7(c)、(d)所示,随着氯化钙溶液和海藻酸钠溶液挤出速率的增加,出丝速度增加,与之匹配的打印速度应该随之增加。
由于较厚的管壁会阻碍氧气和营养物质的交换,而过薄的壁厚会影响机械强度和限制细胞封装数量[30]。由以上实验结果得出:使用6%的海藻酸钠和4%的氯化钙溶液,挤出速率分别为7和3 μL/s时,能产生较为理想的中空细丝,此时中空细丝的直径约为0.93 mm,内径约为0.63 mm,壁厚约为0.15 mm,出丝速度约为11 mm/s。
在打印过程中,中空细丝的交联过程从内腔逐渐扩散到外层,可利用外层未交联的海藻酸,使相邻的细丝发生融合。打印丝间距为1 mm的单层结构,相邻细丝的融合的结果如图8(a)所示。结果显示,细丝之间可以发生融合,实现逐层叠加打印。
打印5层层高1 mm、丝间距2.5 mm的网格状结构(50 mm(L)×50 mm(W)×5 mm(H))。对立体结构进行了灌流测试(见图8(b)),注射器向微通道中注射的溶液(蓝色)可通过内部通道从样品中流出,过程中无泄漏和堵塞。图8(c)、(d)为光学相干断层扫描技术(optical coherence tomography,OCT)对打印支架的三维扫描,可以看到垂直相交的立体中空管道。图8(e)为OCT的扫描纵向剖面,可以观察到打印结构的横向通道及纵向通道,细丝的中空结构明显。
3D细胞封装对比常规的二维细胞培养有很多优势,改进了细胞之间的接触与细胞基质的交互。因此,制造了封装有C3A细胞的立体结构,材料为6%的海藻酸钠与106cells/mL的C3A细胞混合液和4%的氯化钙溶液;打印的细胞支架尺寸为30 mm(L)×30 mm(W)×4 mm(H),层高为1 mm,丝间距为1 mm,层数为4层。
支架打印完成后,在2%的氯化钙溶液中浸泡15 s使其完全交联,在PBS中清洗3次,清除残留的氯化钙。对打印结构两侧进行切除,得到30 mm(L)×15 mm(W)×4 mm(H)的长方体。将切割后的结构嵌入灌流器(见图9)中,然后固定好密封玻璃和空气滤帽。注射器中吸入20 mL含有10%胎牛血清的DMEM培养基,灌流器与注射器通过聚四氟乙烯管连接。设置注射泵进行循环排液和抽液,流量为50 μL/s,每次循环的体积为5 mL。
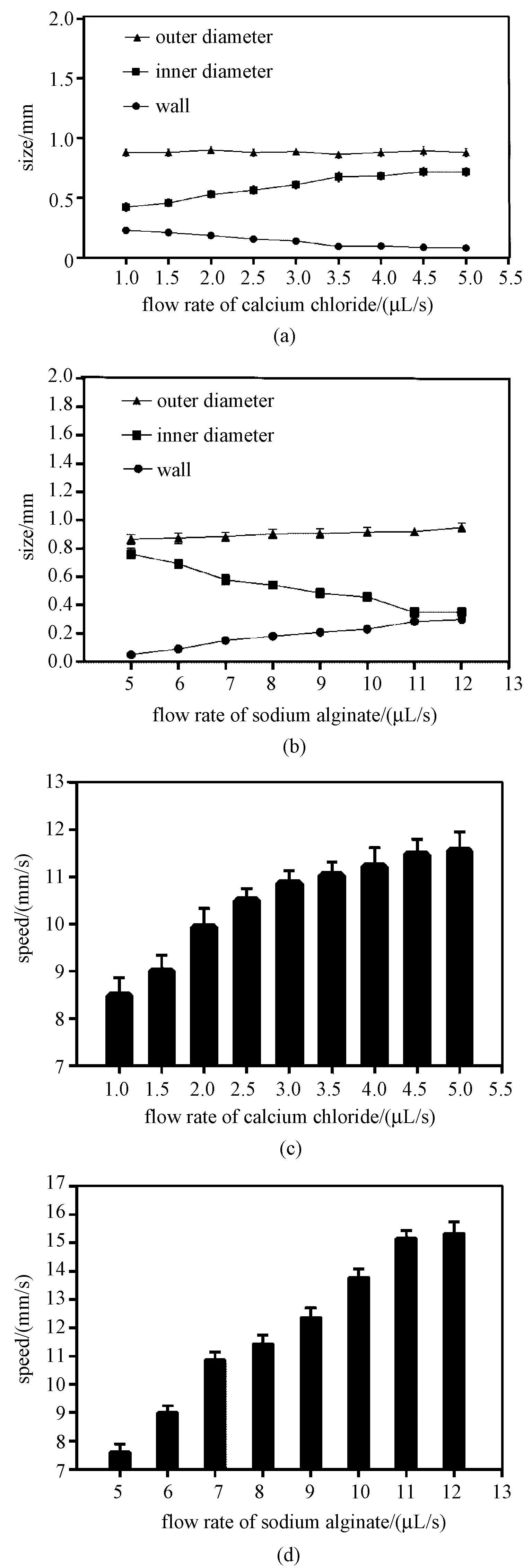
图7 材料的挤出速率对细丝的影响。(a)氯化钙溶液挤出速率对细丝尺寸的影响;(b)海藻酸钠溶液挤出速率对细丝尺寸的影响;(c)氯化钙溶液挤出速率对出丝速度的影响;(d)海藻酸钠溶液挤出速率对出丝速度的影响Fig.7 Effect of flow rate on hollow filament. (a)Effect of calcium chloride flow rate on hollow filament size;(b)Effect of sodium alginate flow rate on hollow filament size;(c)Effect of calcium chloride flow rate on velocity of wire;(d)Effect of sodium alginate flow rate on velocity of wire

图8 立体结构观察。(a)显微镜下观察细丝的融合截面;(b)立体结构的灌流测试;(c)和(d)OCT三维扫描;(e)OCT扫描纵向剖面Fig.8 The 3D structure. (a)Observe fusion under an inverted microscope;(b)Perfusion test;(c)and(d)Three-dimensional scan by OCT;(e)Cutaway scan by OCT

图9 灌流系统实物Fig.9 Perfusion system

图10 封装进C3A细胞的中空细丝。(a)和(b)显微镜观察细胞分布;(c)和(d)荧光显微镜观察细胞存活率Fig.10 C3A cells encapsulated in hollow filaments. (a)and(b)Observe Cell by microscope;(c)and(d) Observe cell survival rate by fluorescence microscope
图10为常规培养1 d的中空细丝染色后在荧光显微镜下观察到的图像。从图10(a)、(b)中可以看出,肝细胞均匀分布在中空细丝的管壁中;图10(c)、(d)表明,活细胞(绿点)的数量远大于死亡的细胞(红点)。
实验组将灌流器置于二氧化碳培养箱中,灌流培养期间每24 h更换一次培养基;对照组将同样的肝组织置于二氧化碳培养箱中常规培养,每24 h更换一次培养基。使用细胞活死染色剂对支架染色15 min,之后用PBS清洗3次。染色后的支架在荧光显微镜下观察,计算出细胞存活率,表示为活细胞占总细胞数量的百分比。

图11 细胞存活率变化Fig.11 Cell survival rate after fabricating
培养24、48、72 h后,分别对灌流培养组和非灌流培养组纵向通道周围的细胞进行了活性分析。图11为灌流组和非灌流组细胞存活率的变化,灌流组的细胞存活率分别为:24 h后90%±2.8%,48 h后88%±4.1%,72 h后86%±2.7%。非灌流组的细胞生存率分别为:24 h后88%±2.1%,48 h后83%±4.7%,72 h后70%±3.1%。
3 讨论
相比传统的基于牺牲材料的管道制造方法,基于同轴喷头的管道制造方法有以下几个优势:无后处理步骤,对细胞损伤小,灵活性较高,能直接生物打印复杂的介质交换网络。但此方法也有其局限性,如制造的管道尺寸有限,无法直接生成分叉的管道[30],等等。
在对中空细丝的研究中发现,同轴喷头的外针略长于内针,有利于中空细丝的稳定成形。同时由于外针长于内针,中空细丝的外径受到外针的限制,改变材料浓度、材料挤出速率等参数时,中空细丝的外径变化较小。增加海藻酸钠的挤出速率时,增加了单位时间内生物材料的挤出体积,从而产生了更厚的管壁,并增加了出丝速度。增加交联剂的挤出速率时,使交联剂对管壁产生更大的径向压力,从而产生了更薄的管壁,并增加了出丝速度。
通过编程打印机移动轴的运动路径,使持续挤出的中空细丝堆叠成预期的3D结构,在结构内部制造了复杂的立体通道。实验表明,细丝之间能相互融合,对立体结构的灌流测试显示,在打印路径的拐角处以及层与层之间的连接处,细丝依旧保持内部通道的完整。这表明,此打印方法未来有潜力生成弯曲的血管结构,模拟生物体弯曲的血管。用OCT技术对立体结构进行观察,进一步清晰地展示了一个完整互连的内部通道。虽然细丝叠层部位显示轻微变形,但未出现管道破裂、堵塞等现象。
将肝细胞封装进海藻酸钠中进行打印,细丝中的细胞存活率较高,表明中空细丝的挤出过程并未对细胞造成明显的损伤。随后,对含细胞的微通道支架进行灌流培养,灌流组和非灌流组纵向通道周围细胞的生存环境形成对比。由于非灌流组中纵向通道内的培养基无法充分流动,细胞无法获得足够的氧气和营养物质;而灌流组的纵向通道内的培养基充分循环流动,为细胞进行营养物质传输和废弃物排放。因此,灌流组的细胞存活率高于非灌流组,随着培养时间的增加,细胞存活率差异越来越大。
4 结论
本研究利用同轴挤出系统制造封装肝细胞的中空细丝,结合生物3D打印系统,叠层制造含微通道网络的肝组织。对中空细丝的研究表明,控制材料的浓度和挤出速率可以改变中空细丝的尺寸和出丝速度。得出较理想的制造参数为:6%的海藻酸钠和4%的氯化钙溶液,挤出速率分别为7和3 μL/s,喷头移动速度为11 mm/s。
叠层制造过程中,中空细丝之间有效融合,且支架内部的立体通道完整。打印过程对细胞的损伤小,细胞存活率较高。灌流组和非灌流组在培养72 h后,细胞活性有显著的差异,证明了对微通道灌流可以提高微通道周围肝细胞的存活率。相比其他管道制造方法,本打印系统有明显的优势,未来有较大的潜力用于制造血管化的人工组织。
