甲基硫菌灵降解菌的筛选与鉴定
2019-01-19马俊红周厚发雷丽萍
马俊红 周厚发 雷丽萍

摘要:为筛选出具有降解甲基硫菌灵能力的菌株,并对甲基硫菌灵的降解效果进行评价,采集云南各地植烟土壤样品,在以甲基硫菌灵为单一碳源的选择性培养基中富集微生物,用梯度稀释法分离出451株农药降解菌株。通过摇瓶培养和高效液相色谱法从451株菌株中筛选得到降解效率在80%以上的20株菌株。继续对菌株的甲基硫菌灵降解能力进行温室和田间筛选,结果表明,田间烟草施用甲基硫菌灵降解菌7 d后,参试的20株细菌均有降解甲基硫菌灵的效果,降低幅度为14.45%~91.84%。其中TP247、TP185、TP243、TP208、TP416等5株菌降解效果较好,分别为 91.84%、90.34%、89.54%、87.33%、85.50%,具有大面积应用推广潜力。
关键词:甲基硫菌灵;降解菌;高效液相色谱法;降解率
中图分类号: S481+.8;X592 文献标志码: A 文章编号:1002-1302(2019)22-0298-05
甲基硫菌灵别称甲基托布津,是一种具有内吸性强、高效低毒、安全广谱等优点的强力杀菌剂,是在烟草上登记使用的农药之一,主要用于烟草白粉病、根黑腐病等的防治[1]。目前,化学防治是烟草病虫害防治的主要措施之一,广泛大量和长期使用化学农药造成了烟叶中农药残留量的增加。烟草虽然不被直接食用,但其在燃烧过程中会发生大量复杂的化学反应,残留农药会直接或间接参与其中[1-2],因此,农药残留问题已经引起烟草界和全社会的广泛关注。
目前国内外农药残留降解方法主要有超声波技术、吸附、洗涤和电离辐射等物理方法,水解、氧化分解和光化学降解等化学方法,微生物、降解酶和工程菌等生物降解方法[3]。微生物降解被公认为是一种有效、廉价、无二次污染的方法,具有操作简便、繁殖快、生态恢复性好等优点[4-5]。早在20世界80年代密歇根州立大学的James Tiedje实验室,就首次从污染的河泥中分离出了具有脱氯功能的厌氧微生物[6-7]。迄今为止,各国科研人员已经从土壤、污泥、污水、天然水体、垃圾场和厩肥中分离到降解多种农药的活性微生物[8]。甲基硫菌灵是在烟叶农残中检出率较高的农药之一,控制该农药残留量意义重大。本研究对甲基硫菌灵农药降解菌进行分离、筛选、初步鉴定以及温室和田间筛选,为烟叶和植烟土壤中甲基硫菌灵农药污染的治理奠定基础。
1 材料与方法
1.1 供試材料
1.1.1 土壤样品 试验于2014年1月至2016年12月在云南省烟草农业科学研究院研和试验基地进行。本试验用土壤采集自云南省昆明市、曲靖市、玉溪市、昭通市、丽江市、普洱市、保山市、临沧市、楚雄州、红河州、迪庆州、文山州、西双版纳州、大理州、德宏州、怒江州等16州(市)植烟土壤,共500份。
1.1.2 培养基 M9培养基配制:分别称取3 g Na2HPO4、1.5 g KH2PO4、0.5 g NH4Cl,加500 mL蒸馏水,用NaOH调节pH值至7.4,配制固体平板时加入7~8 g/L琼脂粉,121 ℃高压灭菌,待温度冷却至50~60 ℃时分别加入0.5 mL 1 mol/L 的CaCl2和MgSO4·7H2O,终浓度为0.1%的甲基硫菌灵;LB液体培养基:5 g酵母粉,10 g蛋白胨,10 g NaCl,蒸馏水定容至1 000 mL,pH值=7.0,固体培养基加琼脂2%,121 ℃高压蒸汽灭菌25 min。
1.1.3 供试烟草 供试烟草品种为云烟87,旺长期的烟株用于温室和田间甲基硫菌灵降解菌的筛选。
1.1.4 供试农药 70%甲基硫菌灵可湿性粉剂,1 000倍液喷雾。
1.2 试验方法
1.2.1 甲基硫菌灵降解菌分离和纯化 量取45 mL纯净水盛于三角瓶内,在121 ℃高压蒸汽灭菌20 min。称取5 g土样放入灭菌的三角瓶内,置于30 ℃、150 r/min摇床摇培 30 min,静置10 min,取200 L上清液涂布于M9平板,置于 37 ℃ 恒温培养箱培养7 d,挑选单菌落划线于LB平板,纯化后获得单菌落,液体摇培并用20%甘油重悬浮,置于-80 ℃条件下保藏。
1.2.2 甲基硫菌灵降解菌的筛选 称取6 g甲基硫菌灵粉剂溶于1 000 mL丙酮,配制成0.6%甲基硫菌灵母液。取已灭菌好的LB液体培养基5 mL于试管内,接种甲基硫菌灵降解菌于三角瓶中培养1 d后,加入1 mL甲基硫菌灵母液,置于30 ℃、150 r/min摇床培养3 d后检测菌液中甲基硫菌灵含量,评价各菌株的降解效果。
1.2.3 甲基硫菌灵含量测定 样品处理:培养菌液 5 000 r/min 离心10 min去除沉淀,用0.45 m滤膜过滤上清液,取10 L样品经高效液相色谱仪分析;测定色谱分析条件:试验采用ZORBAX Eclipse XDB-C18(4.6 mm×250 mm,5 μm)色谱柱,柱温为30.0 ℃,检测波长为266 nm,参比波长为400 nm,流动相的A相为CH3OH、B相为H2O、C相为CH3CN,流速 1 mL/min,每次进样量10.0 μL,洗脱程序见表1。
1.2.4 甲基硫菌灵降解菌株的鉴定 将降解甲基硫菌灵效果较好的37株菌,PCR扩增16S rDNA片段。PCR产物纯化后进行序列测定。将所得序列与EzBilCloud数据库(http://www.ezbiocloud.net/eztaxon/identify)中标准菌株序列进行BLASTn分析,比较序列同源性。
1.2.5 甲基硫菌灵降解菌温室筛选 使用室内筛选出的甲基硫菌灵降解菌,分别用100 mL LB培养基30 ℃摇培3 d,离心去除培养基,沉淀用无菌水悬浮,调整到菌体含量为 108 CFU/mL 备用。
农药喷施1 d后,喷施不同菌悬液,每株菌处理3株烟,设不施菌的处理为对照(3株)。分别于降解菌处理14 d后取烟叶样品,每次每烟株取3张叶,相同处理的烟叶样品计数1份样品,取样时所取烟叶部位相同。样品采集后,将其置于烘箱内105 ℃杀青30 min,60 ℃条件下烘干,去中脉,粉碎过20目筛,检测甲基硫菌灵含量。
1.2.6 甲基硫菌灵降解菌田间筛选 使用温室内筛选的甲基硫菌灵降解菌进行田间筛选,降解菌处理14 d后取烟叶样品测试农药残留量,田间管理、样品采集和检测方法同 “1.2.5” 节。
2 结果与分析
2.1 甲基硫菌灵降解菌分离
以甲基硫菌灵为唯一碳源的培养基,采用稀释平板法分离500份土样,分离到451株菌株。分离结果表明,土壤样品中能降解甲基硫菌灵的可培养微生物较少,43.6%的土样仅能分离到1株菌株,有36.4%的样品不能分离到降解菌,能分离2株以上菌株的土样仅占总土样的20%。土壤样品最多仅能分离到4株降解甲基硫菌灵的菌株,占总土样的1.6%,仅有8份土样。通过对500个土样进行分离试验,以甲基硫菌灵为唯一碳源,只能生长出1个菌的土样所占数量最多,其次1个菌都不能长的土样所占的比例也比较大。
2.2 甲基硫菌灵降解菌液体培养筛选
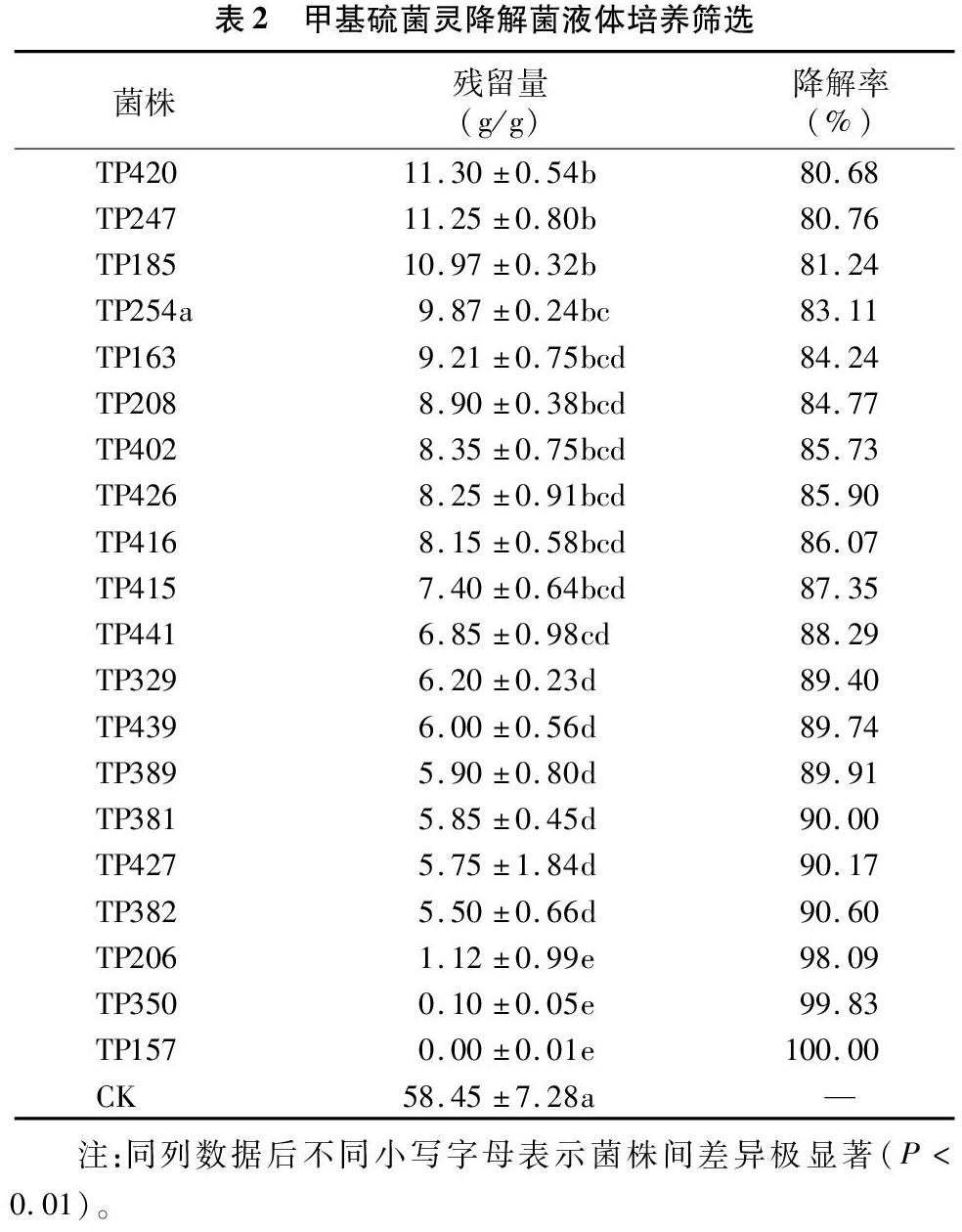
甲基硫菌灵降解菌液体培养筛选结果表明,菌株降解率差异较大,对甲基硫菌灵降解率在80%以上的菌株共有20株,分别为TP157、TP350、TP206、TP382、TP427、TP381、TP389、TP439、TP329、TP441、TP415、TP416、TP426、TP402、TP208、TP163、TP254a、TP185、TP247、TP420(表2),可以用于后续试验,具有进一步研究和应用的价值。
在以甲基硫菌灵为唯一碳源下能够生长的451株菌中,其中413株菌的降解率在50%以下,所占比例高达91.6%;降解率在50%~90%之间的菌有30株,所占比例为6.7%;降解率在85%以上的菌有14株,所占比例仅为3.1%,其中有3株菌(TP157、TP206、TP350)的降解率在98%以上,降解能力极强。
2.3 甲基硫菌灵降解菌菌株的鉴定
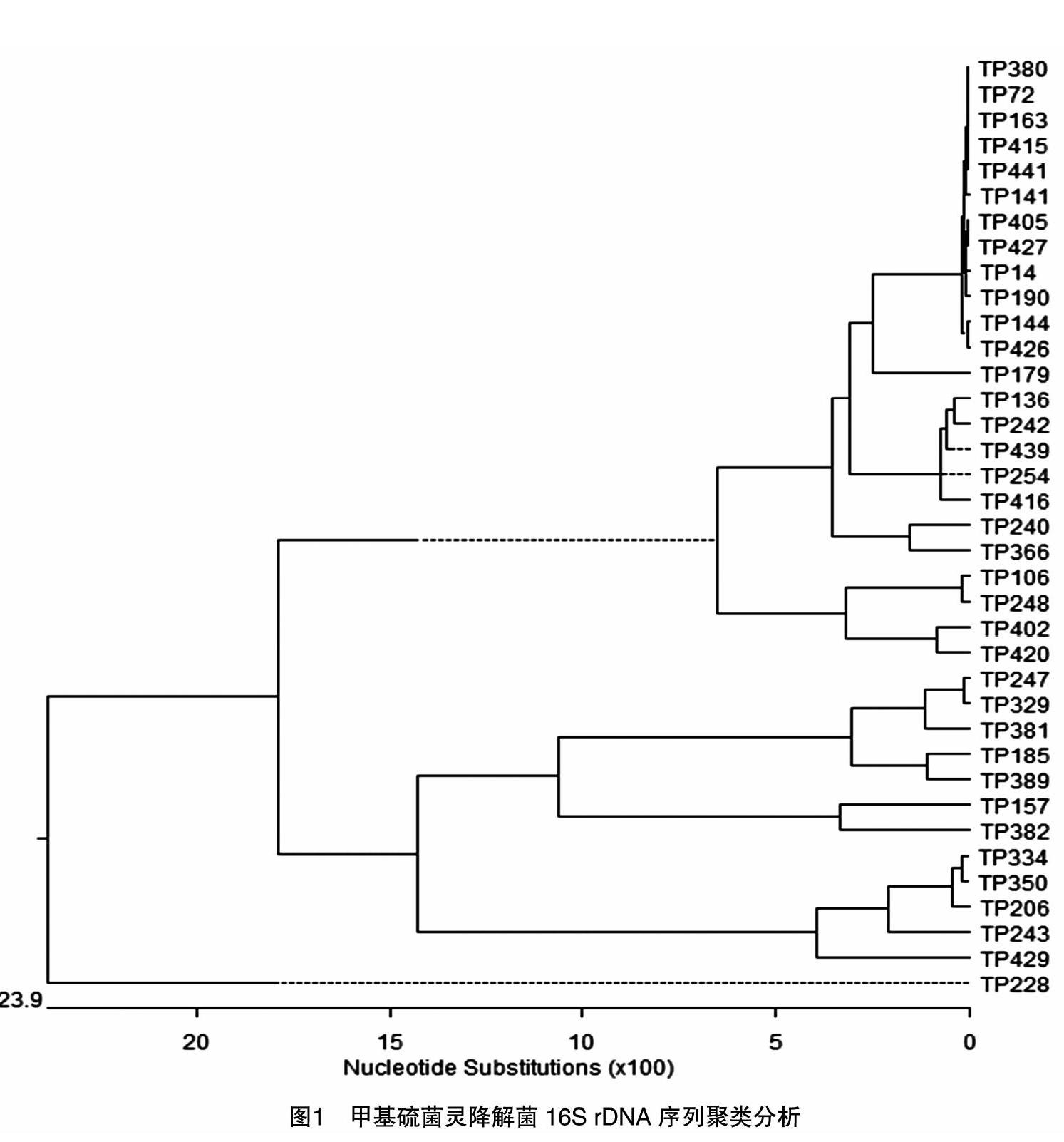
通过16S rDNA序列聚类(图1),可将37株甲基硫菌灵降解菌在0.1水平差异上分为5个类群,大多数菌集中在第1个类群中,含有24株細菌。TP228与其他菌株差异较大。运用EZbiocloud数据库,将所测菌株的16S rDNA序列与标准株序列进行比对。分析表明,所测的37株菌归属于3门、4纲和5目(表3),总体上看,分离的菌株涉及11个属、21个种细菌。有1株菌属于放线菌门纤维菌属,23株菌属于壁厚菌门芽孢杆菌属、类芽孢杆菌属下11种,13株菌属于变形菌门苍白杆菌属和耐寒短杆菌等9个属(表3)。综上所述,芽孢杆菌属、类芽孢杆菌属和苍白杆菌属占测试菌株的比例较大,为优势菌。
通过16S rDNA序列分析,室内筛选中获得的甲基硫菌灵降解率在98%以上的菌株有TP157、TP206、TP350,其中TP157属于假单胞菌属,TP206和TP350都属于苍白杆菌属,三者都属于变形菌门。
2.4 甲基硫菌灵降解菌的温室筛选
喷施室内筛选的20株高效降解甲基硫菌灵菌株14 d后,未处理的对照中可检测出大量的甲基硫菌灵残留,而经降解菌株处理后,除TP106处理的烟叶中农药残留量与对照无明显差异,TP179烟叶中农药残留量高于对照外,其他18株菌处理的样品中的农药残留量均有不同程度的降低,降解率范围在 6.29%~52.40%,其中TP185、TP382、TP208、TP389、TP420和TP243等6株菌温室降解甲基硫菌灵的降解率在40%以上,TP185和TP382降解菌甲基硫菌灵降解率在50%以上。
2.5 甲基硫菌灵降解菌田间筛选试验
试验表明,田间烟草施用甲基硫菌灵降解菌14 d后,参试的20株细菌均有降解农药的效果,降低幅度为14.45%~91.84%。TP179、TP350、TP106、TP382、TP405、TP381、TP254、TP242、TP206、TP163、TP416、TP208、TP243、TP185、TP247等15株细菌的田间降解率大于50%,其中TP247、TP185、TP243、TP208、TP416等5株菌降解效果较好,降解率分别为91.84%、90.34%、89.54%、87.33%、85.50%,具有大面积应用推广潜力,须研究其生物安全性和应用前景(表5)。
3 结论与讨论
甲基硫菌灵是一种广谱性内吸低毒杀菌剂,具有内吸、预防和治疗作用,在烟草生产中常用于真菌类病害的防治。由于其具有内吸性,并在烟株体内转化成多菌灵[9],因此更容易形成残留。本研究中未测定烟叶中多菌灵的含量,无论对空白对照还是试验处理均只测定烟叶上甲基硫菌灵的残留量,具有可比性,可将筛选出的菌株应用于减少土壤中甲基硫菌灵的残留。此外,本研究采集的云南省各州(市)烟区喷洒过甲基硫菌灵的土壤中所含降解甲基硫菌灵的菌株较少,这可能是由于甲基硫菌灵降解速度缓慢,易于富集,在烟叶和土壤中残留量较大,研发有效的甲基硫菌灵降解微生物制剂用于减少该农药残留具有广阔的应用前景。
土壤中的微生物具有种类多、变异快、适应强等特点,是生物修复的重要资源。细菌由于具有适应能力强、易诱变的特点,在农药降解中占据着重要的地位。目前,已分离出来的能降解农药的细菌主要有假单胞菌属、芽孢杆菌属、黄杆菌属、产碱菌属、节细菌属等[10-13],本研究通过田间筛选出的降解率高于85%的菌株有TP247、TP185、TP243、TP208和TP416,分别属于克雷伯菌属、短小杆菌属、苍白杆菌属、固氮螺菌属和芽孢杆菌,除芽孢杆菌属和苍白杆菌属之外[14],其他3个属鲜有报道。
在液态培养环境下,TP157、TP350和TP206菌株降解甲基硫菌灵的能力较强,降解效率均在98%以上,在温室条件下,其降解率均降低至35%以下,在田间条件下,其降解率分别为14.45%、55.84%、78.61%。说明降解菌生长繁殖和对靶标农药的降解受到环境因素(如温度、湿度、光照等)的影响较大。深入研究农药降解菌菌株的降解特性、研发适合菌株施用的剂型,将极大地提升菌株降解农药残留的能力。如何将筛选出的高效甲基硫菌灵降解菌应用于实际生产有待于进一步研究。
在自然界中存在着丰富的能够降解甲基硫菌灵的微生物。用梯度稀释法分离筛选出451株农药降解菌株。通过摇瓶培养和高效液相色谱法复筛得到降解效率在80%以上的20株菌株。然后通过田间试验发现,参试的20株细菌均有降解甲基硫菌灵的效果,降低幅度为14.45%~91.84%。其中TP247、TP185、TP243、TP208、TP416等5株菌降解效果较好,降解率分别为91.84%、90.34%、89.54%、87.33%、85.50%,可作为甲基硫菌灵降解菌生物制剂的备选菌株。
参考文献:
[1]李义强,周杨全,徐金丽,等. 烟叶中多菌灵农药残留的降解规律和影响因素[J]. 中国烟草学报,2017,23(4):40-49.
[2]王津军,文国松,丁金玲,等. 烟草农药残留研究进展及降低烟叶农药残留的探讨[J]. 云南农业大学学报,2006,21(3):329-332.
[3]陳少华,罗建军,林庆胜,等. 农药残留降解方法研究进展[J]. 安徽农业科学,2009,37(1):343-345.
[4]尤民生,刘 新. 农药污染的生物降解与生物修复[J]. 生态学杂志,2004,23(1):73-77.
[5]李晓飞,夏振远,雷丽萍,等. 福美双农药降解菌的分离与筛选[J]. 基因组学与应用生物学,2016,35(1):137-142.
[6]Omenn G S,Colwell R R. Environmental biotechnology:reducing risks from environmental chemicals through biotechnology[M]. New York:Plenum Press,1988:505.
[7]王银善,庞学民. 农药甲胺磷的微生物降解[J]. 环境科学学报,1985,5(3):315-321.
[8]李玉梅,王根林,于洪久,等. 土壤农药残留微生物降解研究进展[J]. 北方园艺,2007(4):72-74.
[9]田丽梅,向 明,耿永勤. 前处理方法对烟草中多菌灵和甲基硫菌灵残留测定的影响[J]. 广州化工,2017,45(22):102-103.
[10]亓文静. 有机磷农药降解菌的筛选、分离鉴定及其降解动力学特性研究[D]. 兰州:兰州理工大学,2007:6-12.
[11]刘玉焕,钟英长. 甲胺磷降解真菌的研究[J]. 中国环境科学,1999:19(2):172-175.
[12]张金萍. 微生物降解农药残留技术研究[J]. 种子科技,2017(3):84-85.
[13]仪美芹,王开运,姜兴印,等. 微生物降解农药的研究进展[J]. 山东农业大学学报(自然科学版),2002,33(4):519-524.
[14]柏文琴,李 梅,邱星辉,等. 苍白杆菌B2对甲基对硫磷降解途径研究[J]. 农药学学报,2004,6(4):48-54.
