人工湿地中生物修复污水的应用与研究进展
2019-01-19刘冉兰汝佳赵海燕
刘冉 兰汝佳 赵海燕


摘要:随着城市化进程及工农业的发展,水土环境污染问题不断加剧。人工湿地的构建是一种高效、可持续的面源污染协同修复途径,人工湿地主要利用植物和微生物联合机制对水污染的环境进行修复,成本低、能耗少、管理运营方便且环境友好,是一种大有潜力的污水修复技术。本文阐述了人工湿地中各个组成的作用和机制,并对未来人工湿地中生物修复需要开展的研究作了分析和展望。
关键词:人工湿地;面源污染;富营养化;生物修复;研究进展
中图分类号: X71;X171.4 文献标志码: A 文章编号:1002-1302(2019)22-0030-07
近20余年来,随着城市化进程深入和工农业的迅猛发展,我国水土环境污染问题不断加剧,并威胁以农-林-水为要素的复合生态系统的生态安全,在长三角地区尤为突出[1]。归纳起来,主要问题表现为以下3个方面:(1)水土环境中重金属、有机污染严重,土壤质量下降,影响农业生产;(2)农业面源污染形势严峻,对区域水土环境产生威胁;(3)水土环境恶化及不合理开发导致生物栖息地丧失,生物多样性下降。
面源污染形势日益严峻,对区域水土环境产生威胁。我国农业源的化学需氧量(chemical oxygen demand,COD)、全氮(total nitrogen,TN)和全磷(total phosphorus,TP)排放量已经超过生活源和工业源,成为我国主要污染源[2]。目前,我国农业污染面临局部改善、整体加剧、环境约束加深的态势,如何保证在农业可持續发展和粮食稳产高产的条件下防治农业面源污染,是我国当前面临的不得不解决的难题。农业生产中农药、化肥、地膜等的不合理或过量使用,是面源污染的主要来源之一[3];畜禽养殖业中畜禽粪便若不经任何无害化处理就直接排放,不仅污染养殖场周围环境,导致大气污染,更是我国江河湖泊等水体富营养化的主要污染源[4]。水产养殖密度的不断加大,导致养殖环境恶化加剧,养殖病害增多,使得大面积死鱼等现象频频发生;抗生素的滥用影响水产品品质及水体质量,导致养殖水体污染加剧,TN、TP等营养素增多,影响养殖业的同时又会污染周边水域,这些问题严重限制了养殖业的可持续发展[5-6]。生活垃圾及工业三废(废水、废气、废渣)的排放也加剧了面源污染,并进入食物链,危害人类身体健康、生活质量和生命安全。在自然降水或农田灌溉中,污染物容易进入附近水体,导致农业面源污染问题日益严峻和突出。
面源污染中主要污染物是N、P等,实现N、P的循环利用,不仅可以减少环境污染,也可补充农作物生产所需养分,实现污染生态治理与养分高效利用的双赢,对我国这样一个资源短缺国家的发展是非常重要的。因此,从发展趋势来看,在单项技术突破的基础上,对面源污染实行系统控制,实施污染源头减量(reduce)-前置阻断(retain)-循环利用(reuse)-生态修复(restore)的4R技术体系,可实现对全类型、全过程、全流域(区域)的控制,是我国农业面源污染治理的重要发展方向。为此,人工湿地应运而生。
1 人工湿地及其应用概述
1.1 人工湿地概况
人工湿地(constructed wetlands)是模拟自然湿地机制的人工生态工程化的地面,可利用物理、化学和生物的协同作用对污水开展净化,效果稳定,且具有投资小、能耗低、节水、供肥、运行管理方便等优点。人工湿地对天然湿地在功能方面进行了强化,并对天然湿地进行了一些补充及恢复建设,可以明显增强污水净化能力[7-9],其主要利用土壤、人工介质、植物、微生物的物理、化学、生物三重协同作用对污水等进行处理;其作用机制主要包括吸附、滞留、过滤、氧化还原、沉淀、微生物分解、转化、植物遮蔽、残留物积累、养分吸收及各类动物的作用,以此来去除流经污水中的悬浮物、有机物、病原体、营养素和重金属等。按结构特点可分为表面流人工湿地(surface flow constructed wetland,FWS)、潜流人工湿地(subsurface-flow constructed wetland,SSF)和混合流人工湿地(hybrid flow constructed wetland,HFS)[7],其中SSF又包括水平潜流人工湿地(horizontal subsurface flow wetland,HSSF)(图1)[8]和垂直潜流人工湿地(vertical-flow constructed wetland,VSSF)[9]。在处理各种污水的过程中多种类型的湿地可以单独使用,也可以结合使用,合理结合不同类型的湿地构建循环水系统可以使系统具有更好的稳定性和净水效果。
1.2 人工湿地处理污水现状与研究
人工湿地系统的研究与应用在很多发达国家起步较早,已取得显著成效,但在发展中国家应用很少,技术发展也很缓慢。在很多发展中国家,污水废水处理的基础设施十分落后甚至没有建设,这造成大量废水被直接排入江河湖海,浪费了大量可循环使用的水资源,同时对河流湖泊和海洋都造成了极大的污染。人工湿地废水处理系统是一种污水净化再循环使用的工程设施,包括生物、化学、物理等多个处理模块[7-9]。近年来,随着人们对生态环境的重视,人工湿地废水处理系统以其低成本、可持续、再循环的优势,作为新兴的战略措施正在发展中国家兴起[10]。
人工湿地已被成功用于减轻环境污染,如去除废水中种类繁多的污染物,包括有机物、悬浮物、病原体、重金属和养分等,其去除效率高、成本低、操作简单,能够对养分和水分进行再利用,成为越来越受欢迎的污水处理技术[11]。Gill等依托高速公路构建人工湿地,9年中对污水中镉(Cd)、铜(Cu)、铅(Pb)和锌(Zn)的去除率分别达到5%、60%、31%和86%[12]。Yang等利用人工湿地系统净化农业径流,减少富营养化农业径流流入河流湖泊对其造成的污染[13];Bezbaruah等利用人工湿地对污水进行脱硫脱氮,比利用生物硝化反硝化进行脱硫脱氮更节约成本[14];Chen等利用人工湿地工程处理工业废水,对COD、悬浮物(suspended solids,SS)、总磷、铵态氮(NH4+-N)去除率分别可以达到61%、81%、56%、35%[15];而Zhai等利用混合人工湿地对COD、SS、TP和NH4+的去除率可以分别达到84%、95%、72%和68%[16];Nahlik等研究了5个热带地区由水生植物构建的湿地,比较其处理污水中有机物和营养素的效力,分别对乳牛场、乳品加工场、造纸厂、垃圾填埋地的污水进行处理,结果发现,5个湿地系统中有4个能够在排入河流之前有效降低废水中的营养素水平[17]。
2 人工湿地处理污水的生物机制
污水的生物修复技术多种多样,河川湖泊池塘本身就具有一定的自净作用,一些N、P营养盐在水生生物世代更替中会随着死亡个体形成有机碎屑沉降在底泥中,另外一些被转化为水生动物的有机组成部分,在营养盐沉积作用中显示出一定的自净效果。植物修复指利用植物转移、容纳或转化污染物,消除或降低污染强度,达到修复环境的目的[18]。水环境植物修复中的植物包括沉水植物、挺水植物等,植物在生长过程中通过一系列生理生态过程,如植株增高、根系伸长、生物量积累等对污水、废水中的营养物质进行积累富集,植物根系也会吸收、沉淀水中的污染物,从而达到修复目的。另一种有效的生物修复手段则是微生物修复,微生物修复是目前污染环境生物修复的主要形式,微生物或提取物对环境污染物具有吸收、转化、降解等功能,可以对养殖污水中的营养素和重金属等污染物质进行转化或降解,且可以抑制有害微生物的生长或繁殖,从而降低养殖塘中鱼类的病害发生概率[5]。另外还可依赖养殖鱼类自身的生长能力进行水质改良,如通过放养一定密度的鲢鱼、鳙鱼等滤食性食藻鱼类,减少水体中的浮游植物,或者使水体浮游植物向小型化发展等[19]。
2.1 人工湿地中植物的作用
湿地植物泛指生长在过度潮湿环境中的植物,其生长易受到介质、气候等条件的影响,吸收污染物的能力也随生长与生理活动状态的变化而变化,因而在不同条件下其污水净化效果也不一样。人工湿地选择的植物必须要适应当地的土壤和气候条件。因各种湿地植物对不同污染物的去除效果各有差异,所以多种植物组合使用,将更有利于各种污染物的全面清除,从而提高湿地系统的污水净化能力。目前人工湿地植物研究的重点已从凤眼莲(即水葫芦)转移到芦苇和香蒲上,芦苇和香蒲既是我国北方与南方的常见物种,也是国际公认的最佳湿地植物,在人工湿地中得到越来越广泛的应用[20-21]。陈永华等在综合应用原有各种湿地植物筛选与评价指标的基础上,增加植物逆境酶和基质酶评价指标进行聚类分析和综合评价,把17种植物分为3类,第1类为具有较强净化能力的植物,即芦苇、千屈菜、美人蕉、风车草、水葱、再力花和花叶美人蕉等;第2类为具有中等净化能力的植物,即菖蒲、芦竹、香蒲和梭鱼草等;第3类为具有较弱净化能力的植物,即鸢尾、野芋、灯心草、葱兰、泽泻和花菖蒲等[22]。
植物是人工湿地的基本组成部分,可利用大型植物或根茎类植物等去除污染物,如富集、转移、稳定或转化在土壤、沉积物和水中的污染物,去除方式包括其根系对污染物的吸收、过滤、蒸发(植物挥发)和微生物降解[23],从而达到彻底去除污染物的目的[24-26]。植物修复是一种绿色环保、低成本、节能节约的污水处理技术。植物修复有多种类型,对不同的污染物有不同的作用机制,如植物提取,即植物从土壤、水和沉积物中吸收和积累富集氮、磷、金属、有毒元素等;植物降解,即利用植物降解转化土壤、水和沉积物中的有机污染物;植物稳定化,即利用超累积植物或耐重金属植物降低重金属的活性,通过植物吸附和植物根际作用降低重金属生物有效性,从而阻止重金属进入水体和食物链[27]。
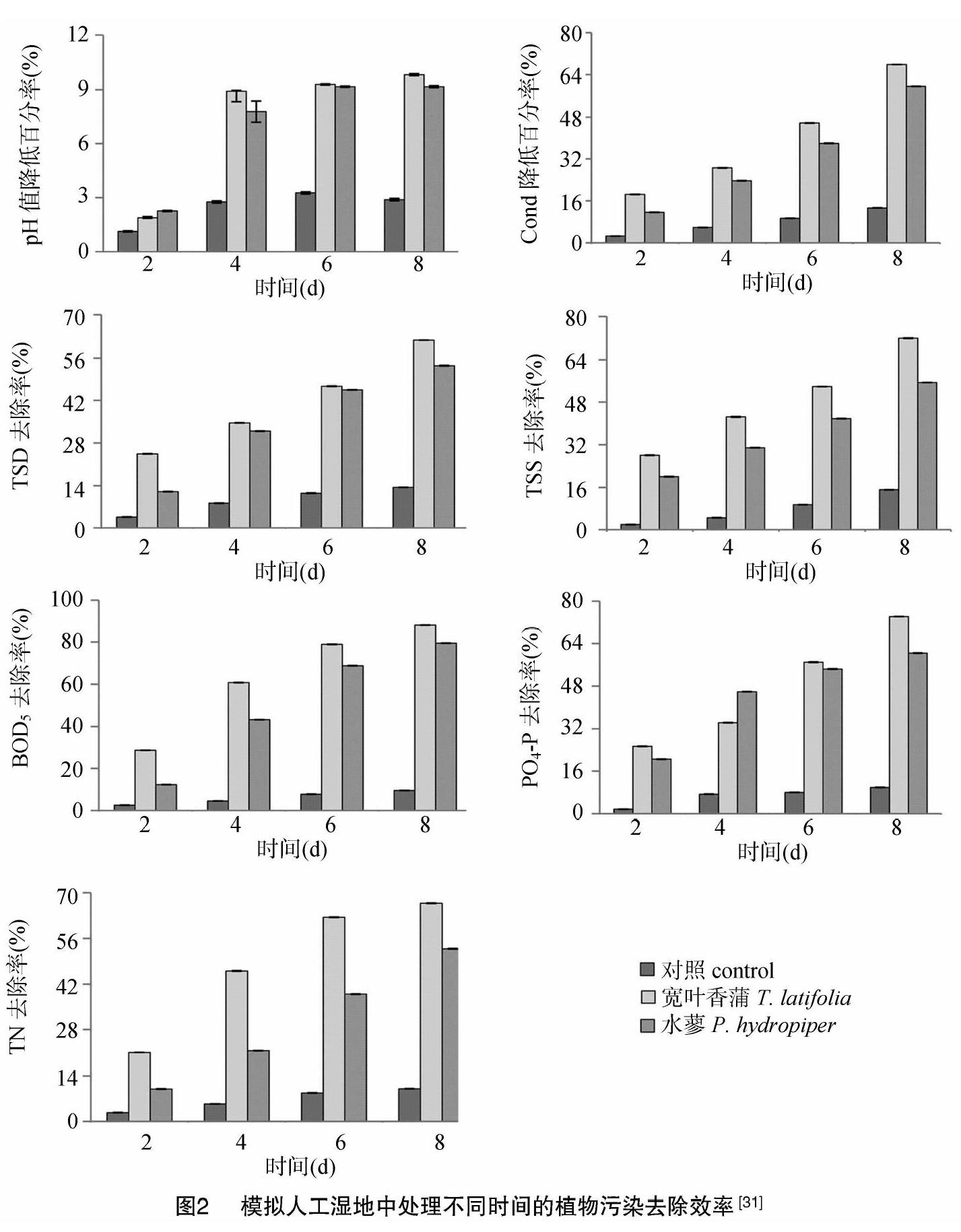
植物修复技术的优点是可以原位处理污染土壤、沉积物、地下水、地表水和外部大气,在人工湿地中利用植物处理污水具有明显的效果,欧洲一些国家应用该系统处理包括工业废水在内的多种类型污水,都有显著的效果[28]。例如在人工湿地系统中利用大藻属和浮萍属等漂浮型大型植物对乳品厂废水中的悬浮物进行处理,总悬浮物去除的平均总体效率为86%,浮萍系统还可以在TN含量为73%~97%或TP含量为63%~99%的废水中去除50%~60%的TN和TP[29]。Krishna等的研究显示,废水处理系统在最佳的调控和环境条件下,COD、生化需氧量(BOD5)、铵态氮、TN、总悬浮固体(TSS)的移除效率分别高达84%、88%、68%、58%、87%[30]。Upadhyay等在砂砾基质上种植宽叶香蒲(Typha latifolia)和水蓼(Polygonum hydropiper),構建人工湿地,结果发现,宽叶香蒲的BOD5、溶解性总固体(TDS)、TSS、PO4-P、TN去除率分别达到88%、60%、70%、72%、65%,而水蓼对这些物质的去除率分别达到79%、50%、53%、60%、53%,2种植物的种植均可有效降低废水pH值和电导率(Cond)(图2);另外,宽叶香蒲和水蓼都可以吸附金属元素,尤其是它们的根系,宽叶香蒲根富集的Zn、Cu、Pb、Cr含量分别高达40.44、39.24、3778、19.95 μg/g,而水蓼根对它们的富集含量分别为1785、33.43、36.19、9.67 μg/g;而且,植株的重金属转运系数比较高,因此,人工湿地在有效去除污染物的同时,还兼顾了环境友好和低成本运作[8]。Sharain-Liew等利用狭叶香蒲(Typha angustifolia)这种热带地区的水生植物,从合成废水中移除Pb2+,最大吸附量达到8 h之内吸附86%的Pb2+,叶片中的Pb浓度达到25 mg/L[31]。
人工湿地中的植物还可以修复污水中的重金属和石油等污染物,植物可以直接从根系释放一些酶, 例如硝基还原酶、过氧化物酶和漆酶(对苯二酚氧化酶)等,分解转化污水中有机污染物等[32]。Oosten等的研究表明,许多盐生植物能够耐受并积累吸收高浓度的有毒重金属离子[33],由于盐生植物可以在多种不利环境中生存,因此利用它对重金属进行植物固定和萃取、提取方面有极大的潜力[34],这给一些盐度较高地区构建人工湿地提供了依据;Laffont-Schwob等利用轮藻修复污水中的重金属,对Cu、Zn、Cd和Pb等都有一定的去除作用[35];Khellaf等的研究显示,浮萍可以从污水中成功移除61%~71%的Zn,可以在处理开始的2 d内迅速去除水中高达60%的Zn2+和Cu2+,但在接下来的8 d中去除速率下降10%~20%[36];由于重金属的生物毒性,浮萍植物对重金属的去除修复有其局限性,Hou等指出,浮萍对Cd2+和Cu2+的耐受限度分别是0.5 mg/L和10 mg/L,可见对该修复植物来说,Cd2+比Cu2+有更高的毒性,从而影响其修复效果[37]。Boonsaner等的研究则证明了美人蕉等湿地植物对石油烃类的富集效果,美人蕉在21 d内移除了根区土壤中80%的苯类物质(包括苯、甲苯、乙苯和二甲苯)[38];热带观赏灌木暹罗草在该方面也显示了极高的去除能力,促进了原油和重金属污染土壤中污染物的分离,从被石油和重金属污染的土壤中去除了高达80%的原油污染[39]。
植物在湿地系统中为微生物的生存和繁殖提供基础环境,且能够促进土壤微生物的活动。研究显示,植物根细胞可以分泌凝胶状的黏胶,它是一种通过根系渗透到土壤中的润滑剂,可以帮助根际微生物溶解不溶性营养物质和回收有机营养元素[40-41],植物的光合作用产物可以通过植物根系体液渗出,如土壤糖类、有机酸和芳香化合物,富含供应微生物生长的碳和能源[42],这些渗出液可以刺激微生物趋化现象和反应能动性,进而增强微生物降解有机污染物的能力[43-44]。此外,湿地植物还有减少水分损耗等的作用,有研究显示,有浮萍覆盖的区域相比其他开放的废水处理系统能够少蒸发20%的水分,从而减少该系统在一些干旱区域的水分耗损[45-46]。
总之,在人工湿地中,植物可以直接吸收污水中的营养物质和元素,吸附、富集有毒有害物质,其根系还会形成适宜微生物生长繁殖的根际区域,为一些能够利用、转化污水中污染物和有毒有害物质的微生物提供良好的生存环境,另外还可以通过根系供氧等调节水质。此外,一些湿地植物具有一定的观赏性,绿色植物的存在也可以增加养殖大生态系统中的氧气含量和环境适宜性。
2.2 人工湿地中根际微生物的作用
在生物修复中,单一的生物类型很难应付污水中种类繁多的污染物,植物修复能够达到可观的修复效果,在很大程度上是由于植物根系的微生物作用,一些固氮细菌可以合成和释放抗生素和植物生长物质[47-48],在修复过程中,微生物是不容忽视的重要部分。人工湿地系统中的微生物包括好氧和厌氧微生物,它们可以转化水中污染物,甚至可以使有机物完全矿化。Teamkao等用化学沉淀的方法净化文具厂的废水,结果发现,依然存在着大量的二甘醇和COD,进一步用微生物修复和植物修复2种方法处理发现,微生物修复在清除二甘醇时具有比植物修复更强的功效,但是在清除COD时不如植物修复;研究还发现,构建“土壤-植物”这样的人工湿地在 8 d 内可以全部清除二甘醇,在14 d内可以把COD降低到 110 mg/L,如果在湿地中添加微生物,全部去除二甘醇只要 5 d,在处理11 d时就可以把COD降低到110 mg/L[49]。利用微生物技术对污水中多种污染物进行清理是一种已经被广泛使用并且效益显著、可持续发展的战略[50]。在生物废水处理系统中,大部分微生物以微生物聚集的形式存在,如污泥絮体、生物膜和颗粒状等[51]。在湿地污泥中,利用多种光能自养菌和异养微生物组成微生物聚合体,经过同化、吸附和生物降解,可从复杂废水中去除多种污染物[52]。
一些微生物可以广泛利用多种形式的氮化合物,包括无机化合物NH4+-N和硝态氮(NO3--N)以及氨基酸、多肽等有机物,可通过生物降解对污染物中的有机物进行转化[53]。还有一些功能微生物可产生胞外聚合物,它是微生物分泌的一种复杂的高分子聚合物,可以吸附废水中的有机物,具有细胞溶菌作用,且具有吸附、可生物降解等性能[51]。Ko等利用可产脂肪酶的细菌、真菌或放线菌来分解转化污水中的脂肪等污染物[54]。Chandra等以芦苇为主要湿地植物,利用其根际细菌群落对酒厂废水进行净化修复,结果显示,其BOD和COD的数值分别减少了95%和96%[55]。采用化学沉淀、离子交换、特殊材质的膜处理等传统方法清理水体中重金属,成本昂贵、操作复杂,且当重金属在水中的浓度低于100 mg/L时,这些传统方法是无效的,但一些微生物却可以对污水中的重金属污染起到很好的修复效果[56]。一些研究利用植物或微生物对重金属进行吸收或分解转化[57-58],微生物和植物有吸附金属的潜力,或者根据不同金属来合成特定蛋白,从而对污染物进行吸附[59-60]。Fosso-Kankeu等利用植物和微生物吸附土壤中的重金属,对富集了Pb、Cr等重金属的农业副产品进行加工利用,對重金属进行永久性分离,其中起重要作用的是金属结合蛋白[61]。Beveridge等的研究则将微生物的吸附能力归因于其细胞壁上高含量的潜在化学吸附剂磷壁酸[62]。Tunali等的研究证明,芽孢杆菌属和假单胞菌属的细菌对钴离子(Co2+)、镍离子(Ni2+)、Zn2+、Pb2+等金属表现出很高的吸附能力[63]。一些微生物可以修复污水中的石油类污染物,Boulton等早就发现,微生物可以调控加氧酶系统氧化脂肪族和芳香烃类污染物,产生相应的醇类,达到石油污染物的无害化处理[64];而Kamath等利用异养微生物将有机污染物代谢为CO2和水,利用植物的解毒机制将化学物质转化为无植物毒性的代谢物[65]。Al-Baldawi等构建“植物[硕大藨草(Scirpus grossus)]-基质(砂砾)”人工潜流湿地,在湿地不添加根际细菌和添加根际细菌2种条件下,水体中石油烃污染物(TPH)分别被去除72%和84%,在砂砾中TPH分别被去除59%和77%,结果(图3)显示,根际细菌可以通过明显缓解硕大藨草的石油胁迫,促进植株生长,提高环境中污染物的去除效果[66]。
2.3 人工湿地系统中动物的作用
人工湿地污水处理系统并不是依靠单一机制作用的,而是多种机制协同作用。除了植物微生物之外,还包括水生动物。如在大菱鲆养殖体系中,投放滤食性水生动物海绵(Hymeniacidon perlevis)可使得水体得到净化[67]。滤食性动物和腐食性动物近年来越来越得到人们的重视,这些动物利用它们的摄食习性可以有效降低养殖对水体环境造成的负面影响。张喜勤等进行的池内和现场试验表明, 草食性水溞能去除富营养化湖水中的TN、TP、COD、BOD等污染物,从而使水质得到净化[68]。因此,选择一种较好的水体修复浮游动物,可为养殖环境修复开辟一条新途径。项黎新等报道,三角帆蚌(Hyriopsis cumingii)对污染水的Cr、Pb和Cd具有很大的净化作用,经12 d净化处理,3种污染水体的Cr、Pb、Cd含量分别下降83%、78%、72%[69]。徐永健等的研究表明,在养殖水体中投放底栖动物双齿围沙蚕,对系统底部氮、磷污染物的去除效果显著,相比于单养鱼处理沉积物中TN、TP含量分别降低了9.59%~10.47%、7.11%~8.18%;此外,沙蚕不同的放养密度对于系统沉积物的修复效果及养殖效益具有显著影响,22.5 kg/hm2的放养密度既可有效修复系统的沉积物环境,又能促进养殖效益的提升,使鱼体产量上升156%[70]。
3 結束语
湿地被誉为“地球之肾”是实至名归的,因其在蓄水、调节河川径流、补给地下水和维持区域水平衡中发挥着重要作用,而且其生态系统中生物多样性高,动植物资源丰富,能有效控制沉积物、有毒物和营养素等污染物,是人与自然和谐共存不可或缺的部分。在水资源紧缺、污染和浪费严重的今天,人工湿地污水处理系统以其环保、节能、可持续、低成本等优势,若加以合理规划和推广,将可以成为今后主要的污水处理净化系统,它自成体系,操作和管理简单,不需要大量人力,建设起来后能可持续运行,而且对于区域内空气、水体都有很好的净化修复作用,随着研究的增多和技术的完善推广,人工湿地将成为今后涵养水源、防治旱涝、修复污染的重要设施,成为绿色环保可持续发展的一大助力。为了更好地发挥人工湿地的净化与生态功能,未来人工湿地中生物修复须要考虑从以下几方面开展研究。
(1)人工湿地的作用与植物和基质的选择有着紧密的关系。合理选择湿地植物及基质依旧是人工湿地设计的关键,因此,应对这方面进行更加深入的研究。如通过研究不同植物种群配置对人工湿地净化能力的影响以及湿地中植物与微生物、基质的协作作用,构建一个完整合适的人工湿地植物生态系统,发挥乔灌木结合及暖、冷季植物套种的优势。另外,还应对植物根际的化学和生物学特性进行研究,探索人工湿地植物根系对污水的适应性,分析其与氮磷、重金属等污染物的关系。合理配置植物以优化微生物群落结构和功能。此外,在机理研究方面,建议采用先进的分子生物学和基因技术等手段确定微生物的空间位置和群落组成,评价微生物对不同影响因素的响应,进一步探索植物-微生物联合脱氮除磷的机制。
(2)研究湿地植物的生态效益、生态安全性和收割后的资源化利用。对现有的人工湿地污染物去除效果、生态价值等进行分析后,探讨出一套完整、系统、科学的评价体系,对现有的人工湿地植物进行客观、科学的生态评价,使得人工湿地的环境、经济、景观等生态服务功能得到合理使用。另外,湿地植物均具有一定的生态适应性,通常具有很高的整体应用价值,但有些因素会限制它们的应用范围,例如凤眼莲在一些地区可能会造成生物入侵,紫萍、浮萍等生长不易控制,亦会形成生物入侵。湿地植物收割后的资源化利用也颇为重要。例如将湿地植物收割后加工成生物炭,既可以作为湿地填料提高对污水的净化效果,也可以作为土壤改良剂施入农田;或者将湿地植物替换成具有经济效益的水生植物(如水稻、观赏植物等),通过收割,既可以去除湿地系统中积累的营养物质,又可以获得经济效益。
(3)研究湿地植物的繁殖生长行为,加强植物在污水中的抗逆性研究,尤其要结合越冬期的寒冷、春季的复苏、夏季的高温等环境因素,以便于选择植物能够更好地适应人工湿地环境,并维持湿地的高效率去污能力。
(4)加强人工湿地生物修复养殖废水中抗生素效果及其动态的研究。以前的研究主要侧重于富营养化和重金属的去除等方面,对抗生素生物修复研究触及很少。而抗生素和重金属等均广泛存在于畜禽养殖业的废水中。这些抗生素进入水体不仅对水生动植物的生长发育造成影响,还会诱导环境微生物产生抗生素抗性基因,对公共卫生安全造成潜在威胁。仍须要进一步筛选富集能力强的湿地植物,深入研究湿地植物固定、吸收和转运抗生素、重金属的机制,并采用基因工程和分子生物学技术,增强湿地植物去除抗生素和重金属的功能。
(5)除了陆上不确定的污废水排放入海之外,船舶污水、石油开采废水和海水养殖废水是主要的海水污染源。这些典型污染源废水的处理还处于研究阶段,至今没有固定的普遍适应任何水质的技术。通过构建耐盐植物联合根际微生物,建立近海滩涂人工湿地,处理含盐污水,为海洋环境可持续发展提供新的思路与方向。
参考文献:
[1]Wu Y H,Liu J Z,Shen R F,et al. Mitigation of nonpoint source pollution in rural areas:from control to synergies of multi ecosystem services[J]. Science of the Total Environment,2017,607:1376-1380.
[2]刘国锋,徐 跑,吴 霆,等. 中国水产养殖环境氮磷污染现状及未来发展思路[J]. 江苏农业学报,2018,34(1):225-233.
[3]王琼瑶,李 森,周 玲,等. 猪粪-秸秆还田对土壤、作物重金属铜锌积累及环境容量影响研究[J]. 农业环境科学学报,2016,35(9):1764-1772.
[4]Wu M,Tang X Q,Li Q Y,et al. Review of ecological engineering solutions for rural non-point source water pollution control in Hubei province,China[J]. Water Air and Soil Pollution,2013,224(5):1561.
[5]Sun H C,Liu S,Hu X J,et al. Occurrence and temporal variation of antibiotic resistance genes (args) in shrimp aquaculture:args dissemination from farming source to reared organisms[J]. Science of the Total Environment,2017,607:357-366.
[6]Lin G R,Sun F L,Wang C Z,et al. Assessment of the effect of Enteromorpha prolifera on bacterial community structures in aquaculture environment[J]. PLoS One,2017,12(7):e0179792.
[7]劉 冉,甘淳丹,赵海燕,等. 四种大型湿地植物对水产养殖废水中矿质元素和重金属富集特征的影响[J]. 南京农业大学学报,2017,40(5):859-866.
[8]Upadhyay A K,Singh N K,Bankoti N S,et al. Designing and construction of simulated constructed wetland for treatment of sewage containing metals[J]. Environmental Technology,2017,38(21):2691-2699.
[9]Rehman F,Pervez A,Khattak B N,et al. Constructed wetlands:perspectives of the oxygen released in the rhizosphere of macrophytes[J]. Clean-Soil Air Water,2017,45(1):1600054.
[10]McAndrew B,Ahn C. Developing an ecosystem model of a floating wetland for water quality improvement on a stormwater pond[J]. Journal of Environmental Management,2017,202:198-207.
[11]Gikas P,Ranieri E,Tchobanoglous G. Removal of iron,chromium and lead from waste water by horizontal subsurface flow constructed wetlands[J]. Journal of Chemical Technology and Biotechnology,2013,88(10):1906-1912.
[12]Gill L W,Ring P,Casey B,et al. Long term heavy metal removal by a constructed wetland treating rainfall runoff from a motorway[J]. Science of the Total Environment,2017,601:32-44.
[13]Yang Z F,Zheng S K,Chen J J,et al. Purification of nitrate-rich agricultural runoff by a hydroponic system[J]. Bioresource Technology,2008,99:8049-8053.
[14]Bezbaruah A N,Zhang T C. Performance of a constructed wetland with a sulfur/limestone denitrification section for wastewater nitrogen removal[J]. Environmental Science and Technology,2003,37:1690-1697.
[15]Chen T Y,Kao C M,Yeh T Y,et al. Application of a constructed wetland for industrial wastewater treatment:a pilot-scale study[J]. Chemosphere,2006,64:497-502.
[16]Zhai J,Xiao H W,Kujawa-Roeleveld K,et al. Experimental study of a novel hybrid constructed wetland for water reuse and its application in Southern China[J]. Water Science and Technology,2011,64(11):2177-2184.
[17]Nahlik A M,Mitsch W J. Tropical treatment wetlands dominated by free-floating macrophytes for water quality improvement in Costa Rica[J]. Ecological Engineering,2006,28(3):246-257.
[18]Ojoawo S O,Udayakumar G,Naik P. Phytoremediation of phosphorus and nitrogen with canna×generalis reeds in domestic wastewater through nmamit constructed wetland[J]. Aquatic Procedia,2015(4):349-356.
[19]Ninawe A S,Selvin J. Probiotics in shrimp aquaculture:avenues and challenges[J]. Critical Reviews in Microbiology,2009,35(1):43-66.
[20]Byun C,Nam J M,Kim J G. Effects of flooding regime on wetland plant growth and species dominance in a mesocosm experiment[J]. Plant Ecology,2017,218(5):517-527.
[21]Pan X,Ping Y M,Cui L J,et al. Plant litter submergence affects the water quality of a constructed wetland[J]. PLoS One,2017,12(1):e0171019.
[22]陈永华,吴晓芙,蒋丽鹃,等. 处理生活污水湿地植物的筛选与净化潜力评价[J]. 环境科学学报,2008,28(8):1549-1554.
[23]Seeger E M,Maier U,Grathwohl P,et al. Performance evaluation of different horizontal subsurface flow wetland types by characterization of flow behavior,mass removal and depth-dependent contaminant load[J]. Water Research,2013,47(2):769-780.
[24]Barznji D M. Phytoremediation as an alternative method to remove lead and cadmium from wastewater using some aquatic plants[J]. European International Journal of Science and Technology,2014,3(4):4.
[25]Alade G A,Ojoawo S O. Purification of domestic sewage by water hyacinth(Eichhornia crassipes)[J]. International Journal of Environmental Technology and Management,2009,10(3):286-294.
[26]Alade G A,Ojoawo S O,Alade G A. Water hyacinth(Eichhornia crassipes)culture in sewage:nutrient removal and potential applications of bye-products[J]. Transnational Journal Science and Technology,2012,2(7):104-111.
[27]Doni S,Macci C,Peruzzi E,et al. Heavy metal distribution in a sediment phytoremediation system at pilot scale[J]. Ecological Engineering,2015,81(1):146-157.
[28]Jácome J A,Molina J,Suárez J,et al. Performance of constructed wetland applied for domestic wastewater treatment:case study at boimorto (Galicia,Spain)[J]. Ecological Engineering,2016,95:324-329.
[29]Ghaly A E,Kamal M,Mahmoud N S. Phytoremediation of aquaculture wastewater for water recycling and production of fish feed[J]. Environment International,2005,31(1):1-13.
[30]Krishna K C B,Polprasert C. An integrated kinetic model for organic and nutrient removal by duckweedbased waste-water treatment (Dubwat) system[J]. Ecological Engineering,2008,34:243-250.
[31]Sharain-Liew Y L,Joseph C G,How S E. Biosorption of lead contaminated wastewater using cattails (Typha angustifolia) leaves:kinetic studies[J]. Journal of the Serbian Chemical Society,2011,76(7):1037-1047.
[32]Chen F,Huber C,Schrder P. Fate of the sunscreen compound oxybenzone in Cyperus alternifolius based hydroponic culture:uptake,biotransformation and phytotoxicity[J]. Chemosphere,2017,182:638-646.
[33]Oosten M J V,Maggio A. Functional biology of halophytes in the phytoremediation of heavy metal contaminated soils[J]. Environmental and Experimental Botany,2015,111:135-146.
[34]張 娜,杨 双,童 非,等. 铅污染对不同生境芦苇体内抗氧化酶系统的影响[J]. 江苏农业学报,2018,34(2):333-339.
[35]Laffont-Schwob I,Triboit F,Prudent P,et al. Trace Metal extraction and biomass production by spontaneous vegetation in temporary mediterranean stormwater highway retention ponds:freshwater macroalgae (Chara spp.) vs. Cattails (Typha spp.)[J]. Ecological Engineering,2015,81:173-181.
[36]Khellaf N,Zerdaoui M. Phytoaccumulation of zinc by the aquatic plant,Lemna gibba L[J]. Bioresource Technology,2009,100(23):6137-6140.
[37]Hou W H,Chen X,Song G L,et al. Effects of copper and cadmium on heavy metal polluted waterbody restoration by duckweed (Lemna minor)[J]. Plant Physiology and Biochemistry,2007,45(10):62-69.
[38]Boonsaner M,Borrirukwisitsak S,Boonsaner A. Phytoremediation of BTEX contaminated soil by Canna generalis[J]. Ecotoxicology and Environmental Safety,2011,74(6):1700-1707.
[39]Atagana H I. Bioremediation of co-contamination of crude oil and heavy metals in soil by phytoremediation using Chromo-laena odorata (L.) King & H.E.Robinson[J]. Water Air and Soil Pollution,2011,215(1/2/3/4):261-271.
[40]Jones R K,Sun W H,Tang C S,et al. Phytoremediation of petroleum hydrocarbons in tropical coastal soils-Ⅱ. Microbial response to plant roots and contaminant[J]. Environmental Science and Pollution Research,2004,11(5):340-346.
[41]Kirk J L,Klironomos J N,Lee H,et al. The effects of perennial ryegrass and alfalfa on microbial abundance and diversity in petroleum contaminated soil[J]. Environmental Pollution,2005,133(3):455-465.
[42]Khan S,Afzal M,Iqbal S,et al. Plant-bacteria partnerships for the remediation of hydrocarbon contaminated soils[J]. Chemosphere,2013,90(4):1317-1332.
[43]Leigh M B,Fletcher J S,Fu X,et al. Root turnover:an important source of microbial substrates in rhizosphere remediation of recalcitrant contaminants[J]. Environmental Science and Technology,2002,36(7):1579-1583.
[44]Gerhardt K E,Huang X D,Glick B R,et al. Phytoremediation and rhizoremediation of organic soil contaminants:potential and challenges[J]. Plant Science,2009,176(1):20-30.
[45]Oron G,Porath D,Wildschut L R. Wastewater treatment and renovation by different duckweed species[J]. Journal of Environmental Engineering,1986,112(2):247-263.
[46]Borrelli J. Mean crop consumptive use and free-water evaporation for texas[D]. Texas:Texas Tech University,1998.
[47]Li F M,Shi M,Zheng X,et al. A novel method of rural sewage disinfection via root extracts of hydrophytes[J]. Ecological Engineering,2014,64(1):344-349.
[48]Beneduzi A,Peres D,Da C P,et al. Genetic and phenotypic diversity of plant-growth-promoting bacilli isolated from wheat fields in southern Brazil[J]. Research in Microbiology,2008,159(4):244-250.
[49]Teamkao P,Techkarnjanaruk S,Kullavanijaya P,et al. Comparison of bioremediation and phytoremediation in treatment of diethylene glycol from stationery industry[J]. Desalination and Water Treatment,2017,60:114-121.
[50]Wu Y H,Hu Z Y,Yang L Z,et al. The removal of nutrients from non-point source wastewater by a hybrid bioreactor[J]. Bioresource Technology,2011,102(3):2419-2426.
[51]Sheng G P,Yu H Q,Li X Y. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems:a review[J]. Biotechnology Advances,2010,28:882-894.
[52]Wu Y H,Li T L,Yang L Z. Mechanisms of removing pollutants from aqueous solutions by microorganisms and their aggregates:a review[J]. Bioresource Technology,2012,107(2):10-18.
[53]Suvilampi J,Lehtomi A,Rintala J. Comparison of laboratory-scale thermophilic biofilm and activated sludge processes integrated with a mesophilic activated sludge process[J]. Bioresource Technology,2003,88(3):207-214.
[54]Ko W H,Wang I T,Ann P J. A simple method for detection of lipolytic microorganisms in soils[J]. Soil Biology and Biochemistry,2005,37(3):597-599.
[55]Chandra R,Bharagava R N,Kapley A,et al. Characterization of Phragmites cummunis rhizosphere bacterial communities and metabolic products during the two stage sequential treatment of post methanated distillery effluent by bacteria and wetland plants[J]. Bioresource Technology,2012,103(1):78-86.
[56]Aejung C,Wang S K,Minhee L. Biosorption of cadmium,copper,and lead ions from aqueous solutions by Ralstonia sp. and Bacillus sp. isolated from diesel and heavy metal contaminated soil[J]. Geosciences Journal,2009,13(14):331-341.
[57]Ghosh M,Singh S P. A review on phytoremediation of heavy metals and utilization of its byproducts[J]. Applied Ecology and Environmental Research,2005,3(1):1-18.
[58]Fossokankeu E,Mulababafubiandi A F,Mamba B B,et al. Prediction of metal-adsorption behaviour in the remediation of water contamination using indigenous microorganisms[J]. Journal
Environmental Management,2011,92(10):2786-2793.
[59]Mejáre M,Bülow L. Metal-binding proteins and peptides in bioremediation and phytoremediation of heavy metals[J]. Trends in Biotechnology,2001,19(2):67-73.
[60]Sriprang R,Murooka Y. Accumulation and detoxification of metals by plants and microbes[M]//Environmental Bioremediation Technologies. Berlin Heidelberg:Springer,2007:77-100.
[61]Fosso-Kankeu E,Mulaba-Bafubiandi A F. Implication of plants and microbial metalloproteins in the bioremediation of polluted waters:a review[J]. Physics and Chemistry of the Earth,2014(2):242-252.
[62]Beveridge T J. Role of cellular design in bacterial metal accumulation and mineralization[J]. Annual Review of Microbiology,1989,43(1):147-171.
[63]Tunali S,Cabuk A,Akar T. Removal of lead and copper ions from aqueous solutions by bacterial strain isolated from soil[J]. Chemical Engineering Journal,2006,115(3):203-211.
[64]Boulton C A,Ratledge C. The physiology of hydrocarbon-utilization microorganisms[M]. Ellis Horwood,Chicheste:Fermentation and Enzyme Technologyr,1984:11-77.
[65]Kamath R,Rentz J A,Schnoor J L,et al. Phytoremediation of hydrocarbon-contaminated soils:principles and applications[M]. Elsevier,Amsterdam:Surface Science and Catalysis,2004:447-478.
[66]Al-Baldawi I A,Abdullah S,Anuar N,et al. Bioaugmentation for the enhancement of hydrocarbon phytoremediation by rhizobacteria consortium in pilot horizontal subsurface flow constructed wetlands[J]. International Journal of Environmental Science and Technology,2017,14(1):75-84.
[67]Zhang X C,Zhang W,Xue L,et al. Bioremediation of bacteria pollution using the marine sponge Hymeniacidon perlevis in the intensive mariculture water system of turbot S cophthalmus maximus[J]. Biotechnology and Bioengineering,2010,105(1):59-68.
[68]張喜勤,徐锐贤,许金玉,等. 水溞净化富营养化湖水试验研究[J]. 水资源保护,1998(4):32-36.
[69]项黎新,邵健忠. 三角帆蚌对水体Cr、Pb和Cd的净化与吸收[J]. 浙江大学学报(理学版),2002,29(5):569-572.
[70]徐永健,卢光明,葛奇伟. 双齿围沙蚕对围塘养殖沉积物氮磷含量的影响[J]. 水产学报,2011,35(1):88-95.
