3种人参根系分泌物的成分比较及化感效应分析
2019-01-19刘成李彩凤刘兵
刘成 李彩凤 刘兵

摘要:为了比较不同品种人参耐连作能力强弱,探讨人参连作障碍的可能机制,通过提取3个不同品种吉黄果参(R1)、边参1号(R2)、吉参1号(R3)7年生人参根系分泌物,利用GC-MS方法对根系分泌物的主要成分进行鉴定,并通过生物检测验证其化感效应。结果表明:R1、R2、R3根系分泌物中鉴定出的化感物质主要有酸类、醇类、酯类合胺类等,但各类化感物质的数量和含量不同。R1、R2、R3中均鉴定出阿魏酸,相对质量浓度分别为0.31、0.21、0.34 mg/L。所有根系分泌物和外源化感物质阿魏酸处理,均明显抑制人参种子的出苗率和幼苗株高、最大叶长和叶宽、根长等形态指标,各处理对幼苗抗氧化酶、叶片光合色素、内源激素含量均表现出化感毒性,但边参1号根系分泌物化感效应较其余处理弱,证明其抗连作能力较强。阿魏酸是人参根系分泌的化感自毒物质之一。
关键词:人参;根系分泌物;阿魏酸;化感效应
中图分类号:S567.5+10.1 文献标志码: A 文章编号:1002-1302(2019)22-0191-05
人参为五加科人参属植物,为我国传统名贵中药材,被誉为21世纪最重要和最具发展前景的药用作物之一。现代栽培的人参,是由野生人参经长期引种驯化、栽培而形成的经济价值很高的作物。近年来,国家对人参产品药食同源的放开,导致人参需求量猛增,种植面积逐年扩大。人参忌地性非常强,重茬参地要30年后才能再栽参,不宜轮作。人参在中国的栽培面积和总产均居世界第一位,是中国用量较大的药材之一,占据较大的出口市场份额,是传统林区改制后重要的经济来源[1]。韩国、日本等已实现大田连续栽参,中国还未掌握人参连作关键技术。连作障碍问题制约了人参产业的可持续发展,栽培土地严重短缺,长期采用伐林栽参方式,即将森林全部砍伐后再栽参,严重破坏自然生态环境[2]。
化感作用就是指一个活体植物通过地上部分茎叶挥发、茎叶淋溶、根系分泌等途径向环境中释放一些化学物质,从而影响周围植物的生长和发育[3]。连作障碍一直是栽培学研究的重点,人参发生连作障碍,轻则减产、减收,重则绝收,严重制约了人参产业的可持续发展。人参忌连作是一个世界性的技术难题,更是长期以来困扰我国参业稳定发展的主要问题。前人研究表明,引起连作障碍的原因众多,土壤理化性状的变化、病原微生物及土传病害的增加都是重要的原因,但都未从根本上揭示连作障碍的产生机制。研究表明化感物质在人参连作障碍中有着重要影响,根系分泌物是人参重要的化感物质来源,与植物的连作障碍有着重要联系,成为众多作物栽培学者研究的热点。根系分泌物在植物根际对话中发挥重要的调控作用,是植物响应外界胁迫的反应途径,也是植物与外界环境进行物质交换和信息传递的重要载体[4-5]。有关根系分泌物笔者从收集方法、萃取途径和化感效应等方面进行了前期研究[6-9]。人参根系分泌物与不同品种、生长时期、生长环境密切相关,是产生化感作用的重要原因[10]。
目前,有关不同品种人参根系分泌物成分的相互比较研究较少,由于人参特殊的生理特点和较长的生长周期,严重影响了其根系分泌物研究工作的精确性和系统性[11-12]。因此,本研究对3种不同抗性品种人参根系分泌物进行对比研究,对根系分泌物成分进行GC-MS质谱鉴定,其中对具有较强化感毒性的物质阿魏酸进行了相对定量分析,并引入外源阿魏酸和不同品种人参根系分泌物对人参幼苗进行生理生化测试,旨在寻找耐连作人参品种和探索人参连作障碍的形成机制,为减缓连作障碍提供科学依据。
1 材料与方法
试验于2016年在吉林康美人参栽培基地进行,日常田间栽培管理。
1.1 根系分泌物的收集
从种植基地设置的不同品种耐连作化感定位试验中,选取连续种植7年人参品种吉黄果参、边参1号、吉参1号地块,分别标记为R1、R2、R3。上述品种采用日常田间种植方式,采取苗趴(播种育苗,用苗移栽后不再移动,直至收获)形式栽培人参,最大限度保证人参根系分泌物的原始成分不受干扰和破坏。每块试验地选择3个点,每点选取人参植株5株,小心抖干净根系附着土壤,将每点植株混合后,分别用500 mL分析纯甲醇反复淋洗根系,将得到的根系分泌物 4 000 r/min 离心5 min,然后将根系分泌物的甲醇溶液在 35 ℃ 下用旋转蒸发仪50 ℃真空减压浓缩定容至10 mL,4 ℃冷藏,备用。
1.2 根系分泌物的衍生化
用氮吹仪在35 ℃下将10 mL制备好的根系分泌液风冷吹干,并进行硅烷衍生化。硅烷化过程参照刘应蛟等的方法[13],硅烷化过程在6 h内完成。
1.3 根系分泌物的定性和定量分析
采用GC-MS方法分析鉴定。采用Agilent公司的Trace-ISQ型气相色谱-质谱联用仪鉴定。气相色谱和质谱测定方法参照郭华等的方法[14]。通过GC-MS分析后得到总离子流色谱图,采用标准质谱库定性,通过计算机在检索系统进行物质的鉴定,应用标准图库(NIST2015 & WILEY)質谱数据库查找核对并结合人工分析进行物质的鉴定。
定量分析:已有研究表明阿魏酸是人参根系分泌物中重要的化感物质,配制阿魏酸的0.10、0.20、0.50、1.00、2.00 mg/L 的吡啶溶液,每个梯度3次重复进样,以浓度为横坐标,以重复样的峰面积平均值为纵坐标,进行线性回归分析,根据各组分的保留时间确定物质的色谱峰面积,通过峰面积和质量浓度关系建立标准曲线,由标准曲线的回归方程计算得到阿魏酸的质量浓度。
1.4 根系分泌物原液及外源化感物质的自毒效应
通过生物检测验证人参根系分泌物对人参苗生长的影响。将按“1.1”节方法收集到的不同品种人参根系分泌物蒸馏水定量稀释为50 mL,用细菌过滤器过滤后每24 h浇灌1次已催芽人参种子,测定发芽率,发芽率方法参照王菡等的方法[15];配制0.20 mg/L阿魏酸的甲醇溶液供后续试验。2年生人参苗用自来水将根部泥土洗净消毒,尽量减少对人参根部的伤害,25%多菌灵500倍液浸泡15 min,无菌水反复冲洗,种植于未受污染的新林地土中,每小区3 m2,日常田间管理方式。培养30 d后开始浇灌根系分泌物及外源化感物质阿魏酸,每次每株加10 mL处理液,以甲醇为对照(CK),共5个处理,分别记作CK、R1、R2、R3、A1,每处理重复3次,每隔5 d浇灌1次处理液。60 d后调查人参株高、叶长、叶宽和须根数及测定各项生理生化指标。计算化感效应指数采用Williamson等的方法进行。酶活性、光合色素含量与内源激素测定参照李合生的植物生理学试验指南方法[16]进行。
2 结果与分析
2.1 人参根系分泌物的成分鉴定
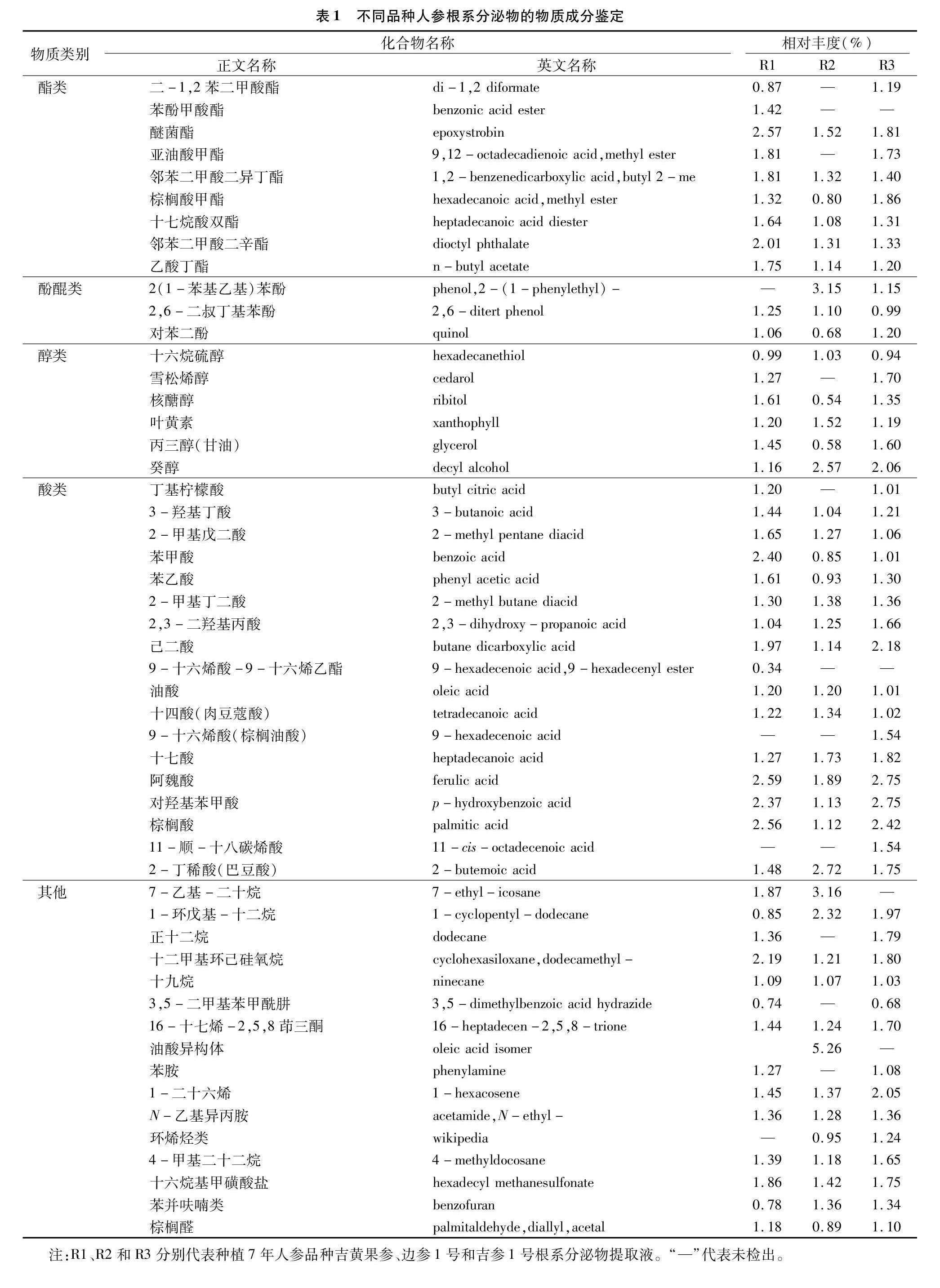
不同品种人参根系分泌物的总离子质谱图比较相似,但峰面积大小不同。对总离子质谱图通过计算机检索系统鉴定,按照相似度大于70%、峰面积大于500 000,得到不同品种人参根系分泌物的主要物质(表1)。各处理中剔除三烯丙基异氰脲酸酯影响,前述试验已证明这种物质为人参栽培所用塑料薄膜中的增塑剂分解物质;同时剔除五氯硝基苯,为残留农药分解产物。这2种物质不能归类为化感物质。
从R1、R2和R3人参根系分泌物中分别鉴定出47种、41种和48种化合物,各处理根系分泌物中以有机酸类物质种类最多,相对丰度占比最大,R1和R3有机酸含量比R2高。在鉴定的化感物质中,酯类、醇类占比也较大。在鉴定出的众多化合物中,阿魏酸是已被证实是人参连作障碍中重要的化感物质之一,从R1、R2和R3人参根系分泌物中鉴定到的阿魏酸相对丰度分别为2.59%、1.89%和2.75%。
2.2 人参根系分泌中阿魏酸的定量
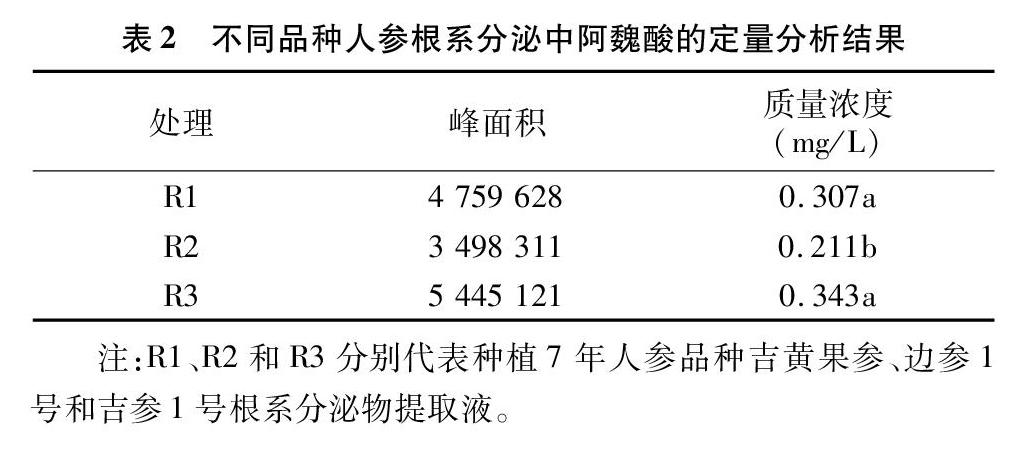
根据不同质量浓度阿魏酸GC-MS图中峰面积和浓度的关系,建立阿魏酸标准曲线图。根据阿魏酸标准曲线图,依据不同品种人参根系分泌物中阿魏酸的峰面积,计算出不同品种人参根系分泌物中阿魏酸的质量浓度和植株分泌量(表2)。
由表2可以看出,R1和R3人参品种中阿魏酸含量高于R2人参品种中阿魏酸的含量,R1、R2和R3中阿魏酸质量浓度分别为0.31、0.21、0.34 mg/L。
2.3 人参根系分泌物的化感效应
2.3.1 不同品种人参根系分泌物及阿魏酸对形态指标的影响 由表3可以看出,相对于对照,不同品种人参根系分泌物和外源阿魏酸均显著抑制了人参种子的出苗率和人参苗的株高、最大叶长和叶宽、根长等形态指标,其中R1和A1对出苗率和株高都达到极显著抑制水平。阿魏酸处理对人参幼苗株高化感指数最高,达到50.08%,其次是边参1号根系分泌物处理,化感指数达到42.28%,边参1号根系分泌物处理对最大叶长化感指数达到40.34%。
2.3.2 人参根系分泌物处理及阿魏酸对幼苗抗氧化酶活性的影响 人参根系分泌物及阿魏酸处理对人参幼苗抗氧化酶活性的影响如表4所示。除R2外, 各处理对SOD酶活性影响均达到极显著差异水平;R1和A1对POD酶活性影响达到极显著差异水平,化感指数为32.30%和38.97%;R1对PAL酶活性影响最大,达到极显著差异水平,化感指数为30.05%;A1对CAT酶活性影响最大,达到极显著差异水平,化感指数为25.71%。
2.3.3 人参根系分泌物及阿魏酸处理对光合色素含量的影响 人参根系分泌物及阿魏酸处理对叶片光合色素含量的影响如表5所示。R1和A1对叶绿素a和叶绿素b影响均达到极显著差异水平;除R2外,各处理对类胡萝卜素影响均达到极显著差异水平,化感指数分别为26.21%、29.61%、27.67%。
2.3.4 人参根系分泌物及阿魏酸处理对内源激素含量的影响 人参根系分泌物及阿魏酸处理对人参内源激素含量的影响如表6所示。除R2外,各处理对IAA与ABA影响均达到极显著差异水平;R1和A1对GA3影响均达到极显著差异水平,化感指数分别为24.64%和36.17%。
3 讨论与结论
3.1 不同品种人参根系分泌物化感物质的差异
本试验的创新点在于首次对比研究不同抗性品种人参根系分泌物成分区别和化感效应,结果表明,不同品种人参根系分泌物中存在化感物质,品种不同,根系分泌物中化感物质种类和含量不同。连续种植导致减产或绝收的重要原因就是化感物质对后续人参生长有强烈的抑制作用,根系分泌的化感毒性越强,连作危害越重。从本试验可以看出,不同品种人参根系分泌物鉴定出的主要化感物质为有机酸类、醇类、酯类,各类物质的数量和相对含量不同,这与前人的研究结果[1]基本一致。传统农家品种边参1号种植7年后,化感物质种类较吉黄果参和吉参1号少,酚酸类化感物质是公认对连作影响较大的化感物质,边参1号品种在对羟基苯甲酸、阿魏酸和棕榈酸这3种主要化感物质含量上较其余2个品种要低,这可以理解为农家品种边参1号连作抗性强的理论依据。
3.2 不同品种人参根系分泌物及阿魏酸处理的化感效应
不同品种人参根系分泌物及阿魏酸处理对幼苗最大叶长和最大叶宽化感指数影响不如出苗率、株高、根长明显,可能与叶长、叶宽化感反应不敏感有關。试验表明,不同处理对人参种子出苗率、植株株高、最大叶长、最大叶宽、根长、须根数均表现出农家品种边参1号化感指数最小,对人参苗抗氧化酶活性及光合色素含量和内源激素含量表现为边参1号化感指数最小、其次是吉参1号,吉黄果参品种受影响最大,化感指数变化与外源酚酸阿魏酸处理表现出一致性,证明产生化感毒害作用的可能主要为酚酸类化感物质。人参幼苗根系酶活性的升高可能是其受到化感胁迫后,导致体内过氧化产物增多而启动的一种应激机制,即氧化胁迫诱导了人参苗体内抗氧化能力的增加。但是,这种适应性的反应只在一定受害程度内发挥作用,当体内过氧化产物积累到一定水平时,各种酶不能正常发挥作用,将会导致酶活性下降,这一研究结果与黄小芳等人的研究结果[17]类似。
在人参种子中,每一个生长季结束,应尽可能除去残留的茎、叶、根,以减少土壤中的化感物质含量[18],减少对来年人参生长的影响。大量研究结果表明,用甲醇做溶剂提取植物根系分泌物是一种有效的途径,能将土壤中大量化感物质提取出来,但该方法与自然界雨水淋溶还有一定区别,在实际大田生产自然环境中化感物质还存在植株分解与土壤中微生物的参与互作2种分解途径,还需要继续深入研究。
本试验只选用了3种人参根系分泌物作对比,后续试验应增加品种和抗性指标测试范围,大田条件下作物根际环境非常复杂,人参化感作用潜力是由多种因素共同作用的结果,更多因素之间的互作效应还应进一步研究。
参考文献:
[1]陈长宝,张 瑞,王恩鹏,等. 人参化感作用及其研究进展[J]. 特产研究,2018,40(1):54-58.
[2]李自博. 人参根系自毒物质在连作障碍中的化感作用及其缓解途径研究[D]. 沈阳:沈阳农业大学,2018.
[3]李明哲,高汝勇,李会芬,崔海英. 不同品种马铃薯对谷子萌发的化感作用研究[J]. 中国农学通报,2017,33(18):13-20.
[4]张文明,邱慧珍,海 龙,等. 不同连作年限马铃薯根系分泌物的成分鉴定及其生物效应[J]. 中国生态农业学报,2018,26(12):1811-1818.
[5]张文明,邱慧珍,张春红,等. 连作马铃薯不同生育期根系分泌物的成分检测及其自毒效应[J]. 中国生态农业学报,2015,23(2):215-224.
[6]刘 成,马凤鸣,吴 蕾,等. 重茬大豆根系分泌物的成分及化感作用研究[J]. 安徽农业科学,2010,38(22):11957-11959.
[7]马凤鸣,王安娜,刘 成,等. 大豆根系分泌物的鉴定及PAL1、PAL2、C4H的克隆[J]. 作物杂志,2011,12(2):65-71.
[8]吴 蕾,马凤鸣,刘 成,等. 大豆与玉米、小麦、高粱根系分泌物的比较分析[J]. 大豆科学,2009,28(6):1021-1025.
[9]李业成,马凤鸣,吴 蕾,等. 正茬与连作大豆根系分泌物差异及对大豆苗生长的影响[J]. 东北农业大学学报,2010,41(6):1005-1011.
[10]杨 莉,任 晶,韩 梅,等. 人参根系分泌物中酸性物质的化感活性与互作效应[J]. 吉林农业大学学报,2017,39(5):570-574.
[11]Li C,Lin C F,et al. Composition Identification and allelopathic effect of root exudates of ginseng in different continuous cropping years[J]. Acta Microscopica,2019,28(3):467-475.
[12]Wingler A,Lea P J,Quick W P,et al. Photorespiration:metabolic pathways and their role in stress protection[J]. Philosophical Transactions of the Royal Society of London,2000,355(1402):1517-1529.
[13]刘应蛟,肖 岚,罗林明,等. 硅烷化衍生化气相色谱/質谱法测定玉竹中游离糖成分[J]. 国际药学研究杂志,2018,45(6):472-478.
[14]郭 华,汪汉城,李 磊,等. 超高效液相色谱-串联质谱法测定新型玉米根系分泌物3-甲基-2(3H)-苯并噻唑硫酮[J]. 理化检验(化学分册),2018,54(12):1454-1455.
[15]王 菡. 植物激素对不同种质人参种子萌发幼苗生长的影响[D]. 长春:吉林农业大学,2012.
[16]李合生. 植物生理学试验技术[M]. 3版.北京:科学出版社,2004:2.
[17]黄小芳. 人参根系分泌物及其自毒活性研究[D]. 北京:中国协和医科大学,2009.
[18]李明哲,高汝勇,李会芬,等. 不同品种马铃薯对谷子萌发的化感作用研究[J]. 中国农学通报,2017,33(18):13-20.
