4个绵羊品种FSHR基因多态性与生物信息学分析
2019-01-19陈来运袁超孙晓萍
陈来运 袁超 孙晓萍

摘要:旨在探究4个绵羊品种的多胎性状分子遗传机制,以高山美利奴羊、青海细毛羊、中国美利奴羊和敖汉细毛羊为研究对象,通过分析全基因组测序结果对4个绵羊品种FSHR基因外显子单核苷酸多态性进行筛选,利用专门软件预测单核苷酸多态性对FSHR基因mRNA二级结构、蛋白质二级结构和三级结构的影响。研究发现,高山美利奴羊、中国美利奴羊、敖汉细毛羊FSHR基因在外显子上分别存在3个SNPs(T904G、C975T、G1572A)、7个SNPs(G149A、G813A、T817C、T904G、C975T、T1234C、G1572A)、6个SNPs(G813A、T817C、T904G、C975T、T1234C、G1572A),青海细毛羊FSHR基因在外显子上不存在突变位点。生物信息学分析发现,试验所检测到的7个SNPs中T817C、T904G、T1234C导致mRNA的二级结构和最小自由能发生改变,G813A引起最小自由能改变,而未引起mRNA二级结构发生改变,G149A、C975T与G1572A未引起最小自由能与mRNA的二级结构发生改变。5个错义突变位点(G149A、G813A、T904G、C975T、G1572A)均导致编码蛋白质二级结构与三级结构发生改变。
关键词:绵羊;FSHR基因;多态性;SNPs;生物信息学分析
中图分类号: S826.2 文献标志码: A 文章编号:1002-1302(2019)22-0047-05
卵泡刺激素受体(follicle-stimulating hormone receptor,FSHR)属于G蛋白偶联受体超家族中的糖蛋白亚家族成员,成熟的FSHR是由二硫键构成的稳定低聚体[1]。FSHR与FSH(follicle stimdating hormone,FSH)功能的发挥有着紧密的联系[2]。FSH是由垂体合成并分泌的一种糖蛋白类促性腺激素,在卵泡生长过程中发挥关键作用,但其是一种不能穿过细胞膜的生物大分子,必须通过FSHR特异性介导[3]。因此,FSHR对动物卵泡的发育与成熟具有重要作用,从而对动物繁殖性状造成影响。研究证实,FSHR基因显著影响动物繁殖性状,吴井生等对106头小梅山猪研究发现,FSHR基因第10个外显子存在2个多态位点对小梅山猪产仔数有显著影响,在P1位点上,2胎以上小梅山母猪中AA型个体的总产仔数、产活仔数比BB型分别显著高出1.95、1.66头(P<001);在P3位点上,2胎以上及所有胎次的母猪中,DD型个体的总产仔数和产活仔数均极显著高于CC型(P<0.01)[4]。邢耀潭对12头单胎、92头双胎天祝白牦牛研究发现,FSHR基因 P3片段(-1 195 bp处)在天祝白牦牛单胎群体和双胎群体中,双胎母牛的突变率显著高于单胎母牛的突变率,说明FSHR基因很可能是控制天祝白牦牛双胎性状的主效基因[5]。Chu等统计252只小尾寒羊不同FSHR基因型产羔数的最小二乘平均值和标准差,发现FSHR基因不同基因型产羔数存在极显著差异[6]。
Jiang等于2014年公布绵羊新一代从头测序的基因组信息,绵羊FSHR基因(GenBank登录号为NC_019460)位于第3号染色体上,基因全长196 149 bp,包含9个内含子和10个外显子,外显子总长为2 431 bp,编码395个氨基酸[7]。目前,对动物FSHR基因SNP的研究主要集中于猪[4,8]、牛[5,9]、羊[6,10]等的第10个外显子及5′ 侧翼区,但对FSHR基因其他外显子分析较少。因此,本研究选取高山美利奴羊、青海细毛羊、中国美利奴羊和敖汉细毛羊为研究对象,根据全基因组测序的结果,分析FSHR基因外显子在4个绵羊品种上的单核苷酸多态性(single nucleotide polymorphism,SNP),并对筛选出的SNPs进行生物信息学分析,以期筛选出与4个绵羊品种产羔数相关的遗传标记,为4个绵羊品种多胎性状的研究奠定分子基础。
1 材料与方法
1.1 材料
采集30只高山美利奴羊(甘肃省绵羊繁殖技术推广站)、30只中国美利奴羊(新疆巩乃斯种羊场)、30只敖汉细毛羊(内蒙古敖汉种羊场)、30只青海细毛羊(青海省三角城种羊场)共120只羊血样,每只羊颈部静脉采血5 mL于江苏宇力医疗器械有限公司EDTA-K2抗凝真空采血管中,每只綿羊分别采集2管血液样品,于-20 ℃冰箱冷冻保存,用于DNA提取。
1.2 方法
1.2.1 全基因组测序 4个绵羊品种共120只,分别对每只羊取1管血液并送至北京诺禾致源科技股份有限公司,提取DNA样品(试验过程中须无降解、无污染、无断裂等,以保证所提4个绵羊品种DNA纯度及完整性),经检测合格的4个绵羊品种的DNA样品分别每个样品取2 μg用于10×genomics平台建库,基于Illumina Hiseq平台进行双末端 150 bp 测序。根据2014年公布的绵羊参考基因组Oar_v 40(GCF_000298735.2),利用不同绵羊品种的测序结果序列reads,应用SOAPdenovo(诺禾自主研发软件)进行组装得到长的序列片段,然后利用lastz软件获得4个绵羊品种的每个个体全基因组信息,该试验由北京诺禾致源科技股份有限公司完成。
1.2.2 FSHR基因多态位点筛选 将120个未分群未过滤的SNP vcf文件按照4个品种(高山美利奴羊、青海细毛羊、中国美利奴羊、敖汉细毛羊)进行分群,所用软件为vcftools_v 0114。将分好群的SNP文件进行过滤,过滤条件为:单个样本测序覆盖深度>2、maf(最小等位基因频率)>0.05、mis(缺失)<0.1。根据FSHR基因位置信息:Chromosome 2,NC_000002.12 (48953161-49154527,complement),利用 vcftools_v 0.1.14软件进行4个绵羊品种FSHR基因外显子SNP位点的提取,然后统计各个品种FSHR基因外显子SNP位点数,利用A-NNOVAR软件将各个品种FSHR基因外显子SNP位点进行注释。
1.2.3 FSHR基因多态位点遗传多样性分析 通过生物学分析软件POPGEN 1.32软件统计4个绵羊品种FSHR基因各SNPs位点的野生型、杂合型及突变纯合型的基因型频率、野生型和突变型等位基因频率、Hardy-Weinberg平衡检验,利用群体多态信息含量(PIC)计算程序计算4个绵羊品种FSHR基因各SNPs位点遗传多样性参数多态信息含量(PIC)。
1.2.4 生物信息学分析 4个绵羊品种FSHR基因由于SNPs产生了不同的基因型。利用RNA二级结构分析软件RNAfold进行4个绵羊品种不同基因型的FSHR基因RNA二级结构预测;利用NPSA软件中的MLRC程序进行4个绵羊品种不同基因型的FSHR基因蛋白质二级结构预测;利用蛋白质三级结构预测软件SWISS-MODEL进行4个绵羊品种不同基因型的FSHR基因蛋白质三级结构预测。
2 结果与分析
2.1 4个绵羊品种FSHR基因外显子SNPs筛选
根据4个绵羊品种共120只羊的全基因组测序结果与绵羊参考基因组比对分析4个绵羊品种FSHR基因外显子上存在的多态位点,高山美利奴羊FSHR基因外显子上共发现3个SNPs,包括2个转换位点(C→T、G→A)和1个颠换位点(T→G);中国美利奴羊FSHR基因外显子上共发现7个SNPs,包括6个转换位点(3个G→A、2个T→C和1个C→T)和1个颠换位点(T→G);敖汉细毛羊INHA外显子上FSHR基因外显子上共发现6个SNPs,包括5个转换位点(2个G→A、2个T→C和1个C→T)和1个颠换位点(T→G);青海细毛羊FSHR基因外显子上没有发现突变。通过对4个绵羊品种FSHR基因外显子氨基酸序列进行分析发现,高山美利奴羊发生了3个错义突变,中国美利奴羊存在2个同义突变T817C、T1234C和5个错义突变G149A、G813A、T904G、C975T、G1572A,敖汉细毛羊存在2个同义突变T817C、T1234C和5个错义突变G149A、G813A、T904G、C975T、G1572A,4个绵羊品种FSHR基因外显子均不存在无义突变(表1)。
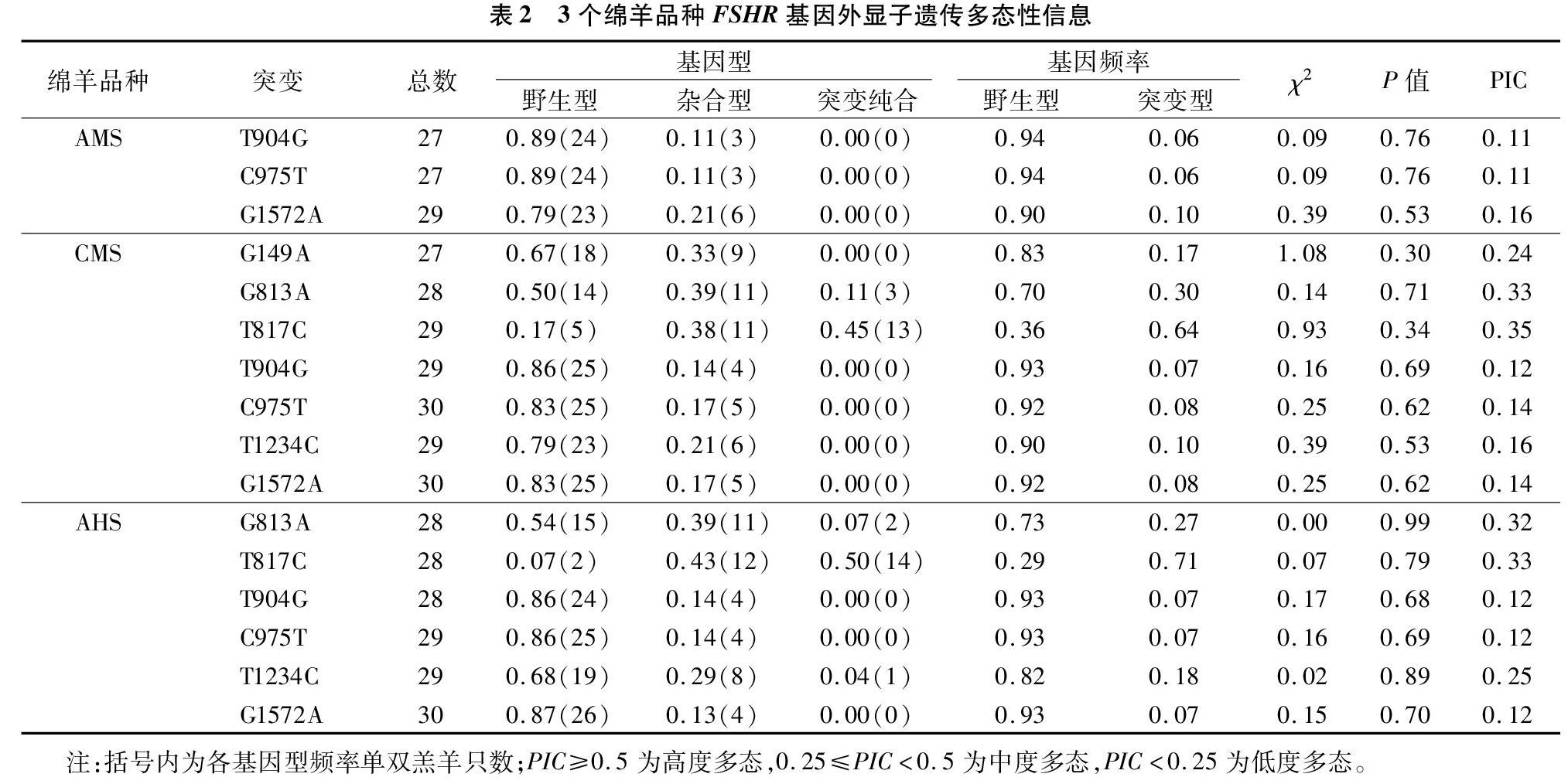
2.2 4个绵羊品种多态位点统计学分析
根据4个品种共120只羊的全基因组测序结果分析高山美利奴羊FSHR基因外显子SNPs位点基因型频率、基因频率、Hardy-Weinberg平衡状态检测(χ2、P值)、群体多态信息含量(PIC)计算结果。高山美利奴羊FSHR基因外显子上检测到的T904G、C975T、G1572A均表现出野生型和突变杂合型2种基因型,野生型基因型频率均高于突变杂合型基因型频率,野生型等位基因T、C、G分别为优势等位基因,均表现为低度多态。中国美利奴羊FSHR基因外显子上检测到的G149A、T904G、C975T、T1234C、G1572A表现出野生型和突变杂合型2种基因型,野生型基因型频率均高于突变杂合型基因型频率,野生型等位基因G、T、C、T、G分别为优势等位基因,均表现为低度多态;中国美利奴羊FSHR基因外显子上检测到的G813A、T817C表现出野生型、突变杂合型和突变纯合型3种基因型,G813A野生型基因型频率高于突变杂合型与突变纯合型基因型频率和等位基因G为优势等位基因,T817C突变杂合型基因型频率高于野生型与突变杂合型基因型频率和等位基因C为优势等位基因,G813A、T817C都表现为中度多态。敖汉细毛羊FSHR基因外显子上检测到的T904G、C975T、G1572A表现出野生型和突变杂合型2种基因型,野生型基因型频率均高于突变杂合型基因型频率,野生型等位基因T、C、G分别为优势等位基因,均表现为低度多态。敖汉细毛羊FSHR基因外显子上检测到的G813A、T817C、T1234C表现出野生型、突变杂合型和突变纯合型3种基因型,G813A和T1234C野生型基因型频率高于突变杂合型与突变纯合型基因型频率和等位基因G、T分别为优势等位基因,T817C突变杂合型基因型频率高于野生型与突变杂合型基因型频率和等位基因C为优势等位基因,G813A、T817C和T1234C都表现为中度多态;高山美利奴羊、中国美利奴羊和敖汉细毛羊FSHR基因外显子上检测到的所有突变位点χ2值均未达到显著水平(P>0.05),说明3个绵羊品种FSHR基因外显子上检测到的所有突变位點均达到Hardy-weinberg平衡状态(表2)。
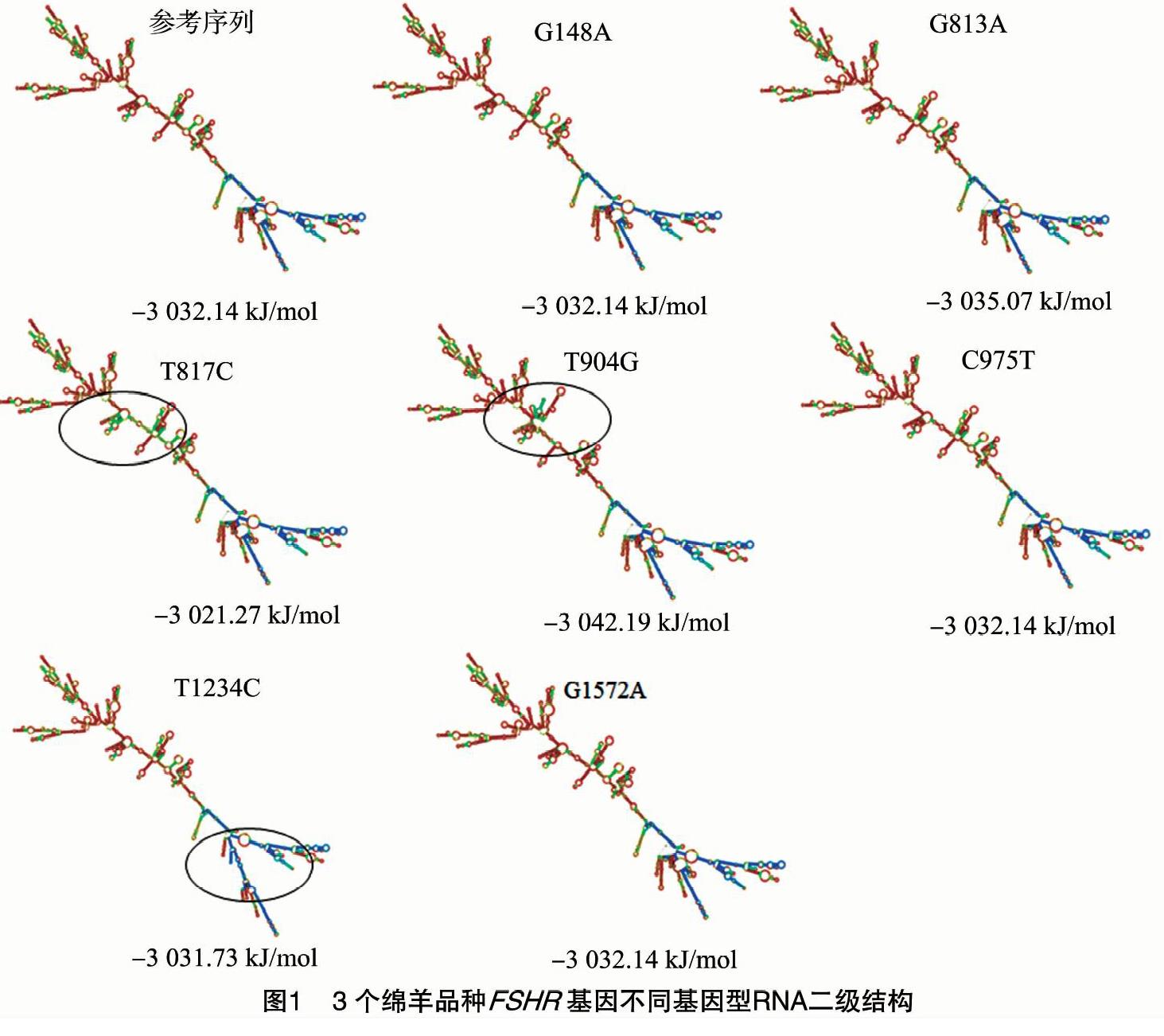
2.3 FSHR基因的RNA二级结构分析
利用RNA二级结构分析软件RNAfold预测3个绵羊品种不同基因型的FSHR基因mRNA二级结构,结果(图1),表明G149A、C975T、G1572A位点的突变不会导致最小自由能的改变,G149A、C975T、G1572A位点的变异也不会导致mRNA二级结构的改变;G813A位点的突变最小自由能增加,结构稳定性降低,G813A未导致mRNA二级结构的改变;T817C、T904G和T1234C位点的突变均导致FSHR基因最小自由能改变,其中T817C导致FSHR基因RNA二级结构最小自由能降低,二级结构稳定性增加,T904G和T1234C位点的突变导致FSHR基因RNA二级结构最小自由能增加,二级结构稳定性降低,T817C、T904G和T1234C位点的突变导致FSHR基因mRNA二级结构的改变。
2.4 FSHR基因多态位点蛋白质二级结构预测
利用NPSA软件中的MLRC程序进行4个绵羊品种不同基因型的FSHR基因蛋白质二级结构的预测,结果表明,FSHR基因编码蛋白质为全α蛋白,不存在β-转角。错义突变G149A位点使编码蛋白质无规则卷曲所占比例减少,扩展链所占比例增加,α-螺旋所占比例不变;错义突变G813A位点使编码蛋白质α-螺旋所占比例减少,无规则卷曲与扩展链所占比例增加;错义突变位点T904G使编码蛋白质无规则卷曲与α-螺旋所占比例减少,扩展链所占比例增加;错义突变位点C975T使编码蛋白质无规则卷曲所占比例减少,α-螺旋与扩展链所占比例增加;错义突变位点G1572A使编码蛋白质无规则卷曲与扩展链所占比例减少,α-螺旋所占比例增加。
2.5 FSHR基因多态位点蛋白质三级结构预测
利用蛋白质三级结构预测软件SWISS-MODEL进行3个绵羊品种不同基因型的FSHR基因蛋白质三级结构的预测,结果表明,3个绵羊品种各错义突变位点导致FSHR基因蛋白质三级结构发生明显改变,与蛋白质二级结构预测结果相一致。
3 讨论
羊的繁殖性状是影响羊养殖业的重要经济性状,直接影响绵羊养殖业的生产成本与生产效益,限制绵羊养殖业的发展,因此提高绵羊的繁殖性能对畜牧业的发展具有十分重要的意义[11]。大量研究表明,FSHR与哺乳动物的繁殖性状有密切的关系,例如雌性动物卵巢功能[12-13]、卵泡生长发育[14]和雌性动物睾丸发育[15]、精子发生[16]、精子活力与精液质量[17-19]等。近年,关于哺乳动物FSHR基因多态性与多胎性状之间的关系研究较多。许瑶等研究猪FSHR基因外显子10的多态性与产仔数间的关联分析发现,FSHR基因可作为提高猪产仔数的分子标记[8]。陈祥等对220只产羔记录完整的黔北麻羊FSHR基因SNPs位点的不同基因型与繁殖性状进行分析,在C1246A位点,黔北麻羊群体中BB型个体的产羔数与AA型和AB型差异显著(P<0.05)[10]。Pan等对FSHR基因的5′侧翼区与产羔数进行关联分析,发现绵羊FSHR基因与绵羊产羔数极显著相关(P<0.01),CC的基因型比TC和TT多0.42(P<0.01)和0.53(P<0.01),表明绵羊FSHR基因可以作为提高绵羊产羔数候选基因[20]。
由上述研究可推测,FSHR基因多态性与高山美利奴羊、青海细毛羊、中国美利奴羊、敖汉细毛羊的多胎性状也存在相关性。本研究通过分析4个品种全基因组测序结果,首次对4个绵羊品种FSHR的全外显子的单核苷酸多态性进行研究。研究发现,高山美利奴羊FSHR基因在外显子上存在3个多态位点(T904G、C975T、G1572A),中国美利奴羊FSHR基因在外显子上存在7个多态位点(G149A、G813A、T817C、T904G、C975T、T1234C、G1572A)、敖汉细毛羊FSHR基因在外显子上存在6个多态位点(G813A、T817C、T904G、C975T、T1234C、G1572A)。4个品种之间检查结果与龙威海等对黔北麻羊FSHR基因的检测结果[21]及王惠娥等对多浪羊和卡拉库尔羊FSHR基因的检测结果[22]存在差异,可能是由地域不同造成的自然选择不同或者是品种的不同造成的。基因外显子编码氨基酸序列,外显子上的单核苷酸突变可能会造成RNA二级结构、蛋白质二级结构、蛋白质三级结构改变,进而对其生物学功能造成影响[23]。本研究所检测7个SNPs中T817C、T904G、T1234C既使mRNA的二级结构发生改变,又改变了最小自由能,G813A只改变最小自由能,mRNA二级结构未发生改变,G149A与C975T、G1572A既没有使最小自由能发生改变,又没有改变mRNA的二级结构。碱基突变会导致蛋白质二级结构发生改变,本研究对4个品种所检测的7个多态位点中5个错义突变位点(G149A、G813A、T904G、C975T、G1572A)进行蛋白质二级结构分析发现,5个突变位点会导致 α-螺旋、无规则卷曲、扩展链的比例发生改变,进一步分析蛋白质三级结构发现错义导致蛋白质三级结构的改变,对FSHR基因功能是否造成影响还需要进一步的试验研究。
本试验为高山美利奴羊、青海细毛羊、中国美利奴羊、敖汉细毛羊的FSHR基因多态性与多胎性相关性的研究提供了参考,后续试验研究将进一步分析试验结果中的各品种FSHR基因SNPs位点与绵羊多胎性状相关性,研究FSHR基因多态性对绵羊产羔数的影响。
参考文献:
[1]Dattatreyamurty B,Smith R A,Zhang S B,et al. The size of the mature membrane receptor for follicle-stimulating hormone is larger than that predicted from its cDNA[J]. Journal of Molecular Endocrinology,1992,9(2):115-115.
[2]Casarini L,Moriondo V,Marino M,et al. FSHR polymorphism p.N680S mediates different responses to FSH in vitro[J]. Molecular and Cellular Endocrinology,2014,393(1/2):83-91.
[3]Jiang X L,Liu H L,Chen X Y,et al. Structure of follicle-stimulating hormone in complex with the entire ectodomain of its receptor[J]. Proceedings of the National Academy of Sciences of the United States of America,2012,109(31):12491-12496.
[4]吳井生,王金玉. FSHR基因第10外显子多态性及其与小梅山猪产仔数的相关性[J]. 中国农业科学,2012,45(13):2728-2736.
[5]邢耀潭. 天祝白牦牛FSH、FSHR基因多态性分析与双胎性状的关联研究[D]. 兰州:甘肃农业大学,2011:22-26.
[6]Chu M X,Guo X H,Feng C J,et al. Polymorphism of 5′regulatory region of ovine FSHR gene and its association with litter size in Small Tail Han sheep[J]. Molecular Biology Reports,2012,39(4):3721-3725.
[7]Jiang Y,Xie M,Chen W B,et al. The sheep genome illuminates biology of the rumen and lipid metabolism[J]. Science,2014,344(6188):1168-1173.
[8]许 瑶,刘 畅,牛 熙,等. 香猪FSHR基因外显子10的多态性及其与产仔数间的关联分析[J]. 中国畜牧兽医,2017,44(3):799-806.
[9]雷雪芹,魏伍川,陈 宏. 6个牛品种在FSHR基因位点的遗传关系及其多态对双胎性状的标记[J]. 西北农林科技大学学报(自然科学版),2004,32(7):1-6.
[10]陈 祥,龙威海,孙振梅,等. 贵州地方山羊FSHR基因与繁殖性状的相关性研究[J]. 农业生物技术学报,2017,25(1):94-101.
[11]王建英,曹顶国,刘昭华,等. 绵羊多羔性状候选基因的研究进展[J]. 草食家畜,2017(3):1-8.
[12]Laan M,Grigorova M,Huhtaniemi I T. Pharmacogenetics of follicle-stimulating hormone action[J]. Current Opinion in Endocrinology Diabetes and Obesity,2012,19(3):220-227.
[13]Boudjenah R,Molina-Gomes D,Torre A A,et al. Genetic polymorphisms influence the ovarian response to rFSH stimulation in patients undergoing in vitro fertilization programs with ICSI[J]. PLoS One,2012,7(6):e38700.
[14]李俊杰,贾 青,张正珊. 雌性哺乳动物促卵泡素受体与促黄体素受体的结构与表达[J]. 生命的化学,2003,23(4):289-291.
[15]Lend A K,Belousova A,Haller-Kikkatalo K A,et al. Follicle-stimulating hormone receptor gene haplotypes and male infertility in estonian population and meta-analysis[J]. systems Biology in Reproductive Medicine,2010,56(1):84-90.
[16]Wu Q Y,Shai Y C,Xia X Y,et al. FSH and FSHR gene polymorphisms and male infertility:an update[J]. National Journal of Andrology,2015,21(11):1031-1031.
[17]Sang L,Du Q Z,Yang W C,et al. Polymorphisms in follicle stimulation hormone receptor,inhibin alpha,inhibin bata A,and prolactin genes,and their association with sperm quality in Chinese Holstein bulls[J]. Animal Reproduction Science,2011,126(3/4):151-156.
[18]Lazaros L,Xita N,Takenaka A,et al. Synergistic effect of follicle-stimulating hormone receptor and androgen receptor gene variants on semen quality[J]. Andrologia,2013,45(5):339-344.
[19]Zhylkova I S,Sotnik N N,Yegunkova O V,et al. Analysis of single nucleotide polymorphisms G919A and a2039G of gene FSHR in infertile men[J]. Cytology and Genetics,2018,52(2):132-138.
[20]Pan X,Liu S,Li F,et al. Erratum to:molecular characterization,expression profiles of the ovine FSHR gene and its association with litter size[J]. Molecular Biology Reports,2014,41(12):7749-7754.
[21]龍威海,丁 玫,冯文武,等. 卵泡刺激激素受体基因(FSHR)在贵州地方山羊的多态性及表达研究[J]. 农业生物技术学报,2015,23(6):755-761.
[22]王惠娥,王 永,汪 澜,等. 南疆绵羊FSHR基因第10外显子多态性检测及序列分析[J]. 黑龙江畜牧兽医,2017,17)(17):114-117,294.
[23]杨 红,孙 鹃,裘贵华,等. 3个贵州地方鸡种NKX2-5基因多态性及生物信息学分析[J]. 中国畜牧兽医,2014,41(12):209-214.
