生物3D打印高分子材料发展现状与趋势
2019-01-16毛宏理顾忠伟
毛宏理,顾忠伟
(南京工业大学 材料科学与工程学院,江苏 南京 211816)
1 生物3D打印概述
3D打印,又称增材制造,已广泛应用于航天航空、国防军事、健康医疗、文化教育等领域[1, 2]。该技术的产生与发展带来的不仅仅是制造模式的变化、技术的创新,更重要的是观念的创新、思维模式的创新,它最终将带来制造业的翻天覆地的变化[3, 4]。其核心价值主要体现在:① 通过3D打印技术能够直接制造出传统生产方式所不能制造的个性化、复杂度高的产品;② 3D打印技术可以快捷、方便、短周期、低成本地生产制造出传统生产方式虽然也能制造,但投入成本高、周期长的产品,有效解决了个性化定制与规模化批量生产的矛盾。
生物3D打印作为3D打印的一个重要分支,是基于“增材制造”的原理,以特制生物“打印机”为手段,以加工活性材料包括生物材料、生长因子、细胞等为主要内容,以重建人体组织和器官为目标的跨学科、跨领域的新型再生医学工程技术,也是3D打印目前最富有生命力和发展潜力的核心组成部分,代表了目前3D打印技术的最高水平之一[5-8]。
1.1 生物3D打印技术
根据所打印基质材料的不同,生物3D打印分为金属3D打印、陶瓷3D打印、聚合物3D打印、细胞生物3D打印等,分别涉及不同的打印设备、技术和工艺[9-11]。本文将着重介绍聚合物3D打印和细胞生物3D打印的研究概况。
1.1.1 聚合物材料3D打印
聚合物材料3D打印技术主要包括激光选区烧结技术(selective laser sintering, SLS)、熔融沉积技术(fused deposition modeling, FDM)、立体光固化技术(stereo lithography appearance, SLA)以及聚合物喷射技术(PolyJet)(图1)。
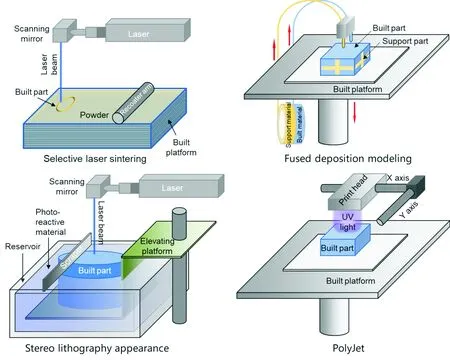
图1 4种常见的聚合物材料3D打印技术[12-17]Fig.1 Main technologies used for polymer 3D printing[12-17]
SLS是控制激光在铺设好的粉末上方选择性地对粉末进行照射,激光能量被选区内的粉末吸收并转换为热能,加热到烧结温度的粉末颗粒间接触界面扩大、气孔缩小、致密化程度提高,然后冷却凝固变成致密、坚硬的烧结体过程[12-14]。目前,采用该技术成型的常用聚合物主要为尼龙(PA)、聚醚醚酮(PEEK)等材料。该技术起源于美国德克萨斯大学澳斯汀分校(University of Texas at Austin),于1988年研制成功了第一台SLS成形机。随后,由美国的DTM公司将其商业化,2001年,DTM被3D System公司收购。
FDM成型是将丝状原料通过送丝部件送入热熔喷头,然后在喷头内被加热融化,在电脑控制下喷头沿着零件截面轮廓和填充轨迹运动,将半流动状态的材料送到指定位置并最终凝固形成成品[15]。该技术是20世纪80年代末,由美国Stratasys公司发明的技术。在健康医疗领域,FDM 3D打印通常用来制作等比例实体模型,用于术前模拟手术、培训、展示等。
PolyJet工作原理与传统喷墨打印机十分类似,不同的是喷头喷射的不是墨水而是光敏聚合物[16, 17]。该技术由以色列Objet公司在2000年初推出专利技术,后该公司被Stratasys公司收购。目前该技术产品主要包括Stratasys公司的Objet 、Connex、 EDEN等系列产品,医疗健康领域聚合物PolyJet 3D打印产品多集中在手术规划用的医疗模型、手术导板等。
1.1.2细胞生物3D打印
细胞生物3D打印的主要方式是将细胞等具有生物学功能的材料通过注射器挤压式预置组成特定的形体组织,打印制备活体器官和组织。
(1)细胞生物3D打印机原理
根据工作原理的不同,现阶段细胞生物3D打印所采用的成型技术主要分为喷墨、微挤压和激光辅助这3种方法(图2)[18-24]。如表1所示,3种打印方式具有各自不同的优缺点。
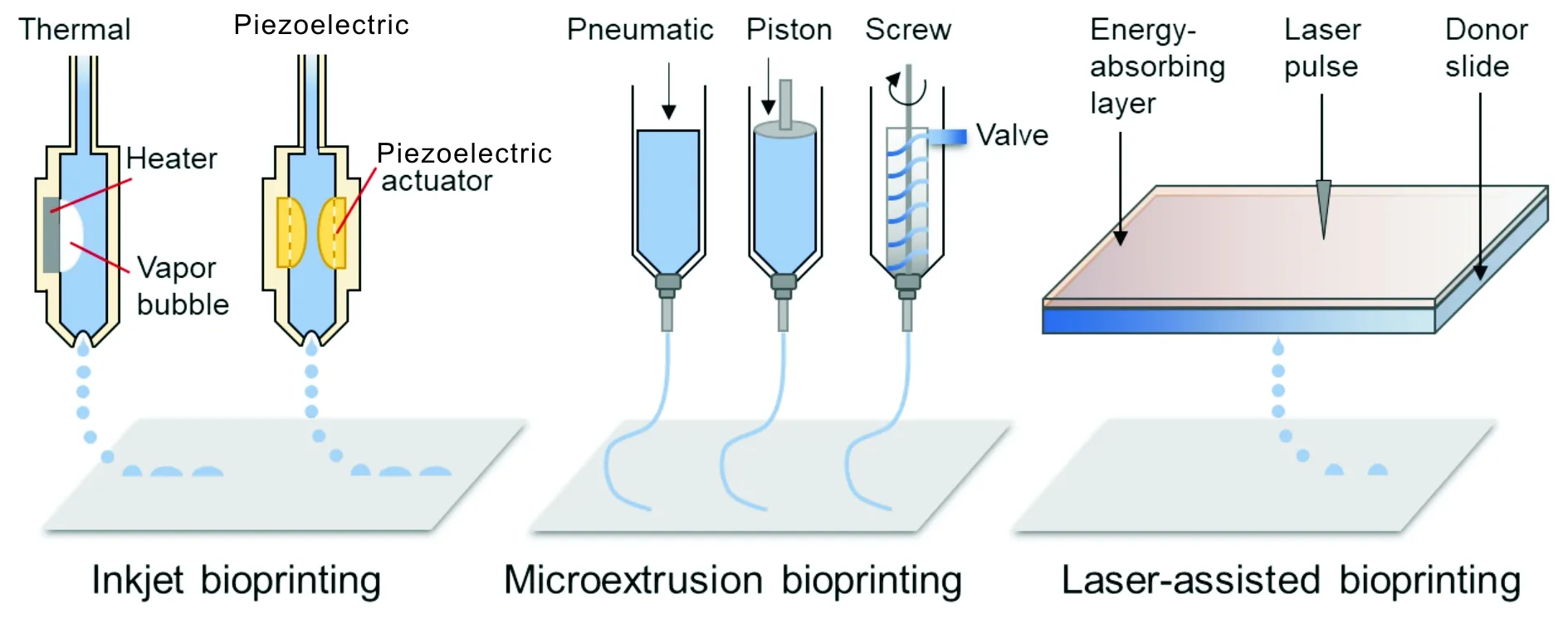
图2 现阶段细胞生物3D打印所采用的技术[18-24]Fig.2 Main technologies used for cell biology 3D bioprinting[18-24]
喷墨式生物3D打印是3种打印方式当中技术门槛最低的。常见的喷墨式打印机通过将墨水换成粘稠度相近的生物墨水,就可以实现最简单的二维生物打印。它的原理就是在喷嘴处利用压电陶瓷或者微型的加热器,在喷嘴处瞬间产生一个升压,将生物墨水从喷嘴挤压出去,从而形成液滴。
挤出式的细胞打印技术中,常见的是向生物墨水的管路系统用气泵增压,使得管路内部压强比外界要大,从而使内部生物墨水从喷嘴流出。除使用气泵之外,也有使用活塞或螺旋杆等方式的,其能够打印粘度更高的生物墨水。
除以上两种之外,激光辅助式生物打印技术(LaBP)在2004年出现技术原型。现在的LaBP技术原理是将生物墨水涂覆在镀制在透明玻璃板上的吸收层之上,形成玻璃板-吸收层-生物墨水层的三层结构,然后脉冲激光聚焦在吸收层上,使得照射位置的生物墨水层,有一小部分溶液气化膨胀,将该处的生物墨水挤离表面,形成射流,然后沉积在接收基板上。
(2)细胞生物3D打印主要技术难点
首先是细胞活性。对于喷墨式与挤出式打印,其难点在于生物墨水流出时承受的剪切力会损伤细胞,尤其是喷嘴尺寸减小后,而喷嘴尺寸决定了打印精度,细胞活性和打印精度难以兼得。
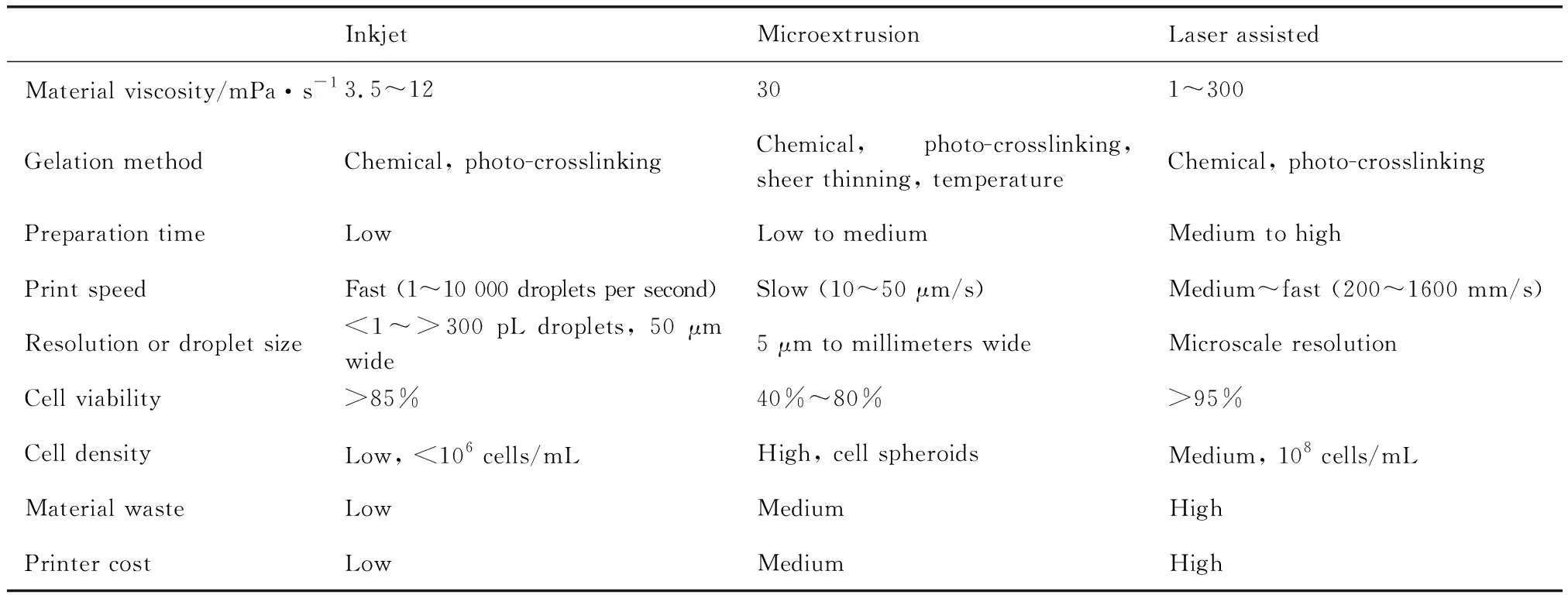
表1 细胞生物3D打印所采用的3种打印方法的各自特点
其次是交联成型。生物墨水图样化需要通过温控、化学处理、紫外照射等方式固定成型。然而这些交联方式都会对细胞、蛋白质等材料造成损伤。
第三是高通量,即多材质细胞生物3D打印技术。对于具备一定功能的生物组织,其内部应该具备多种细胞、蛋白、生长因子等,材料分布非常复杂,精度非常高。这对打印技术提出了巨大的挑战。
1.2 生物3D打印在健康医疗领域中的应用
事实证明,3D打印技术与医学的结合能够解决很多传统医学很难甚至是无法解决的难题。例如,传统医学能够获得患者的三维影像学资料,却不能提供更为直观形象的三维实体模型,尤其是复杂的病损部位。因而,3D打印在医疗健康领域具有重要的研究意义与应用价值。
(1)3D打印仿真解剖模型让医学教学更直观(图3a)。人体解剖学是3D打印应用最多的基础学科。人体解剖学是最重要的一门基础医学学科,其中尸体解剖又是最重要的教学手段。尸体解剖不仅实践性强,更可使学生直观了解人体器官结构、位置、相互关系,促进学生对人体结构与疾病关系的认识。然而,目前越来越多的国家及地区面临着尸体短缺的情况,无法满足教学需要。因此,利用3D打印制备解剖结构模型甚至是标准化“人造尸体”(artificial cadavers)用于解剖学教学成为了近年来研究的热点。3D打印出的解剖模型可解决标本短缺及相关伦理问题,有效避免学生对尸体“恐惧”感,提高教学质量。同时,3D打印出的解剖模型易于保存、搬迁,不易损坏,且可实现快速批量生产,具有较高的性价比。此外,通过3D打印技术可对经典病例、罕见临床情况进行忠实记录和高度复制,使医学教学不再局限于基本知识的技能讲授,这一应用将对高级研修培训和技术探索产生积极的影响。
(2)3D打印将推动个性化和精准化医疗快速发展。个性化和精准化医疗是未来医疗发展的重要方向,目前3D打印助力个性化精准医疗的发展主要体现在两个方面。一是在针对人体“硬性支撑”(牙齿、盆骨、关节、心脏支架和骨骼修复等)应用方面的个性化定制。以矫正义肢为例,3D打印技术可以实现患者截肢部分的1∶1复制,为截肢患者定制出完美契合的假肢(图3b)。又比如,当前口腔医疗中所用的人工牙种植体,都是统一标准件型号,尺寸相对固定,很难与患者的拔牙窝完全吻合;而且种植手术操作非常复杂,整个治疗周期长达6~8个月。而结合3D打印技术,可以高精度、低成本、高效率重塑患者原来的牙齿,省去预备植牙孔、植入骨粉等步骤,不仅缩短治疗周期,同时还能达到微创、精准、快速治疗的目的(图3c)。二是针对复杂、罕见、高难度病例的术前规划与精准演练。每个人的身体构造、病理状况都存在特殊性和差异化,尤其是病情复杂、罕见的患者,考虑到手术风险较大,医生可借助3D打印技术,将患者病变部分按照1∶1的比例完整打印出来。这不仅为医生设计手术方案提供精准的三维立体结构数据,也可在更直观更真实的前提下预演整个手术过程,完善手术规划,从而提高真实手术的精准度,降低手术风险。此外,针对不同患者,3D打印个性化手术导板,能够有效减少手术的创伤和出血量,大大缩短手术时间,提高手术准确度。因而,与传统医疗技术相比,在尊重和掌握个体差异的基础上,3D打印技术能够实现真正个性化定制,使医疗更加精准化。
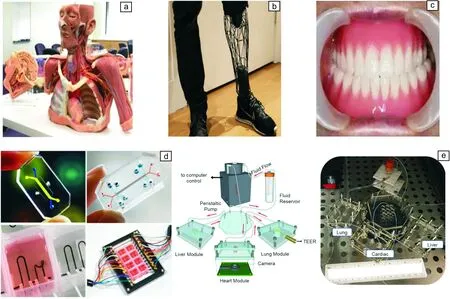
图3 生物3D打印在生物医学领域的应用范例:(a)澳大利亚Monash University团队开发仿真医学模型,(b)Adam Root公司开发的3D打印Exo-Prosthetic假肢,(c)北京大学口腔医院自主研发的3D打印全口义齿,(d)Harvard University研发的系列3D打印器官芯片(Organ-on-a-Chip),(e)Wake Forest Institute for Regenerative Medicine开发的多模块3D打印器官芯片Fig.3 Typical examples of the applications of 3D bioprinting in biomedical field: (a) 3D printed anatomy from Monash University, (b) 3D printed exo-prosthetic from Adam Root, (c) 3D printed denture from School of Stomatology of Peking University, (d) 3D printed Organ-on-a-Chip from Harvard University and (e) developed by experts in Wake Forest Institute for Regenerative Medicine
(3)生物3D打印将有助于解决新药筛选周期长、成本高和效率低的问题。医药市场需求不断增长,医药创新格局越来越受企业关注。然而,在制药过程中,由于缺乏准确的药物筛选模型,新药研发一直是个高成本、低效率和高风险领域。国际上单个创新药物的开发成本普遍超过10亿美元,耗时10年左右。理论上来讲,进行药物筛选最佳的方法是用人体,但这是法律道德不允许的。目前的药物筛选技术主要是高通量药物筛选和动物模型药物筛选。其中高通量药物筛选模型与体内环境差异大,药物筛选相关率小于1%;动物模型则存在种属差异和周期长等缺点,筛选无关率达58%,平均每100个动物试验结果,好的药物只有不到10个可以走完临床试验,这使得新药的转化率极低。生物3D打印可以精确地堆叠各种细胞及支架材料,形成接近实际器官组织的结构,同时其细胞也可采用人类的细胞,恰好可以弥补目前常用的两大药物筛选方式的缺点。因而,用生物3D打印出来的组织器官进行药物筛选,将给整个药物筛选体系带来革命性的改变(图3d和3e)。未来几年,生物3D打印或将迎来一段突破期,打开一个全新的市场。
(4)生物3D打印将有望解决器官移植来源匮乏问题。迄今为止,许多医学难题诸如肾衰竭、恶性肿瘤等,临床上的行之有效的治疗方式仍为器官移植手术,然而异体器官移植一直以来都存在着供体不足的问题。在美国,根据美国器官资源共享网络(UNOS)公布,每1.5 h就有1例病人因为等不到合适的器官移植而死亡,每年有超过800万例患者需要进行组织修复相关手术。在我国,据统计每年大约有150万人因末期器官功能衰竭需要器官移植,但每年却仅有约1万人能得到器官移植的救治,有限的活体器官来源满足不了患者需求。单以肾移植手术为例,每年进行移植的患者为3000人,而需求者高达30万。大多数患者只能在等待配体的过程中病情恶化甚至离世。与此同时,中国需要接受器官移植的患者数量还在以每年超过10%的增量扩大。另外,器官移植后还存在免疫排异反应,需要长期进行免疫抑制治疗。有鉴于此,临床上急需一种行之有效的方法,以解决供体器官的短缺和器官移植出现的排异反应等问题。生物3D打印技术的出现及快速发展为组织/器官短缺的问题提供了全新的解决方案。研究表明,生物3D打印可以以自身的成体干细胞经体外诱导分化而来的活细胞为原料,在体外或体内直接打印活体器官或组织,从而取代功能丧失的器官或组织。目前,生物3D打印在器官移植领域已取得了一定的成绩,被应用于皮肤、骨骼、人造血管、血管夹板、心脏组织和软骨质结构的再生与重建。
2 生物3D打印材料特性要求
2.1 可打印性
可打印性指的是材料能够在空间和时间维度上精准可控增材成型的性能,即用于打印的材料必须可以在一定的时间内精确地沉积在所指定的空间内,该性能直接关系到3D打印产品是否能取得期望的结构与尺寸精度。针对不同的打印工艺,对材料可打印性的需求也会有所不同。例如喷墨打印,对材料粘度有很大的限制,同时需要材料具有能够快速交联的性能以促进复杂3D结构的分层成型;而微挤压打印,则可以使用高粘性材料,以保持打印后初期的3D形状,并可通过打印后的交联形成最终稳定的结构,因而要求材料应具有特定的交联机制或剪切稀化性质。
在进行载细胞生物打印时,打印参数如喷头尺寸,会直接影响到材料内细胞所受到的剪切应力及材料沉积形成3D结构所需的时间[25, 26]。因此,在考量材料可打印性能时应同时考虑到材料对细胞活性的保护能力[27]。例如,热喷墨打印和激光辅助打印都涉及到材料的局部加热,因而具有低热导率或在打印过程中具有热缓冲能力的材料将会有利于细胞活性和功能的维持。打印后的细胞存活率随打印机规格、材料特性、打印分辨率和细胞类型的不同而显著变化,但通常情况下,喷墨生物打印的细胞存活率大于85%,微挤压打印的细胞存活率为40%~80%,激光辅助打印的细胞存活率高达90%。
细胞生物打印所用的生物墨水为典型的软物质材料,其打印性通常包括3层含义:① 生物墨水的粘度要能调控,比如通过温度变化、剪切应力等。只有粘度可调才能设计出适合的打印方式及打印参数。② 生物墨水在打印前需要是流体或半流体状态,以避免堵塞喷嘴,打印后要能迅速固化以保持形状。在逐层打印的过程中,不同层间的粘结也非常重要,这决定了该材料或该打印工艺是否是真正的3D打印。③ 拥有或能找到针对该材料的打印窗口或工艺参数区间。目前有大量的看起来很理想的新型生物材料或生物墨水的研发报道,但最终因这些墨水只能局限于某些简单的成型,而失去实际应用价值。
2.2 生物相容性
随着组织工程与再生医学研究的深入,人们对生物相容性的认识已从最初的要求材料能够与组织器官共存,且不引起宿主任何不良的局部或系统反应,发展到植入材料需要与宿主产生积极的相互作用,包括与宿主组织和/或免疫系统的相互作用,以达到调控宿主细胞、组织和器官活性与功能的目的[28, 29]。目前,3D打印用于体外辅助医疗时,包括打印体外使用的医学模型、医疗器械、康复辅具、假肢、手术导板等,对材料生物相容性的要求较低,只需要材料能够提供适合的力学强度和可打印性能。当3D打印用于制备植入性医疗器械产品(如3D打印骨骼、软骨、关节、牙齿、义眼等永久植入替代物)、组织工程支架以及含细胞的组织器官替代物时,要求材料应具有良好的生物相容性。
从材料角度讲,生物相容性主要受材料的化学组成、结构形态(如多孔结构/丝状结构)、表面特性(如亲疏水性)、表面电荷以及材料的力学性能、物理化学特性等因素的影响[30, 31]。因此,为提高3D打印材料生物相容性,可以对材料:① 进行表面改性,如改变材料拓扑结构(包括微纳米尺度结构)、调控材料的表面亲疏水性(研究表明,较强的亲水性及较强的疏水性都有可能提高材料的生物相容性)、改变材料表面的电荷强度以及制备活性分子的表面涂层;② 进行不同类型材料的杂化,如结合天然与合成材料二者的优点来改善材料力学性能等的同时,提高材料的生物相容性;③ 通过仿生原理,制备出与生命体具有相同或相似结构与性能的材料;④ 复合材料的研制,如将高分子材料与纳米材料/生物活性因子等复合,制备生物相容性材料。
2.3 力学稳定性
材料具有一定的力学强度,能够一定程度上抵抗外界作用力,维持打印物的形貌结构,对于打印物功能的发挥起着重要作用[32, 33]。在材料打印过程中,应根据实际应用目标,选择设计具有不同力学特性的打印材料。例如,在3D打印构建组织器官的相关研究中,应根据不同靶组织器官(如皮肤、肝脏、软骨、骨等)所需的结构力学环境,选用具有相应力学特性的打印材料。另外,在打印过程中,尤其是必须选用力学性能较差的天然高分子材料进行打印时,可选择力学性能较好的牺牲材料作为支撑[34, 35]。该支撑材料应在成型或交联稳定后很容易从打印结构中除去,且其自身及其去除时的中间产物对打印物的结构及其它性能不产生负面影响。
2.4 降解特性
理想的生物打印材料,植入体内后应当随着细胞的增殖及细胞外基质(ECM)的产生而逐渐降解,且降解速率应当与细胞产生ECM替换植入材料的速率,及新组织生成的速率相匹配[36]。同时,降解产物也应无毒、易于代谢、能够迅速排出体外。有害降解产物通常包括小分子量蛋白质或其它能够改变机体局部pH值、温度等,进而对细胞的生存和功能产生不良影响的分子。
2.5 仿生功能
近年来随着研究的深入,仿生学对于理想生物材料研发的重要性逐渐彰显出来。研究表明,向打印材料中加入细胞活性配体或将仿生组分加入到生物打印构建体中,可显著改善内源和外源细胞的黏附、迁移、增殖和功能表达等[9, 37]。同时,构建体的微纳尺度环境特征会直接影响到细胞的形态、增殖及分化等[38]。
为构建具有特定生理功能的3D打印材料,ECM将是最好的仿生对象[39-41]。在哺乳动物体内,有超过300种ECM蛋白、多种ECM修饰酶和ECM结合生长因子,以及其他ECM相关蛋白。其中最丰富且研究最多的是胶原蛋白、蛋白多糖和糖蛋白。这些蛋白质提供强度支撑、空间填充、结合生长因子、调控细胞命运、参与细胞信号传导等功能。脱细胞ECM可提供完整的ECM支架,用于ECM组成、空间分布和生物学功能的详细分析[42, 43]。利用3D打印技术精准调控功能性材料的呈现,实现特异性ECM的体外复制,将是构建具有仿生特性材料体系的一个重要方面。
生物打印仿生的另一个方面,则是通过打印细胞或细胞聚集体,使其产生并沉积ECM,自发构建出适合细胞自身生长的微环境,进而促进自身功能的发挥。该方面研究的一个挑战是开发出能够通过生物打印技术将合适的材料恰当地结合到构建体中的方法,同时要确保材料具有合适的降解时间和副产物,并且这些材料在构建体中具有明确可控的结构特征和生物学功能。
3 用于生物3D打印的高分子材料
理想的生物3D打印材料要有合适的粘度、足够的强度、良好的生物相容性及降解性。从制造角度来讲,生物打印材料,尤其是涉及到细胞打印时的打印窗口其实很狭窄。为了保证更好的成形精度,材料需要更高的浓度或交联密度,而这会对细胞的迁移、增殖等造成很大的影响,同时高浓度的打印材料也会增加打印的难度。然而,低浓度的材料却难以定形。因而,找到合适的打印材料仍然是生物3D打印技术取得进一步发展的关键要素。从来源上来分,用于生物3D打印的高分子材料可分为合成高分子材料与天然高分子材料。
3.1 合成高分子材料
3.1.1 PEG
聚乙二醇(polyethylene glycol, PEG)是由环氧乙烷与水或乙二醇逐步加成聚合得到的一类水溶性聚醚。PEG作为一种两亲性聚合物,既溶于水,又溶于绝大多数有机溶剂,且其生物相容性好、无毒、免疫原性低,可通过肾排出体外,不会积累在体内,在生物医药领域具有广泛的应用前景[44-46]。
Gao等[47]使用市售的热喷墨打印机与PEG-二丙烯酸酯(PEGDA,MW 3400)开发出了可用于3D软骨组织工程的生物打印平台。利用该平台可以实现人间充质干细胞(hMSC)的精确分布和排列,打印后3D PEGDA水凝胶中的细胞显示出软骨形成表型,且在培养过程中糖胺聚糖(GAG)和II型胶原蛋白的产生逐渐增加。构建的工程化软骨显示出天然的带状组织、理想的ECM组成和适当的机械性质。
在另外一项研究中,PEG被用作增塑剂对聚乳酸(polylactic acid,PLA)进行改善[48]。研究者利用三维快速成型技术制备出含5%,10%和20%(质量分数)PEG的PLA / PEG共混物,以及PLA / PEG /活性CaP生物玻璃复合物,并详细考察了PEG对PLA基共混水凝胶的增塑效果。研究结果表明,PEG的加入会引起聚合物链的重排、构建物表面形貌的改变及其润湿性和弹性模量的增加。此外,添加10%和20%PEG会产生不均匀的3D结构,具有相对较低的机械性能。体外降解研究表明,PEG的加入显著加速了材料的降解速率。
Tehrania等[49]则用PEG作为增塑剂对纳米纤维素膜的打印性能进行了改进。研究发现,PEG的添加增加了膜在50%相对湿度下的力学强度,也形成了适于印刷的光滑表面。同时,PEG在没有显著降低膜的半透明性的前提下增强了膜的保水能力。该膜在磷酸盐缓冲溶液(PBS)和水中分别表现出600%和超过1000%的溶胀率,表明这些膜可以很好地用作伤口处理敷料。当用含10%和25%PEG的膜孵育成纤维细胞时,未检测到细胞代谢活性的变化。因此,纳米纤维素-PEG膜对人皮肤细胞而言没有细胞毒性。
3.1.2 PLA
PLA作为一种线型热塑性脂肪族聚酯,主要是由淀粉原料经过糖化、发酵及一定的化学反应制备而成。PLA具有很好的生物相容性和生物可降解性,在特定条件下可完全降解,最终产物为二氧化碳和水[50, 51]。除此之外,PLA还具有较好的热稳定性、抗溶剂性,以及优异的光泽度、透明性和一定的耐菌性、阻燃性[52]。
因其独特的性能,PLA被广泛用于骨组织工程的相关研究中。Ritz等[53]利用3D打印技术制备出PLA圆盘以及多孔笼。多种类型的细胞(成骨细胞、成纤维细胞和内皮细胞)在PLA打印的圆盘上均表现出良好的存活、扩散和增殖。装载有SDF-1胶原蛋白的PLA笼子则能够很好地支持内皮细胞的生长并诱导新血管形成。 该研究很好地证明了PLA支架在骨组织工程中的应用潜力。在另外的一篇报道中,研究者利用FDM技术制备出具有不同孔径的PLA支架,并用于骨组织工程[54]。研究发现3D打印过程会引起PLA分子量和降解温度的降低,但没有改变聚合物的半结晶结构。随后,研究者将人骨髓基质细胞(hBMSC)接种到打印的支架中,分别培养3 d和7 d后观察,hBMSC均匀分布在支架内,表现出很高的活性,且与孔径无关。另外一研究小组则提出基于人牙龈间充质干细胞(hGMSC)复合3D打印PLA支架来改善骨组织再生的新治疗策略[55]。研究者详细评估了3D打印PLA支架(3D PLA)、hGMSC细胞、细胞外囊泡(EV)、聚乙烯亚胺(PEI)以及PEI复合EV(PEI-EV)各要素在骨缺损体内外再生中的作用。研究者共设计了6个实验组:3D-PLA、3D-PLA+hGMSCs、3D-PLA+EVs、3D-PLA+EVs+hGMSCs、3D-PLA+PEI-EVs、3D-PLA+PEI-EVs+hGMSCs。研究结果表明,3D-PLA+EVs+hGMSCs和3D-PLA+PEI-EVs+hGMSCs均未显示出细胞毒性,且3D-PLA+PEI-EVs+hGMSCs表现出更高的成骨诱导性。此外,体内实验结果显示,植入皮质颅盖骨组织损伤大鼠中的3D-PLA+PEI-EVs+hGMSCs和3D-PLA+PEI-EVs支架显示出更好的成骨特性和骨愈合情况。因而,重建骨病变组织的完整性可能是治疗意外或手术骨创伤的有效策略。Wang等[56]使用冷大气等离子体(CAP)改变3D打印支架表面的纳米级粗糙度和化学组成,对打印成型的PLA支架进行处理。经CAP处理后,正常3D打印PLA支架的水接触角从(70±2) (°)急剧下降到(24±2) (°)。X射线光电子能谱(XPS)分析表明,CAP处理后氧与碳的比例显著增加,表明CAP处理不仅改变了支架的纳米级粗糙度,而且改变了化学组成,这对增强骨细胞和MSC的附着和功能起着重要作用。
随着骨组织工程研究的不断深入,压应力在构建组织工程骨中的作用越来越受到重视。Senatov等[57]利用羟基磷灰石(hydroxyapatite, HAP)颗粒作为添加剂来增强3D打印PLA多孔支架的力学性能,同时考察了支架在低循环载荷情况下的表现。利用熔丝挤出3D打印技术,研究者制备了PLA-HAP(15%,质量分数)多孔支架,其平均孔径和孔隙率分别为700 mm和30%。在循环载荷试验中,分散的HAP颗粒能够降低支架内缺陷的累积速率,抑制裂缝的生长,使支架具有较大抗裂性。PLA-HAP支架能够在循环加载21 MPa应力的情况下长时间维持其性能不发生变化。因而,通过3D打印获得的PLA-HAP多孔支架有望在循环载荷作用的情况下用作骨小梁的植入物。
3.1.3 PCL
聚己内酯(polycaprolactone,PCL)又称聚ε-己内酯,可通过ε-己内酯单体在金属阴离子络合催化剂催化下开环聚合而成,是一种可生物降解的半晶型聚酯材料[58]。PCL无毒,不溶于水,易溶于多种极性有机溶剂,具有良好的生物相容性、良好的有机高聚物相容性以及良好的生物降解性,自然环境下6~12个月即可完全降解[59-61]。此外,PCL还具有良好的形状记忆温控性质,在加热条件下,表现出良好的粘弹性和流变性,可通过FDM技术进行3D 打印加工[62]。因此,在临床医学研究中,PCL常被用作支架材料,广泛应用于硬组织工程领域[59, 63]。
3D打印PCL用作组织工程支架时,其机械性能及结构稳定性受PCL相对分子质量和支架孔隙几何构型的影响[32]。研究结果表明,相对分子质量对3D打印PCL支架的压缩模量和屈服强度有显著影响。具体而言,相对分子质量为45 000的PCL是制造粘弹性、柔性和承重PCL支架的更可行的选择。此外,3D打印的PCL支架的孔隙率和机械性能之间存在反向线性关系。为提高骨再生效率,研究者打印出富含磷酸三钙(TCP)的PCL多孔支架并用于脂肪间充质干细胞(ADSCs)的递送[64]。结果表明,支架培养的ADSCs较二维(2D)培养的ADSCs具有更高的骨再生效率。TCP的加入对培养在支架中ADSCs成骨分化没有显著的贡献,而3D打印构建的多孔微环境则在ADSCs的成骨分化中发挥重要作用。Hollander等[65]则通过FDM 打印技术构建出基于PCL的T形载药宫内节育器系统(IUS)。研究者以吲哚美辛为模型药物,制备出载药PCL长丝,然后打印出载药IUS。结果表明,相对于打印前PCL长丝,打印成型IUS的药物释放更快,且扩散是该体系药物释放的主要机制。该研究表明,3D打印可以为具有控释功能的植入式装置的制造开辟新的途径。
理想的支架不仅需要模仿天然组织的微米结构,它们还需要能够模仿组织的纳米级EMC特性。为了实现这一点,Wang等[66]通过引入石墨烯来改变PCL支架的表面及生物学特性。与纯PCL支架相比,石墨烯的添加有助于适度降低材料接触角,而用5 mol/L NaOH处理会进一步增加支架的亲水性,进而使细胞具有更好的附着和更为理想的生物学行为。
同时,为了拓宽PCL在生物3D打印中的应用,通常将其与其它材料进行复合。Peng等[67]使用3种不同比例的PCL与聚乳酸-羟基乙酸共聚物(PLGA)混合物制备3D打印支架,并详细评估了支架的表面特征和降解性质,以及人牙周膜干细胞(hPDLSCs)对支架的反应。结果表明,增加PLGA比例会赋予材料更快的降解速度、更平滑的表面和更强的润湿性。此外,PLGA的加入可显著改善hPDLSC在支架上的粘附和增殖,以及更佳的成骨能力。Goncalves等[68]则将HAP和碳纳米管(CNT)混合到PCL基质中,并通过3D打印制备复合支架。获得的支架具有450~700 μm范围内的方形联通孔,含2%CNT(质量分数)支架则是机械性能和导电性的最佳组合。其抗压强度约为4 MPa,与骨小梁具有很好的相容性,且种植的细胞表现出良好粘附和扩散行为。
3.1.4 PEEK
聚醚醚酮(polyetheretherketone,PEEK)是一种半结晶聚合物,在熔融条件下具有突出的熔体流动性能。同时,PPEK具有十分优异的力学性能,与天然骨相似,是一种可用在骨科和牙科中的理想的3D 打印材料[69-71]。同时,PEEK也已被用于外科手术重建、制造解剖模型或患者特异性植入物[72]。
Kang等[73]使用FDM打印技术制造出定制化的PEEK肋骨假体,且该假体的机械行为与天然肋骨的机械行为接近。以天然肋骨骨干的质心轨迹为指导,可以为肋骨假体的形状和所需强度提供相当大的设计自由度。利用该方法制备的肋骨假体已成功植入患者体内,并取得了良好的临床表现。Basgul等[74]利用熔融PEEK长丝的方法,3D打印出腰椎融合器标准件。打印融合器的压缩和剪切强度为传统机加工融合器的63%~71%,而扭转强度为92%。打印速度是3D打印PEEK的重要参数,在3000 mm/min的最高速度下可获得高达20%的孔隙率,从而降低了打印物的强度。PEEK打印件的结晶度与经挤压棒加工成的PEEK支架没有明显差异。
Wu等[75]将利用FDM技术制备的PEEK样品与丙烯腈-丁二烯-苯乙烯(ABS)样品进行了详细的比较。结果表明,虽然PEEK和ABS的压缩模量和弯曲模量之间没有明显差异,但3D打印PEEK样品的机械性能(拉伸强度、压缩强度和三点弯曲强度)高于商业3D打印机打印的ABS样品。具体而言,PEEK样品的拉伸强度、压缩强度和弯曲强度分别为ABS样品的108%,114%和115%,即PEEK打印件的机械性能优于ABS的3D打印件。为进一步提高PEEK的机械性能,未来的研究可聚焦在提高3D打印系统的控制精度和产品成型精度,减少打印过程中孔的形成以及改善打印层间的粘合。
PEEK作为一种半结晶聚合物,其制造过程中的热处理条件可以直接和间接地对其结晶度和机械性能产生影响。Yang等[76]利用可控温的3D打印系统制备PEEK样品,以研究各种热处理条件(环境温度、喷嘴温度和热处理方法)在FDM工艺中,对PEEK的结晶度和机械性能(拉伸强度、弹性模量和断裂伸长率)的影响。实验结果表明,通过调控3D打印温度可以制备出具有不同结晶度和机械强度的PEEK样品。随着环境温度从25 ℃升高到200 ℃,PEEK样品的结晶度从17%增加到31%。喷嘴温度则会影响PEEK晶体熔化、结晶过程、所打印线条之间的界面以及聚合物材料的劣化。打印成型后PEEK样品的热处理则可能导致结晶度和结晶过程的差异。相对于回火或淬火处理,炉冷却或退火可以获得更高的结晶度(36%和38%)和更好的机械性能。
单纯的PEEK为生物惰性材料,具有较差的骨传导性能,因而PEEK植入物与相邻骨的不良整合,阻碍其在临床实践中的应用。为了改善骨-种植体间的界面效应,通常采用改变其表面特性或用生物活性材料浸渍PEEK的策略。Roskies等[77]通过将PEEK打印物内部结构修改为小梁网络并用间充质干细胞浸渍PEEK的方法来改善PEEK性能。结果显示, 3D打印制造的支架孔隙率为(36.38±6.66)%,种植的BMSC和ADSC的形态类似于附着于支架表面和微孔的活成纤维细胞。两种细胞均表现出较高的活性,且ADSCs表现出比BMSCs更高的骨分化效率。
在另外一项研究中,研究者[78]通过儿茶酚胺化学反应开发了一种新型的纳米Ag颗粒(AgNPs)修饰3D打印PEEK。SEM照片显示AgNPs均匀地锚定在PEEK表面上,对革兰氏阴性和革兰氏阳性细菌显示出显著的抗菌作用。同时,与纯PEEK支架相比,用AgNPs修饰的支架可以很好地支持MG-63细胞的增殖以及更高的碱性磷酸酶活性。因此,这种具有抗菌和促进成骨分化双功能3D打印PEEK/Ag材料在临床骨组织修复中具有很好的潜在应用价值。
3.1.5 Pluronic
Pluronic是Poloxamer的一种,为聚氧乙烯聚氧丙烯醚嵌段共聚物的商品名。Pluronic是一类非离子型高分子表面活性剂,在生物打印中经常被用作牺牲材料,起到初期稳定打印构建物或后期形成孔道(形成血管网络)的作用(图4)[34, 79]。它具有良好的可打印性和温度响应凝胶化特性,因而非常适合用作生物3D打印墨水。Pluronic可在4 ℃或更低的温度下发生液化,因此,Pluronic凝胶可以在必要时很容易从打印构建物内被冲洗掉[80]。虽然Pluronic已被广泛用作生物3D打印中的牺牲材料,但其自身的生物相容性不足以支持细胞的长期存活,这也限制了其作为常规生物打印材料直接用于细胞培养。在最近的一项研究中,Müller等[81]报道了一种构建纳米结构Pluronic水凝胶的策略,可以显著提高Pluronic的生物相容性。该研究中,他们将丙烯酸酯和未经改性的Pluronic F127混合,既可以很好地保持Pluronic的可打印性又可通过UV交联获得稳定的3D凝胶结构。随后经洗脱将未反应的Pluronic从交联网络中除去。经14 d的培养后,所装载软骨细胞的存活率从纯丙烯酸化Pluronic水凝胶体系中的62%提高至纳米结构水凝胶中的86%。洗脱除去纳米结构水凝胶体系中未反应的Pluronic会导致3D结构的孔隙率增加,机械强度低,但是可以通过添加丙烯酸甲酯透明质酸(HAMA)来进行改善。这些结果表明Pluronic可以潜在地与其它聚合物结合并用于不同组织构建体的生物打印。
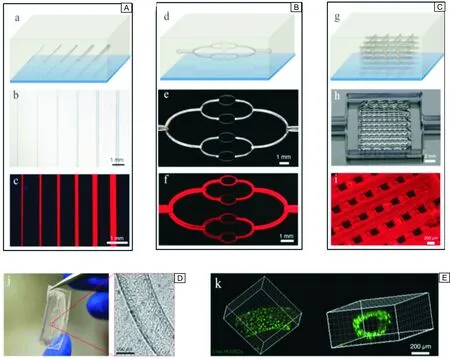
图4 Pluronic作为牺牲材料构建孔道结构:利用 Pluronic 构建的1D(A)、2D(B)和3D(C)孔道结构的示意图、光学照片及荧光照片;灌注HUVECs细胞后的2D孔道结构的光学照片(D)及激光共聚焦照片(E)[34, 79]Fig.4 Vasculature developed by using Pluronic as sacrificial material: schematic illustrations, optical images and fluorescent images of printed 1D (A), 2D (B) and 3D (C) vascular networks; Optical image of representative micro-channel within a 2D vascular network perfused with a HUVEC suspension (D) and confocal image of live HUVEC cells lining the microchannel walls (E) [34, 79]
3.2 天然高分子材料
3.2.1 胶原
胶原(collagen)是动物组织最主要的构造性蛋白质,同时也是ECM最重要的组成成份。由于胶原具有很低的免疫原性、良好的生物相容性及可生物降解性,而被广泛应用于组织工程与再生医学等领域。Koch等[82]使用Ⅰ型胶原负载角质形成细胞和成纤维细胞,并利用激光辅助生物3D打印(LaBP)技术成功构建出多层三维皮肤组织。研究发现,打印成型后两种细胞之间存在胞间通讯,所得到的皮肤构建物也具有组织特异性功能,这为进一步构建复杂的多细胞组织结构奠定了基础。在另一项研究中,研究者[83]利用胶原模拟真皮基质负载角质形成细胞和成纤维细胞,通过逐层打印的方式构建出仿表皮和真皮结构的多层皮肤组织。将打印出的三维皮肤构建体在培养基内浸泡培养后,将表皮层暴露于气-液界面处以促进打印皮肤组织的成熟和分层。组织学和免疫荧光结果表明,3D打印的皮肤组织在形态学和生物学上与天然人体皮肤组织相似,可很好地用作皮肤病生理学研究模型。
Rhee等[84]利用高密度胶原水凝胶通过商业3D打印机成功打印出非均相半月板结构,并详细考察了打印物的结构精准性、力学稳定性和细胞活性。结果表明,对打印沉积表面进行适当加热可极大地提高打印产物的几何精度。当胶原水凝胶浓度为15和17.5 mg/mL时可得到最佳的半月板结构,且其压缩模量随着胶原浓度线性增加,然而打印细胞活性却与胶原凝胶浓度无关。打印成型的半月板结构在体外培养中,可保持其几何形状及细胞活性达10 d。
天然组织/器官具有复杂的分级多孔结构,以赋予细胞高度特异性的功能。但模仿大多数天然组织/器官的分层多孔胶原结构仍然是非常具有挑战性的。为此,Ng等[85]提出了单步按需滴定(DOD)生物打印策略来制造分层多孔胶原基水凝胶,以通过改变胶原原纤维形成过程来调控多层胶原基水凝胶内的孔隙。实验结果表明,通过调控打印在每层上的胶原生物墨水滴的数量,即可以实现分级多孔胶原结构的构建。这种简便的单步生物打印方法为各种组织工程胶原基水凝胶结构的构建提供了新途径。
天然ECM组分复杂,为比较不同组分对细胞生长发育的影响,Park等[86]将胶原与透明质酸进行了详细的对比。他们发现这两种ECM组分,相较于非天然材料水凝胶,都能够更好地促进细胞增殖和细胞功能,但透明质酸对于软骨细胞表现出更好的促进作用,而胶原则更有利于成骨细胞的培养。因此,选择适当的水凝胶材料,对于生物打印构建组织/器官至关重要。
在另一项研究中,胶原被制成可满足打印机喷嘴要求的微纤维(长度为(22±13)μm)[87],然后利用胶原结合结构域(CBD)负载骨形态发生蛋白(BMP2),并混合到甲基丙烯酰胺化明胶内进行载细胞打印。结果表明,打印材料内加入的CBD-BMP2-胶原微纤维在14 d培养期内比成骨培养基更能有效地诱导所负载的BMSC向成骨细胞分化。
另外,胶原还被广泛用作生物打印中的生物纸,即首先打印出类似于标准印刷工艺中纸的作用的胶原底物,通常为胶原水凝胶,然后将负载有细胞的生物墨水或单纯的细胞或细胞聚集体打印在胶原底物表面进行三维结构构建[88, 89]。
3.2.2 明胶
明胶(gelatin)是胶原经部分水解而得到的一类蛋白质,与胶原具有同源性,具有良好的水溶性、可生物降解性、生物相容性和低抗原性。明胶溶液具有温度响应性,可在低温环境下凝胶化(凝胶化具有浓度依赖性)。因而,不同浓度的明胶及其与其它高分子材料的混合物已被用在生物3D打印中。同时,明胶的改性产物,如光反应性甲基丙烯酰化明胶(gelatin methacryloyl, GelMA) 也常被用于生物3D打印。
Zhang等[90]利用明胶-藻酸盐复合材料包裹成肌细胞并研究了利用该材料生物打印软组织结构的机械性能。该打印过程包括两步交联程序:生物打印过程中明胶在低温下的物理交联和生物打印完成后藻酸盐与Ca2+的离子交联。研究者观察到在培养期间载有细胞的构建体的机械强度会降低,但结构的低孔隙率和成角度的几何形状能够维持它们的机械耐久性。同时,尽管细胞活性由于低温影响在打印后最初几天急剧下降,但随着培养时间增加细胞仍会继续增殖。在另一项研究中,明胶-藻酸盐复合材料被用于生物打印构建硬组织结构[91]。研究表明,人类骨肉瘤细胞在这种复合生物基质中呈现出非增殖状态。因此他们提出利用琼脂糖覆盖物填充打印成型的硬组织构建体。此外,研究者还在体系中添加了多磷酸盐-Ca2+复合物以更好地促进矿物沉积。该复合体系显著改善了载细胞构建体的机械性能及细胞增殖活性。
LaBP技术目前也正被广泛用于3D生物打印,然而打印质量有待进一步提高。Xiong等[92]利用明胶作为LaBP的能量吸收层(EAL)材料,考察了其在生物3D打印中的可行性。在该研究中,明胶EAL被施加在石英支撑体和待打印的构建材料涂层(海藻酸盐)之间。由于明胶凝胶的吸收系数较高,特别是在达到最佳打印类型/质量时,所需的激光能量密度也会降低。结果表明,打印后细胞活力提高了10%,DNA双链断裂减少了50%。同时,明胶EAL还有助于降低打印材料的液滴尺寸和平均射流速度。
明胶具有热响应性,因而可以通过温度变化来使其凝胶化以维持所打印结构的形状。然而,温度诱导的凝胶化通常是缓慢且不稳定的。为了解决这一问题,可采用光反应性甲基丙烯酰基对明胶进行改性,并在温和的条件下利用光引发剂通过紫外光照射对其进行共价交联。这种甲基丙烯酰化的明胶,即GelMA,是一种很有应用价值的生物材料,它在甲基丙烯酰基活化期间或光引发聚合过程中,可以很容易地控制交联密度,进而调控最终打印构建物的物理化学性质[88, 89, 93-95]。Bertassoni等[96]报告了一种基于挤出式生物打印机打印载细胞GelMA 生物墨水的策略。研究者通过探讨各种GelMA和细胞浓度以及不同的UV照射时间来评估载有细胞的GelMA的可打印性。使用10% GelMA 可获得良好的打印构建物,且UV照射时间在15 到 60 s之间时对细胞无显著性影响。同时,该课题组通过引入可牺牲琼脂糖,3D打印出基于GelMA的含微通道网络的构建体。在去除这些牺牲层后,可显著改善打印构建物内的质量转运,提高细胞活性以及GelMA基质中成骨细胞的分化。
Liu等[97]利用GelMA的剪切稀化和自愈合性能,通过简单冷却过程实现了载细胞GelMA的物理凝胶打印成型。GelMA可以在物理凝胶后保持形状并形成整体结构,通过随后的UV光照交联实现永久稳定。该方法可以使GelMA能够在相对低浓度(低至3%)下直接打印成型为高度多孔和柔软的结构,同时能够维持细胞较高的增殖、迁移活性。
Kolesky等[79]报道了一种以GelMA为主要基质材料、利用多喷头沉积系统(MHDS)同步打印多种细胞的方法。打印过程中,为了构建血管网络,研究者使用Pluronic F127作为牺牲油墨,在打印完成后通过较低温度液化处理将其除去。该MHDS体系大大减少了构建复杂组织结构所需的打印时间,并且能够维持包封在GelMA中的多种细胞高存活率。
另外,GelMA也被用于金属(例如金属钛)表面修饰。由于其相对低的抗原性和高耐久性,金属钛已广泛地用在生物医疗中。然而,由于钛和组织之间的界面效应,阻止了足够的负荷传递到植入物周围的骨中。随着时间的推移,承重植入物会趋于松动并需要进行手术翻修。因此,为了改善钛植入物与骨的整合,McBeth等[98]利用挤出式生物3D打印机制备出GelMA支架,并直接打印并接枝到钛植入物表面。结果表明,在没有任何外源性成骨因子的情况下,该支架能够触发MG63成骨细胞和原代正常人成骨细胞的矿物质沉积,可有望成为良好的钛植入物替代品。
用甲基丙烯酰基官能团改性明胶,并通过光引发自由基聚合反应进行后加工固化,所产生水凝胶是由长度不可控且不可降解的聚合物链交联而成。为克服这一缺点,Bertlein等[99]开发出了一种烯丙基化明胶材料(GelAGE),可通过硫醇-烯点击化学二聚化反应而固化。该凝胶化过程产生的分子网络具有柔性特性,可提供比甲基丙烯酰化更广泛的生物制造窗口,且该反应没有产生额外的不可降解组分。通过基于光刻(数字光处理)3D打印技术和挤出生物3D打印技术,利用GelAGE可制备出具有高形状保真度的结构(图5),且挤出式生物3D打印GelAGE可维持所打印的软骨细胞的长时间存活。
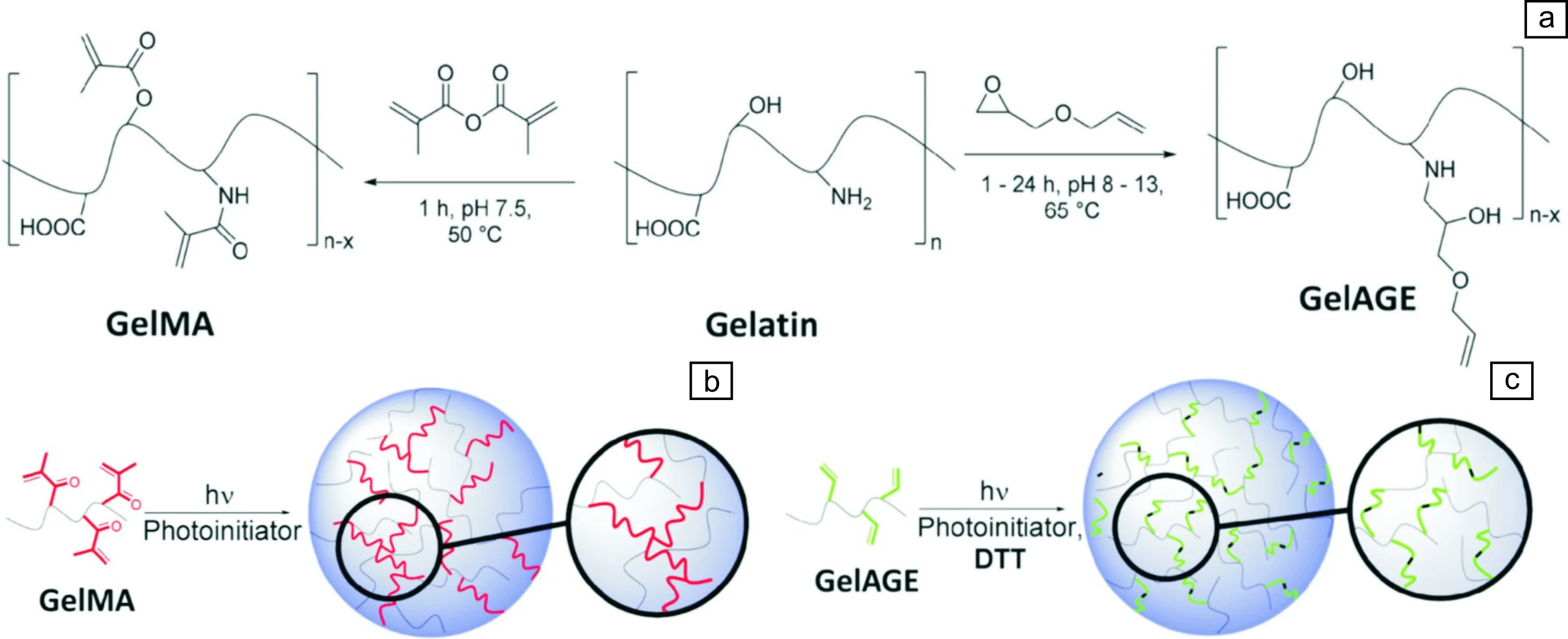
图5 可打印明胶的制备:(a)甲基丙烯酰化明胶(GelMA)及烯丙基化明胶(GelAGE)的合成示意图;(b)GelMA及(c)GelAGE的光固化机理示意图[99]Fig.5 Preparation of printable gelatin: (a) Scheme of the synthesis of GelMA and GelAGE, (b) the free radical polymerization of GelMA, and (c) the controlled dimerization with thiol-ene click chemistry for GelAGE[99]
3.2.3 海藻酸
海藻酸(alginate),又称为海藻酸盐,是从褐藻中提炼出的一种阴离子天然多糖,与人体天然ECM中的糖胺聚糖类似。海藻酸具有低细胞毒性及良好的生物相容性,因而在生物医学中得到了广泛的应用。同时,由于其可在温和的生理条件下快速胶凝化而不会产生有害的副产物,因而被广泛用作生物打印材料。
在多价阳离子与海藻酸形成的水凝胶中,以Ca2+-海藻酸水凝胶研究的最多。例如,Yu等[100]设计出一种同轴喷嘴系统,通过护套挤出藻酸盐溶液,并在芯中输送CaCl2溶液,以此打印出管状结构。随后,他们将软骨祖细胞包裹在藻酸盐中,并通过该同轴喷嘴系统打印出具有良好机械性能和生物学特性的载细胞中空管状构建体。同时研究发现,将藻酸盐浓度从2%增加至6%(w/v)时,由于粘度增加导致挤出剪切应力增加,进而显著降低了细胞活性。在另一项研究中,Zhang等[101]将人脐静脉平滑肌细胞((HUVSMCs)装载在海藻酸盐中,同样使用同轴喷嘴打印方法构建脉管系统导管。研究者除了考察细胞的活性及ECM沉积,还探讨了构建体的脱水、溶胀和降解特征。研究表明在生物打印导管的两个表面上都观察到ECM形成;较高浓度的藻酸盐会导致较低的细胞活性、降解速率、孔隙率和渗透性,而4%藻酸盐浓度表现出最佳的生物打印特性。同样,Gao等[102]使用相同的同轴系统对藻酸盐基生物墨水进行3D打印以制造空心管结构(图6)。初步成型后,他们采用分阶段逐渐浸入CaCl2溶液中的方法对打印构建物进行进一步的交联,该方法对于实现大规模生物打印或大尺寸组织打印构建具有重要意义。
除了被广泛用在挤出式生物打印中,海藻酸还可以作为生物墨水用在LaBP过程中[103]。一个典型打印方法是,将载细胞海藻酸生物墨水涂敷在具有激光吸收层的石英片表面,然后将激光聚焦在石英片的顶部,其光学吸收层将产生局部加热并在下面的细胞-海藻酸涂层中产生蒸汽泡。然后气泡膨胀并迫使海藻酸形成液滴,随后喷射到CaCl2溶液中。在LaBP过程中,凝胶特征参数和海藻酸浓度将影响细胞活性。结果表明,喷射到CaCl2溶液中的海藻酸液滴经2 min凝胶化后,所装载的细胞活性高于经10 min凝胶化处理的细胞,表明载细胞海藻酸较厚凝胶层会阻止氧气和营养物质的运输。研究者进一步考察了海藻酸浓度对细胞活性的影响,他们发现由于传质的局限性,高浓度海藻酸导致低细胞活性。另一研究组采用相似的LaBP技术考察了海藻酸粘度的影响[23]。高粘度海藻酸可通过提高其浓度而获得,并可以用来打印具有更小直径的液滴,提高打印结构的分辨率。由此可以看出,细胞活性和结构分辨率似乎存在相互平衡的作用。因此,为满足不同的应用需求,需要精确调控海藻酸浓度。
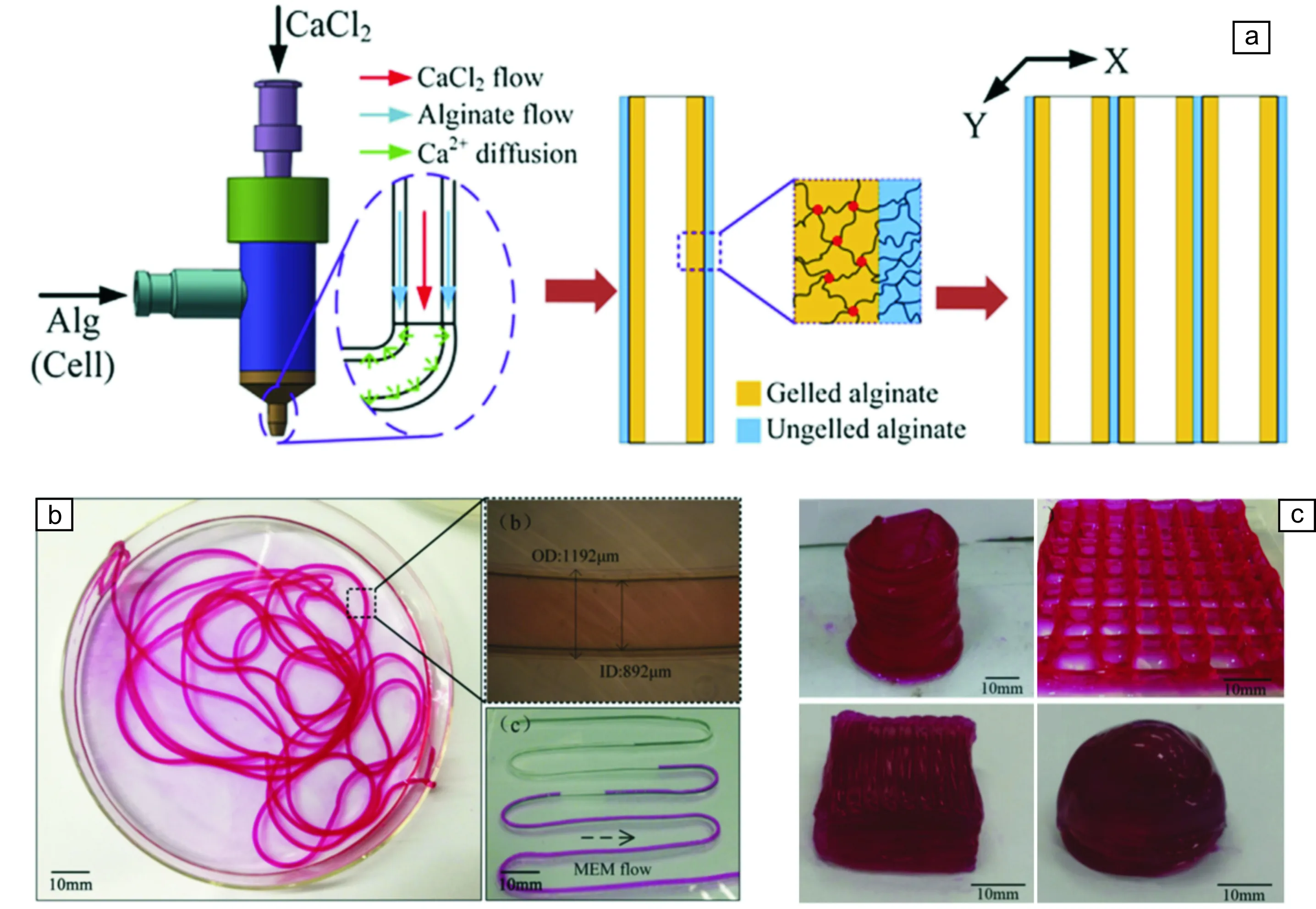
图6 海藻酸基空心管结构的3D打印制造:(a)多层海藻酸空心管结构的3D打印成型过程示意图;(b)制备的单根海藻酸空心管;(c)打印成型具有空心结构的海藻酸圆柱体、网格、长方体及半球体[102]Fig.6 Fabrication process of a 3D alginate structure with built-in microchannels: (a) Scheme of the fabrication process; (b) Printed alginate hollow filaments; (c) Printed 3D alginate hollow cylinder, grid, cuboid and hemispheroid[102]
同样,Gasperini等[104]通过使用电流体动力学沉积方法将载有细胞的海藻酸微粒打印到明胶-CaCl2涂层上。在该方法中,生物打印机喷嘴的尖端连接到具有高电压的电脉冲发生器,用于克服分配器的尖端处发生的表面张力相关问题。在另一项研究中,Williams等[105]利用藻酸盐,通过使用基于液滴的生物打印方法对脂肪组织中血管基质部分(SVF)的细胞聚集体进行打印。他们发现包封的细胞均匀地分散在海藻酸构建体中并保持良好的细胞活性。
由含海藻酸制成的生物墨水也可通过喷墨生物打印技术来制造复杂的结构[106]。总之,由于其具有快速物理凝胶化和广泛可调粘度的能力,海藻酸已成为广泛使用的生物打印天然聚合物。然而,海藻酸是相对生物惰性的材料,具有有限的细胞附着能力。为了解决生物打印应用的这个问题,Jia等[107]在氧化步骤后,它们将RGD肽缀合到海藻酸上使其具有生物活性和细胞结合位点。
3.2.4 透明质酸
透明质酸(hyaluronic acid,HA)是天然ECM中的一种非硫酸化糖胺聚糖,以其独特的分子结构和理化性质在机体内显示出多种重要的生理功能,如润滑关节,调节血管壁的通透性,调节蛋白质、水电解质扩散及运转,促进创伤愈合等。尤为重要的是,HA具有特殊的保水作用,是目前发现的自然界中保湿性最好的物质,被称为理想的天然保湿因子。溶于水后,HA溶液具有粘性,且其粘度会随浓度和相对分子量增加而增加。同时,研究表明当剪切速率增加时,HA分子需要更长的弛豫时间才能重新定向,表现出粘度降低效应,从而使其非常适合用作需要高粘度和良好流变性的生物3D打印材料。
Park等[86]在一项研究中为构建骨软骨界面,用PCL作为支撑物打印出两个矩形部分:一部分是由海藻酸-HA混合水凝胶装载软骨细胞/成骨细胞打印而成,而另一部分则是由I型胶原负载软骨细胞/成骨细胞打印而成。研究结果表明,I型胶原水凝胶中的成骨细胞具有超过90%的活性,并且比海藻酸-HA水凝胶中的成骨细胞显示出更高的成骨标记物(RUNX2和ALP)表达;而在海藻酸-HA水凝胶内培养的软骨细胞则比I型胶原水凝胶中的细胞显示出更高的软骨细胞标记物(II型胶原和聚集蛋白聚糖)表达水平。这意味着不同的细胞需要不同的打印基质材料才能更好地发挥其作用。
Law等[108]则制备出HA与甲基纤维素(MC)的复合水凝胶(HAMC),并用于生物3D打印。他们详细评估了8种浓度的HAMC的可打印性、溶胀性、流变特性、经时结构稳定性以及所装载间充质干细胞的活性。结果表明,HAMC混合溶液在4 ℃时表现为粘性,通常达到37 ℃时凝胶化,并且在较高温度下具有较快的胶凝化速度。混合水凝胶的储存、损失和压缩模量等可调控,且与HAMC浓度及37 ℃时的温育时间有关。膨胀性和稳定性受时间比受pH环境的影响更大。细胞实验表明,3D打印结构中间充质干细胞活性高于75%,在打印后存活时间至少一周,且较高浓度的HAMC更加适合细胞的3D打印。
与明胶类似,光反应性HA,如甲基丙烯酸化HA(MeHA)也被开发出来并用于生物3D打印。Duan等[109]人基于MeHA和GelMA开发出了物理性质可调节的混合水凝胶,并用于生物打印载有人主动脉瓣膜间质细胞的心脏瓣膜导管(HAVIC)。该混合水凝胶可以很好地支持HAVIC生长并可以通过改变混合水凝胶成分来调节细胞应答。增加GelMA浓度会导致水凝胶硬度降低、粘度增大和细胞粘附密度增加,从而促进HAVIC扩散和更好地维持HAVIC的成纤维细胞表型。打印精确度则取决于GelMA和MeHA的相对浓度,经水凝胶组分优化后则可打印出具有高细胞活性、良好准确性和重塑潜力的活体三叶草心脏瓣膜导管。
在另外一篇报道中,研究者[110]将MSCs装载到MeHA水凝胶中,培养21 d后细胞存活率保持在64.4%。在没有额外成骨刺激的情况下,MSCs的成骨分化在高浓度MeHA水凝胶中自发发生。向培养基中添加骨形态发生蛋白(BMP-2),进一步增加了成骨分化效率。同时,流变学和动态力学分析表明,UV照射使得MeHA水凝胶的存储模量和弹性模量增加,即水凝胶强度增加,使其非常适用于生物3D打印。
3.2.5 其它天然高分子材料
葡聚糖(dextran)是指以葡萄糖为单糖组成的同型天然多糖,单元之间以糖苷键连接,又称右旋糖酐。因其无毒性和亲水性而广泛用于组织工程。 Pescosolido等[111]利用HA和羟乙基甲基丙烯酸化葡聚糖(dex-HEMA)制备出具有多糖半互穿网络的聚合物水凝胶。经光反应交联后,该凝胶具有良好的粘弹性和假塑性,且其机械性能与天然组织的机械强度具有很好的匹配性。同时,研究者利用该水凝胶体系装载马软骨细胞进行3D打印,成型后的软骨细胞具有优异的生物学活性。在另一项研究中,Du等[112]基于热敏明胶和氧化葡聚糖之间的相分离机制研发出可在生理pH范围内调控其凝胶时间的水凝胶。两相体系的交联动力学可以在pH 6.0~8.0的生理环境范围在1 h内有效地调节。结合热敏明胶的可挤出性,随后的席夫碱反应可使水凝胶非常容易地自发交联成型。因而,该水凝胶的易处理性、热敏物理凝胶特性和延迟的化学交联增强作用,使其成为很好的生物3D打印材料。
琼脂糖(agarose)是一种线性结构的多糖,基本结构是1,3连结的β-D-半乳糖和1,4连结的3,6-内醚-L-半乳糖交替连接起来的长链。琼脂糖在水中一般加热到90 ℃以上溶解,温度下降到35~40 ℃时形成良好的半固体状的凝胶,这是它能够用于生物3D打印的主要特征基础。Kreimendahl 等[113]将琼脂糖分别与I型胶原和纤维蛋白混合,制备出用于生物3D打印复合水凝胶并考察了其诱导血管形成的能力。研究发现,胶原和纤维蛋白的加入对最终打印分辨率没有显著性影响,而琼脂糖-胶原混合水凝胶的储存模量与相应的单一组分相比显著提高。通过装载人脐静脉内皮细胞和人皮肤成纤维细胞,打印成型并孵育14 d后,在琼脂糖-I型胶原复合水凝胶中观察到明显的毛细血管网形成。Fan等[114]则基于基质胶(Matrigel)-琼脂糖研发出具有生物打印所需流变特性的复合水凝胶体系,用于生物3D打印人肠上皮细胞(HCT116)。该混合水凝胶的弹性随胶凝时间延长而增加,但当Matrigel的体积分数增加时,凝胶弹性降低。经优化后具有50%(体积分数)Matrigel和3%(质量分数)琼脂糖的混合水凝胶表现出最好的可打印性,且能够很好地支持细胞粘附和生长。此外,当在恒定温度(37 ℃)下进行打印时,细胞铺展和细胞活性都得到显著改善。在最近的一篇报道中,研究者[115]利用琼脂糖、锂皂石(Laponite)和原位聚合丙烯酰胺(PAM)制备出4D打印水凝胶(4D凝胶)。在该复合体系中Laponite赋予水凝胶剪切稀化特性及打印后形状稳定性,而高度交联的琼脂糖网络则渗透到轻度交联的PAM网络中,赋予4D凝胶高强度和韧性。同时,琼脂糖的溶胶-凝胶热可逆性则赋予水凝胶的第四维变化的能力。研究结果表明,该4D凝胶的机械性能出乎意料地高于琼脂糖和聚丙烯酰胺水凝胶的机械性能,且显示出可进一步转变其形状的能力。研究者通过喷墨打印技术成功构建出能够张嘴和翘尾的水凝胶鲸鱼和挥动触角的水凝胶章鱼。这项工作对于构建更为复杂的结构提供了新途径,在开发智能支架、传感器、软体机器人等研究中具有重要借鉴意义。
壳聚糖(chitosan)又称脱乙酰甲壳素,是由自然界广泛存在的几丁质(chitin)经过脱乙酰作用而得到。自1859年,法国人Rouget首先得到壳聚糖后,这种天然高分子的生物功能性和相容性、血液相容性、安全性、微生物降解性等优良性能被各行各业广泛关注。Wu等[116]报告了一种直接在室温条件下用壳聚糖打印构建复杂三维结构(如星形薄片、叶子和蜘蛛状等,如图7)的方法,并详细考察了影响打印过程的各因素,包括墨水特性(即流变性质和溶剂蒸发)、打印工艺参数(即喷嘴直径、施加的压力和推进速度)等。结果表明,在酸性条件下制备的壳聚糖墨水在打印成型后会有残留的酸,这将有助于减少由收缩引起的形状变形。中和处理后,打印的三维结构仍然能保持其形状。在另外一项研究中,研究者报道了一种可自动化、高效、低成本3D打印制备具有可控孔隙率的壳聚糖支架的方法[117]。该方法依赖于专门的3D打印系统,可以实现很好地重建宏观和微观级别的复杂结构,同时提升对支架几何形状的有效控制。研究者制备出的壳聚糖支架具有400 μm开放网状几何形状,为人成纤维细胞粘附和增殖提供了条件。
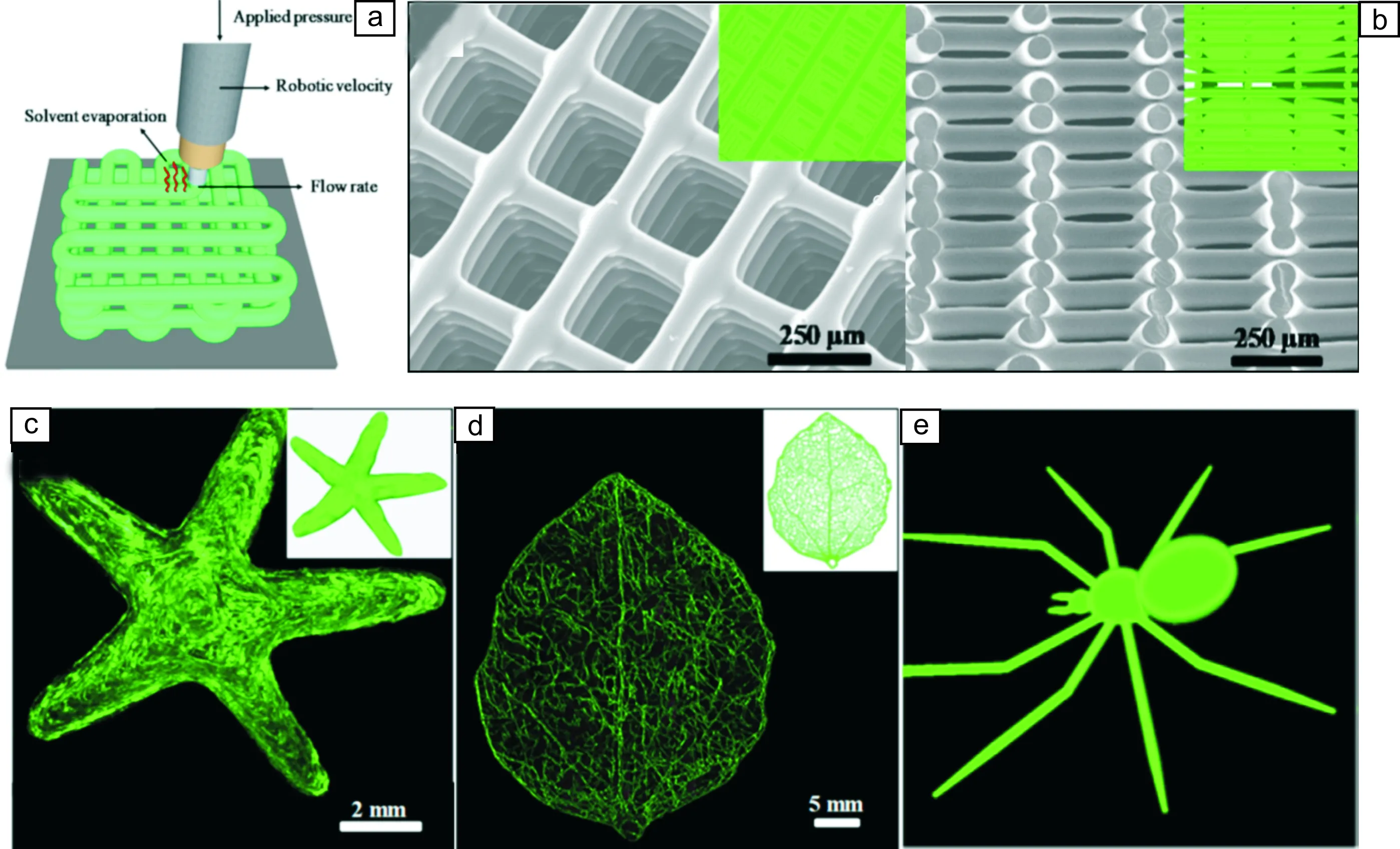
图7 基于壳聚糖的复杂三维结构打印构建:(a)3D打印成型过程示意图;(b)打印成型的壳聚糖支架的俯视及侧视SEM照片;(c~e)打印成型的壳聚糖星形薄片、叶子和蜘蛛状结构的荧光照片[116]Fig.7 3D printing of complicated microstructures using chitosan: (a) Schematic of the 3D printing process; (b) SEM image of a 3D chitosan scaffold with square pore size with top and side views; (c~e) Fluorescent microscopy images of 3D printed starfish, leaf and spider structure[116]
纤维蛋白原(fibrinogen)是一种由肝脏合成的可溶性糖蛋白,在Ca2+存在下通过凝血酶的分子间相互作用转化为不溶性纤维蛋白分子,参与血液凝块形成。纤维蛋白原具有很好的生物相容性、可生物降解性和非免疫原性,可诱导细胞附着、增殖和形成ECM[118-120]。Nakamura等[38]使用纤维蛋白和海藻酸盐制作生物墨水并用于细胞3D打印。在该生物墨水体系中,纤维蛋白具有很好的细胞相容性,而海藻酸盐则是用作打印成型材料很好的选项。Xu等[121]利用纤维蛋白-胶原蛋白,并将喷墨印刷与静电纺丝结合起来,以改善用于软骨组织工程的最终构建体的性能。在该研究中,PCL静电纺丝与负载软骨细胞的纤维蛋白-胶原水凝胶3D打印交替进行,制造出厚约1 mm的五层组织构件。结果表明,与单独打印的海藻酸或纤维蛋白-胶原凝胶相比,该构建体表现出增强的机械性能。同时,软骨细胞在该构建体成型一周后的存活率仍超过80%,并能够很好地维持其增殖及其它生物学特性。
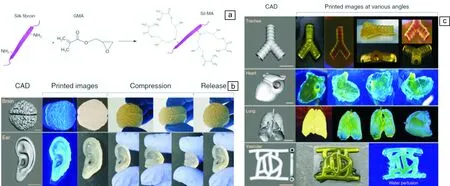
图8 蚕丝蛋白用于生物3D打印:(a)蚕丝蛋白的甲基丙烯酸化处理(Sil-MA)示意图;(b,c) 利用Sil-MA打印成型的脑、耳、气管、心脏、肺和血管结构[122]Fig.8 3D printing using silk fibroin: (a) Modification of silk fibroin molecule with GMA; CAD and images of printed brain and ear (b), and trachea, heart, lung and vessel at different conditions (c) [122]
3.3 脱细胞细胞外基质材料
ECM是由细胞合成并分泌到胞外、分布在细胞表面以及细胞之间,主要是由一些蛋白、多糖和蛋白聚糖组成[40, 125-127]。在生物体内,这些分子自发形成复杂的网架结构,起到支持并连接组织结构、调节细胞行为和组织发生的重要作用。脱细胞细胞外基质(decellularized ECM, dECM)材料是指通过使用化学试剂或采用物理、机械作用处理等方法,除去组织或器官的细胞成分,仅保留细胞外基质成分的一类材料[39, 41, 128, 129]。理想的dECM材料应完全去除组织内所有细胞、病毒等成分,而最大限度地保留天然细胞外基质的成分和三维结构。
在生物3D打印研究中,为了更好地模拟体内真实微环境,dECM也被用于组织特异性新型生物墨水的开发。Pati等[35]开发了基于dECM的生物墨水,以达到体外重构细胞天然微环境、维持细胞固有形态和功能的目的。在该研究中,研究者通过物理、化学和酶处理联用的方法成功地获得了脱细胞心脏(猪源,hdECM)、软骨(猪源,cdECM)和脂肪(人源,adECM)细胞外基质。得到的dECM细胞去除率达98%以上,而每mg hdECM、cdECM和adECM内DNA残余量仅分别为11±1、6.7±1.2和 39±15 ng。随后,制备的dECM被用作生物3D打印墨水,其打印过程如图9所示。预凝胶化的hdECM被直接用于打印构建心脏组织结构。软骨和脂肪组织结构,则是利用多喷头打印技术同时挤出dECM和PCL而制得。其中,PCL作为骨架起到支撑作用。进一步体外实验表明,dECM用于细胞打印能够有效维持高细胞存活率、支持细胞特异性基因表达和ECM形成,为解剖学相关(厘米级)尺寸组织的体外构建提供可能性。
Skardal等[130]利用Triton X-100处理获得了骨骼肌、肝脏和心脏组织dECM。然后将dECM与基于透明质酸/明胶的水凝胶溶液混合并用于生物3D打印。该水凝胶打印墨水,可通过4臂和8臂PEG二丙烯酸酯(PEG-DA)提供的丙烯酸酯基与硫醇化透明质酸或硫醇化明胶提供的硫醇基团反应,实现第一次交联反应。在第一交联步骤之后,利用UV光照射进行二次交联以形成稳定的水凝胶结构。同时,为了验证生物打印肝脏结构的功能性,研究者在水凝胶预聚物溶液中加入原代人肝细胞聚集体。

图9 利用脱细胞心脏(猪源,hdECM)、软骨(猪源,cdECM)和脂肪(人源,adECM)细胞外基质3D打印组织结构的流程示意图[35]Fig.9 Schematic elucidating the tissue printing process using decellularized heart (hdECM), cartilage (cdECM) and adipose (adECM) extracellular matrix[35]
结果表明,打印成型的肝组织结构具有较高的细胞活性,且细胞可以产生达到可检测水平的白蛋白和尿素。
在最近的一篇报道中,Athirasala等[131]通过将海藻酸盐(3%)水凝胶与牙本质基质的可溶性和不溶性成分混合,开发出了一种新型可打印生物墨水材料。研究者发现,含有较高浓度的海藻酸盐可提高所制备生物墨水的打印成型性,而含较高比例牙本质不溶性基质成分的生物墨水则可显著提高细胞活力。其中,海藻酸盐和牙本质的比例为1∶1时,最适合用作生物3D打印墨水。此外,在浓度为100 μg/mL时,这些可溶性牙本质基质成分可显著增强所包裹干细胞的牙源性分化。
基质胶(matrigel)作为一种商品化的ECM提取混合物,从小鼠肉瘤ECM中提取获得,其组分包括一些必需的生物活性分子,如层粘连蛋白、胶原蛋白和生长因子。它可作为天然仿生ECM,可在较高温度下进行热交联,目前已被广泛用于细胞和组织培养。Poldervaart等[37]利用Matrigel与海藻酸混合制备生物3D打印墨水,以用于血管化研究。与其他研究结果类似,添加海藻酸可以改善基质胶的可打印性。他们还将血管内皮生长因子(VEGF)直接或以微球包裹的方式放入,从而实现其控制释放。同时,他们使用带有气动驱动系统的生物3D打印机对负载人类内皮祖细胞(human endothelial progenitor cells, EPC)的生物墨水进行打印。结果表明,海藻酸的添加可改善生物墨水的可打印成型性,但同时生物墨水的降解速率增加,管状结构的形成速率降低。这意味着材料类型及其比例是开发最佳生物打印材料的关键参数。 Matrigel还可作为微流体系统的一部分用于生物打印药物平台构建,以及作为生物纸用于材料表面涂覆以起到支持所打印的细胞存活及功能维持的目的[23, 132]。然而,对于Matrigel,其最主要的问题是它源自鼠肉瘤ECM,这也极大地限制了其临床适用性[133]。
4 结 语
生物3D打印作为3D打印技术最前沿的研究领域之一,是生命科学、材料科学、制造科学交叉融合的新兴领域。通过将生物材料、活细胞和活性因子等一体化成型而制备具有精确的解剖结构与特定的生物学功能的组织/器官,有望为组织/器官再生、临床修复治疗、器官移植、药物研发等医学应用带来全新的理论和方法突破。目前,利用生物3D打印技术人们已成功构建出几种接近临床需求的功能性组织,但总体而言该领域仍处于早期阶段,仍然面临着许多挑战。就生物3D打印材料而言,随着研究的深入,支持高精度快速成型、具有特异性生物学功能且与打印机及打印软件具有更好的兼容性的新型材料应当不断地被开发出来。
人体组织器官无论是从结构上还是从功能上来讲,都是极其复杂的。材料在体外打印构建组织器官时,需起到保护支撑、维持活性、诱导分化、引导新生以及促使功能成熟等多重功能。因此,任何单一组分的材料都不可能兼具重构组织功能所需的所有特性。因此,开发复合3D打印材料成为一个必然的趋势。例如,Kang等[34]开发出一种集成式组织器官打印机(integrated tissue-organ printer, ITOP),并以明胶、纤维蛋白原、透明质酸和甘油为材料基础,通过调控不同组分的比例,制备出分别用于骨、软骨、骨骼肌打印的生物墨水(图10a和10b)。同时,以Pluronic F-127为外层牺牲,以PCL为力学增强材料,成功构建出下颌骨、软骨(耳)和骨骼肌(图10c~10e)。Zhang与Khademhosseini等[134]率先报道了多细胞/材料体系的仿生打印技术,在体外构建了与人体器官类似的人工组织器官(图11)。利用高度自动化控制的多材料打印机,实现了对7种“生物墨水”的快速打印,分别构建了类器官结构如脑、肺、心脏、肾、胰腺、胃、小肠、大肠、膀胱、前列腺等器官。例如,以GelMA和海藻酸盐水凝胶为基质,包覆多种细胞,在保障细胞存活率的前提下,成功地打印了类心脏结构,细胞初始存活率达到90%以上,培养7 d后显示出显著的分化特性,预示其在组织再生方面具有很大的潜力。
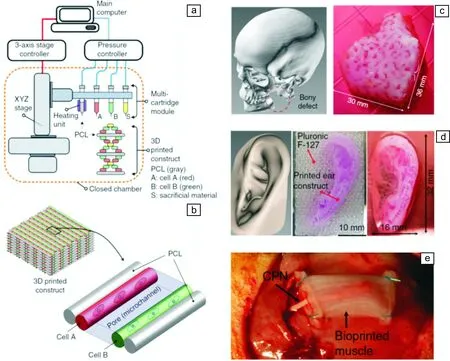
图10 生物3D打印构建大尺度类人体器官:(a)研究者开发的名为“integrated tissue-organ printer (ITOP)”的打印机的示意图;(b)打印物结构示意图;(c~e)生物3D打印成型的下颌骨、软骨(耳)和骨骼肌[34]Fig.10 Fabrication of stable, human-scale tissue constructs of any shape: Illustration of the integrated tissue-organ printer (ITOP) (a) and the basic patterning of 3D architecture including multiple cell-laden hydrogels and supporting PCL polymer (b); Reconstruction of mandible bone (c), ear cartilage (d) and skeletal muscle (e)[34]
为更好地维持打印细胞的活性,实现组织器官功能的体外重建,仿生学的重要意义被逐渐彰显出来。未来一个重要的发展方向就是对天然ECM的认识不断深入,通过模拟ECM的复杂组分及梯度分布,开发具有特异性功能的活性材料(如活性因子或dECM修饰后的高分子材料);同时利用3D打印技术精准调控功能性材料的呈现,实现特异性ECM的体外复制,构建出仿ECM的微环境,为细胞的生存、增殖、分化及功能维持创造有利条件。基于仿生学的另外一个重要研究方向则是开发功能适应性材料,即材料可以自发地根据外部刺激按需重新编程其形状、属性或功能。比如,在打印初期材料除了能够起到保护支撑的作用,还应能促使细胞产生并沉积ECM,自发构建出适合细胞自身生长的微环境;随着细胞的不断增殖,材料应产生相应的降解,为细胞的生长让出空间,且其降解产物应无毒副作用。
生物3D打印领域同样也面临着组织工程和再生医学领域所共同面临的其他挑战。比如,3D打印构建组织器官的内部血管化问题。一些研究报道已经证明了构建生物打印器官内分支血管网的可行性(图12)[34, 79, 135, 136]。目前,3D打印构建血管网络的一个挑战是该方法处理过程与材料、细胞以及印刷系统中其他组件的兼容性。另外,在整个组织构建体中血管网络产生并成熟所需的时间可能长于细胞的存活时间。生物反应器可以帮助维持组织构建体的活性,并为后处理中组织融合、重塑和成熟争取所需时间。另外,人体内血管网络是一个从粗到细逐渐变化的非匀质网络结构。未来的一个可能的解决策略是,在3D打印成型的过程中,利用自牺牲材料来构建大的联通血管网络;植入后,通过植入物周围血管网络的自发长入,来构建中或毛细血管网路;通过诱导植入物内干细胞的定向分化,在植入物内部产生毛细血管网。
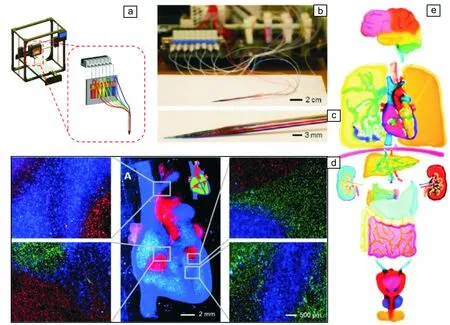
图11 多材料生物墨水快速打印类人体器官结构:(a)研究者所设计的七通道打印头示意图;(b,c)打印头通道及喷嘴处实物照片;(d)生物3D打印成型的多组分心形结构及其在不同材质交界处的荧光照片;(e)单独打印成型的类人体器官(包括脑、肺、心脏、肝脏、肾脏、胰腺、胃、小肠/大肠、膀胱和前列腺)构建体及其在人体相对位置处拼合照片[134]Fig.11 Rapid continuous multimaterial extrusion bioprinting: (a) Schematic of the developed printer with seven-channel printhead; (b,c) Photographs showing the setup of the Festo valves and printhead; (d) Fluorescence images of the printed multi-component heart-like structure and different junction regions; (e) Bioprinting of human organ-like constructs, including brain, lung, heart, liver, kidneys, pancreas, stomach, small/large intestines, bladder and prostate, the organ-like constructs were individually printed, photographed and stitched together in the same image at relative locations as those in the human body[134]
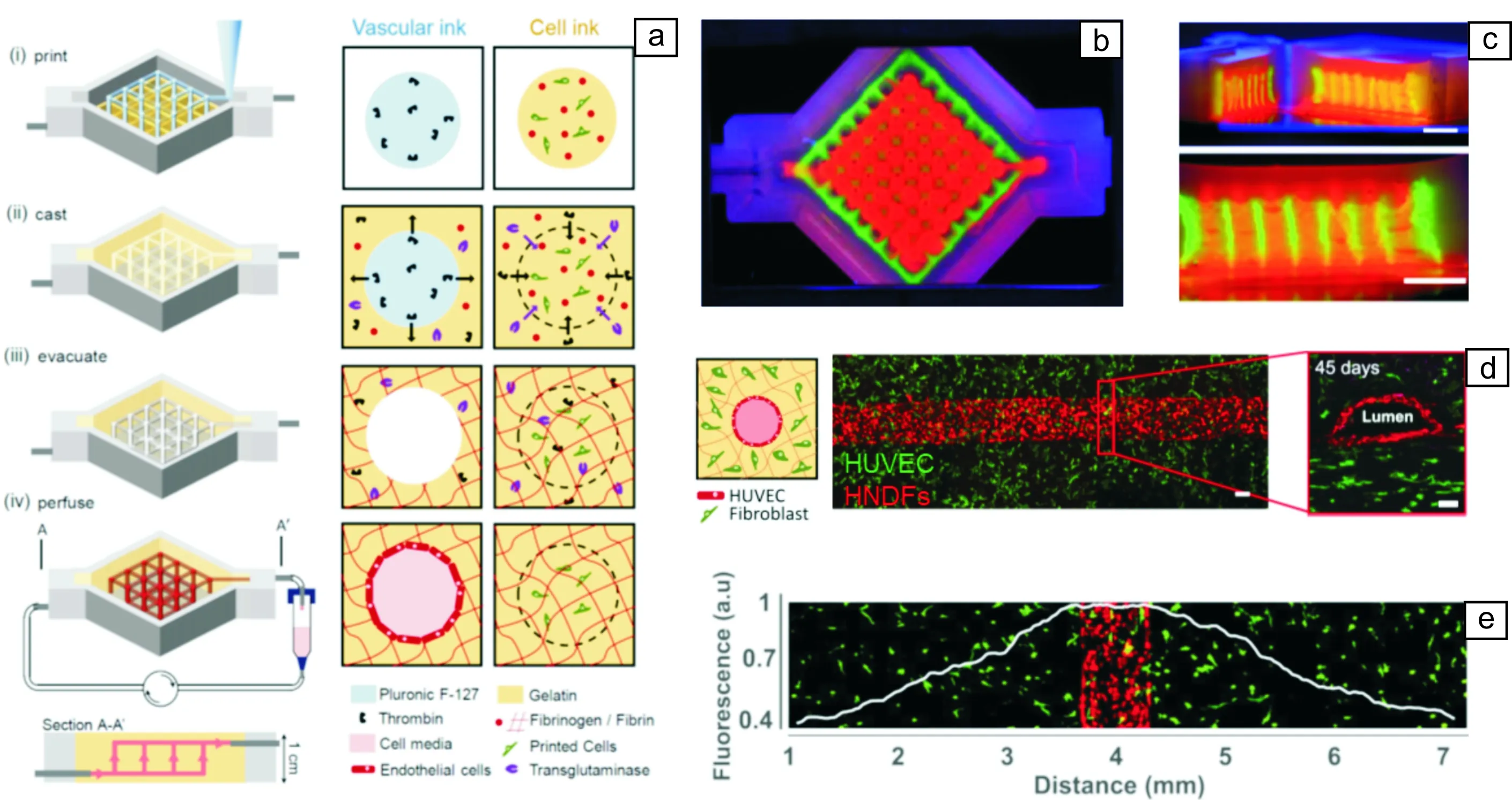
图12 含血管网络组织器官的3D打印构建:(a)含血管结构构建过程示意图;(b,c)含血管结构的3D打印构建体的横面及纵切面荧光照片;(d)在载成纤维细胞基质内由HUVECs细胞构建血管结构的示意图及荧光照片;(e)绿色荧光蛋白标记的人新生真皮成纤维细胞HNDFs(GFP-HNDFs)细胞在血管周边的分布(荧光强度)[136]Fig.12 Three-dimensional vascularized tissue fabrication: (a) Schematic illustration of the tissue manufacturing process; (b, c) Photograph of printed tissue construct housed within a perfusion chamber and the corresponding cross-sections; (d) Long-term perfusion of HUVEC-lined (red) vascular network supporting HNDF-laden (green) matrix shown by top-down (left) and cross-sectional confocal microscopy (right); (e) GFP-HNDF distribution within the 3D matrix shown by fluorescent intensity as a function of distance from vasculature[136]
因此,研发新型生物3D打印高分子材料并赋予其更加丰富的成型方式,优化材料的力学性能,使其具有更好的打印性;通过仿生、负载生物活性因子等方法改善高分子材料的生物学特性;结合其它材料,开发异质、梯度化复合材料;设计调控材料的降解性能及促血管化能力,提高打印细胞及组织器官的存活及功能维持;建立生物3D打印材料标准及生产工艺规范等,将是未来的重要研究方向。我们相信随着打印材料种类的拓宽和性能的完善,生物3D打印终将为健康医疗应用方面带来变革性的改变。
