ROS/PARP-1/AIF信号通路在糖皮质激素诱导的MC3T3-E1细胞凋亡过程中的作用研究
2019-01-11张雷邢赛彭昊方洪松黄冠予梁世博
张雷 邢赛 彭昊*方洪松 黄冠予 梁世博
激素性股骨头缺血性坏死(steroidinduced avascular necrosis of the femoral head,SANFH)是非创伤性股骨头坏死的最常见病因,其主要原因为长期或短时间大剂量应用糖皮质激素,导致股骨头内循环障碍,引起股骨头塌陷、髋关节疼痛和功能障碍。国内外对其发病机制进行了广泛的研究,成骨细胞凋亡机制逐渐成为研究的热点。SANFH中的细胞凋亡通路是一个多因素、多水平的复杂的调控过程,目前国内外的主要研究成果包括:Wnt/-catenin、STAT1-caspase3、Akt/Bad/Bcl-2、RANK/RANKL/OPG和 HIF-1等一些经典的凋亡通路[1-5]。本文用地塞米松诱导MC3T3-E1细胞建立激素性股骨头坏死的成骨细胞模型,介绍氧化应激介导线粒体凋亡途径,把ROS与非依赖caspase家族信号分子凋亡诱导因子(AIF)相关联,并通过抗氧化剂抑制ROS产生,和钙蛋白酶抑制剂抑制钙蛋白酶活性,减少钙离子内流,最终减少AIF的释放,抑制MC3T3-E1细胞凋亡,现汇报如下。
1 材料与方法
1.1 材料
1.1.1 细胞系选择和实验材料
本文选用小鼠胚胎成骨细胞前体细胞(MC3T3-E1),购于武汉赛维尔生物科技有限公司细胞库。
地塞米松(D4902-25MG,Sigma,美国),凋亡诱导因子AIF(D3902 20 L,Rabbit mAb CST,美国),聚腺苷二磷酸核糖聚合酶-1抗体(SinoBiological,中国),细胞色素C抗体(碧云天,中国),N-乙酰-L-半胱氨酸(规格1 g,Sigma,美国),PD151746钙蛋白酶-1抑制剂(Selleck,美国), -Actin Antibody(谷歌,中国),PVDF膜(0.45 m300mm×4m,EA,德国),抗兔IgG二抗(CST,美国)。超净工作台(SW-CJ-1E,苏净,中国),二氧化碳培养箱(上海智诚分析仪器有限公司),电泳仪(北京市六一仪器厂),流式细胞仪(BD公司)、Odyssey(LI-COR公司,美国)。
1.1.2 糖皮激素诱导的成骨细胞凋亡模型的建立
选择复苏后第2代或第3代的小鼠成骨细胞系(MC3T3-E1),经胰酶消化离心重悬后,用细胞计数板计数需传代的细胞总数,根据查阅文献,需接种的细胞浓度为1×105个/mL,根据需要加入适量的细胞原液(本实验细胞原液浓度为1×106个/L,只需稀释10倍即可),细胞过夜等待细胞贴壁充分(一般需2~4 h),加入地塞米松药物浓度为1×10-6mol/L,继续培养72 h,然后使用流式细胞仪,与正常组细胞对比,检测细胞凋亡率。
1.1.3 细胞分组
选择生长良好的小鼠胚胎成骨细胞前体细胞系(MC3T3-E1),以1×105个/mL接种于25 cm培养瓶或六孔板中。48h后贴壁生长良好,对细胞干预前PBS润洗细胞2次,然后随机将细胞分为4组:正常组(10%FBS),激素组(地塞米松浓度1×10-6mol/L),NAC组(NAC1mmol/L+地塞米松1×10-6mol/L)和钙蛋白酶抑制剂 PD151746(PD)组 (PD10 mol/L+地塞米松1×10-6mol/L),于72h收集细胞做各种后续指标的检测。
1.2 实验方法
1.2.1 CCK-8试剂盒检测细胞增殖
根据实验要求,设置未加药物的含有地塞米松的成骨细胞组(地塞米松对照组),未加药物及地塞米松的细胞对照组(细胞对照组),以及加入药物浓度梯度的药物试验组。地塞米松浓度为1×10-6mol/L,NAC的浓度梯度设为(0.2、0.5、1、1.5、2 mmol/L),PD151746的浓度梯度设为(2、5、10、15、20 mol/L),每组重复3次及以上。将96孔板继续放置于温箱中培养,72h后,待细胞密度达到100%时,用CCK-8检测细胞增殖能力,在450nm处测定吸光光度值。
1.2.2 流式细胞仪检测细胞凋亡率和ROS含量
收集细胞:细胞悬液转入离心管中,1500rpm离心5min收集细胞,弃上清液。PBS洗涤细胞:加入3 mL 4℃预冷的PBS完全重悬细胞,1 500 rpm离心5 min,弃上清液。沉淀震荡混匀。细胞计数:移取10 L在血细胞计数仪上进行细胞计数,调整细胞为1×106~2×108/mL。细胞标记:凋亡使用AnnexinV-FITC和PI溶液,ROS使用DCFH-DA探针。孵育探针:37℃温箱内孵育20 min,3~5 min充分混匀1次,使DCFH-DA和细胞充分反应。然后无FBS润洗细胞,洗掉残留细胞外的探针,以免影响实验检测结果。上机检测:流式细胞仪使用激发波长488nm,发射波长(525±20)nm进行检测,并分析细胞凋亡率和ROS含量。
1.2.3 激光扫描共聚焦显微镜检测ROS含量和钙离子含量
去除细胞培养液,PBS洗涤细胞,ROS加入用无血清培养基稀释DHE试剂和钙离子加入Fluo-4/AM荧光探针。37℃培养箱内孵育,无FBS的H-DMEM培养基润洗细胞,洗掉残留细胞外的探针,以免影响实验检测结果,放置于暗室等待检测。按照扫描的激光共聚焦显微镜设置数据为:激发波长488 nm,发射波长515 nm。然后采用Image J软件得出荧光强度的数值,其荧光强度即可反映细胞内ROS含量和钙离子含量。
1.2.4 Western blot检测蛋白的水平
用超纯水(去离子水)清洗玻璃板,检查是否漏水,如漏水则调整玻璃板至完全密封。根据目的蛋白的分子量选择10%分离胶和5%浓缩胶。加入足量的电泳液后,拔出梳子,确定蛋白总量一致,每孔加样10 L,在样品两侧各加marker 3L。将电泳电压调整为120 V,时间90 min,当溴酚蓝刚到达胶的底端处附近即可停止电泳。选择切胶的范围,220mA恒流转膜90min。封闭后,孵一抗,孵二抗,Odyssey仪器扫膜。
1.3 统计学方法
数据采用 SPSS 17.0统计软件分析,ROS、Ca2+和蛋白灰度值计算采用ImageJ软件,分析和计算平均荧光密度值,蛋白条带灰度值。计量资料采用方差分析,以均数±标准差表示,两独立样本采用t检验,P<0.05则认为差异有统计学意义,P<0.001则认为有显著性意义。作图工具选用GraphPad Prism 5和 Adobe Photoshop CS 5。
2 结果
2.1 CCK-8检测成骨细胞MC3T3-E1细胞增殖
根据测得的 CCK-8的OD值,计算出激素对照组和正常对照组的平均OD值,将测得的加入NAC和PD151746各浓度梯度的OD值代入细胞存活率公式[6]:细胞存活率=(药物试验组OD值-激素对照组平均OD值)/(正常对照组平均OD值-激素对照组平均OD值)。将细胞存活率值分别输入 GraphPad Prism 5软件,得出细胞存活率线性坐标曲线图(见图1)和半最大效应浓度(EC50):NAC为1.010mmol/L,PD151746为8.085 mol/L。因此,本研究分别取NAC的实验浓度为1mmol/L,PD151746的实验浓度为10 mol/L。
2.2 流式细胞仪检测MC3T3-E1成骨细胞凋亡率
如图2所示,通过Annexin V-FITC和PI双染标记法进行流式细胞仪检测,结果显示,4组凋亡率分别为:正常组(3.24±0.14)%、激素组(11.69±1.42)%、NAC 组(4.52±0.23)%和 PD151746组(4.81±0.11)%,激素组、NAC组和PD组与正常组比较差异具有统计学意义(P值分别为0.001,0.001和0.000),激素组与NAC组、PD组比较差异具有统计学意义(P值分别为0.001和0.01)。
2.3 流式细胞仪检测各组成骨细胞ROS的平均荧光强度
如图3所示,ROS的荧光强度,结果显示4组的荧光强度分别为:正常组(123 547.70±845.92),激素组(161 033.70±1 781.71),NAC 组(131 158.70±1 969.73)和PD组(133 387.70±1 512.25)。激素组、NAC组和PD组与正常组比较差异具有统计学意义(P值分别为0.001、0.004和0.001),激素组与NAC组、PD组比较差异具有统计学意义(P值分别为0.002和0.02)。

图1 NAC和PD151746对地塞米松诱导的成骨细胞凋亡模型增殖能力的影响
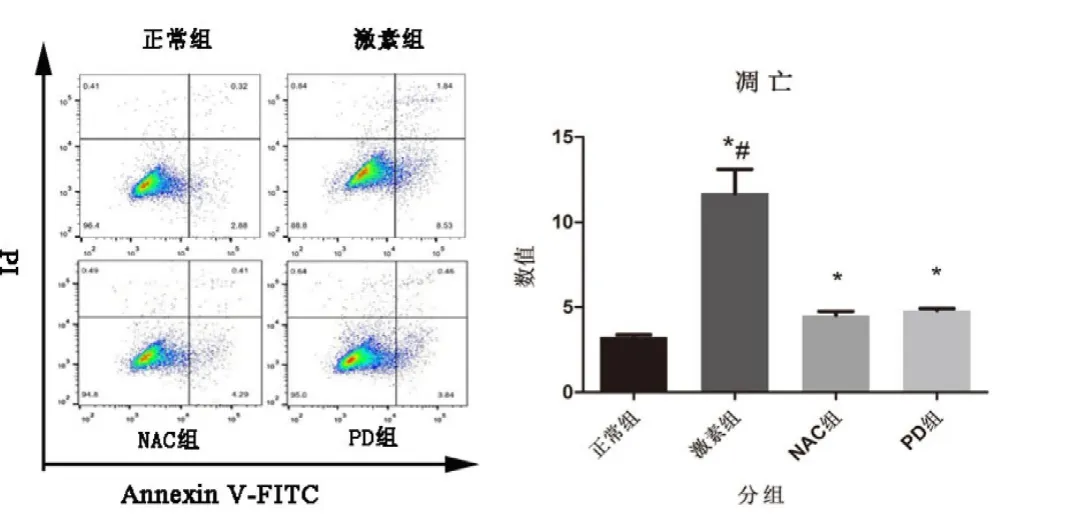
图2 流式细胞术检测不同药物处理对MC3TC-E1成骨细胞凋亡率的影响
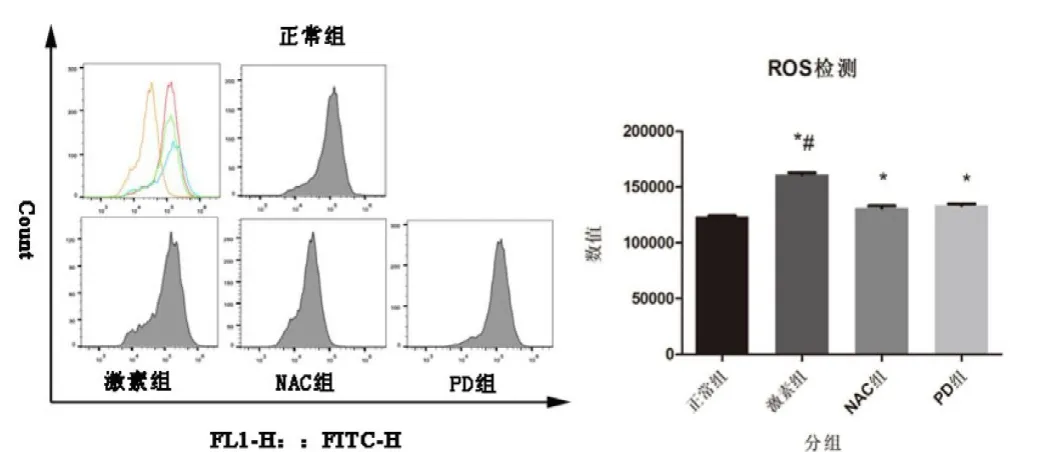
图3 流式细胞仪检测不同药物处理对 MC3TC-E1成骨细胞产生ROS含量的影响
2.4 激光扫描共聚焦显微镜检测各组Ca2+含量
如图4所示(彩图见插页),采用 Image J图像处理软件,计算每组平均荧光密度值,结果显示四组钙荧光密度值为:正常组(0.0208±0.0003),激素组(0.0334±0.0029),NAC组(0.0249±0.0041)和PD组(0.0258±0.0023)。激素组、NAC组和PD组与正常组比较差异具有统计学意义(P值分别为0.002、0.026和0.021),激素组与NAC组、PD组比较差异具有统计学意义(P值分别为0.044和0.001)。
2.5 激光扫描共聚焦显微镜检测各组ROS的荧光强度
如图5所示(彩图见插页),采用 Image J图像处理软件,计算每组平均荧光密度值,结果显示4组ROS荧光密度值为:正常组(0.0244±0.0012),激素组(0.0322±0.0016),NAC 组(0.0189±0.0012)和 PD 组(0.0278±0.0010)。激素组、NAC组和PD组与正常组比较差异具有统计学意义(值分别为0.003、0.005和0.023),激素组与NAC组、PD组比较差异具有统计学意义(P值分别为0.000和0.017)。
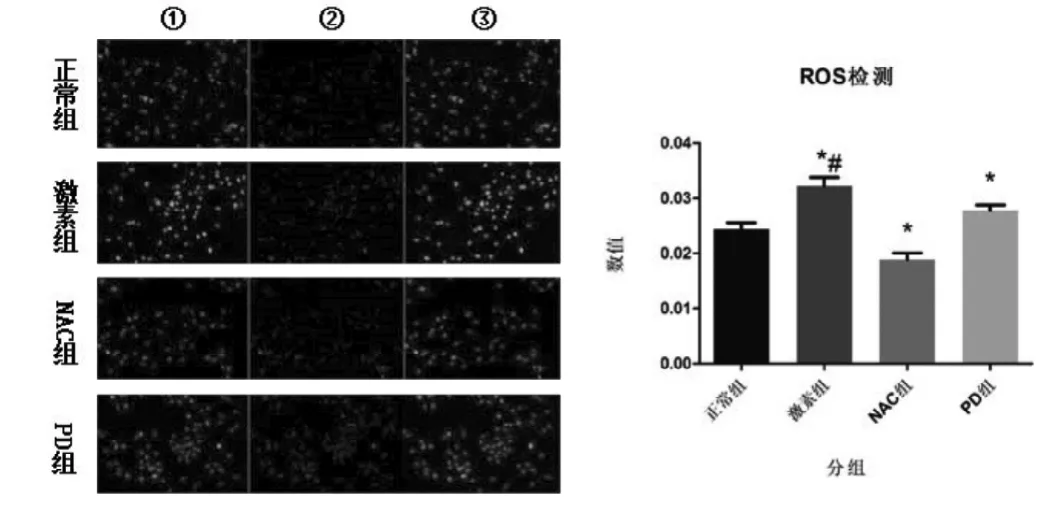
图5 激光扫描共聚焦显微镜检测不同药物处理对MC3TC-E1成骨细胞产生ROS荧光强度的影响
2.6 Western blot检测各组 MC3T3-E1成骨细胞表达 AIF、RARP-1和Cyt-c蛋白的水平
如图6所示,采用ImageJ图像处理软件,测量各蛋白条带的灰度值与 -actin灰度值的比值。结果显示,AIF蛋白:正常组(0.191±0.009),激素组(0.345±0.006),NAC组(0.249±0.006)和 PD 组(0.293±0.007);PARP-1蛋白:正常组(0.164±0.007),激素组(0.460±0.042),NAC 组(0.342±0.018)和 PD 组(0.380±0.023);Cyt-c蛋白:正常组(0.247±0.006),激素组(0.430±0.084),NAC 组(0.374±0.013)和 PD 组(0.366±0.011)。其他三组与正常组比较,差异具有统计学意义(P<0.05);激素组与NAC组、PD组比较,差异也具有统计学意义(P<0.05)。

图6 Western blot检测不同药物处理对MC3TC-E1成骨细胞蛋白表达水平的影响
3 讨论
激素性股骨头缺血性坏死是长期大量使用糖皮质激素类药物导致的并发症之一,好发于30~50岁的中青年人群,而且致残率高,往往非手术治疗效果欠佳,全髋关节置换术成为其最终且可行的唯一治疗方法。激素性股骨头坏死的保髋策略包括非手术治疗:改变生活方式,减轻体重,扶双拐行走减轻髋部负重;目前没有被广泛认可疗效客观的药物,主要包括一些缓解及减缓病程的药物,调节破骨细胞功能(如阿仑膦酸钠),调节脂质代谢(如阿托伐他汀)等。手术保髋较为经典的手术且成熟的髓芯减压术,以及衍生的髓芯减压植骨术,对早中期激素性股骨头坏死有较好的疗效,能延缓病情进展[7,8],其他还包括坦棒置入术、带血管蒂或肌蒂的骨瓣转移术、骨盆内移截骨术、骨髓间充质干细胞移植等[9-12],对早期激素性股骨头坏死,保髋手术能一定程度上缓解患者症状,延缓病情继续恶化,改善髋部功能[13]。
在糖皮质激素诱导的骨坏死中,氧化损伤出现的时间要早于骨坏死[14]。童培建等建立大鼠激素性股骨头坏死模型,并运用基因芯片的方法检测组织内表达的基因,发现坏死股骨头组织中表达较强的氧化应激基因,提示 COX6A2、COX412、SOD3和DUSP1基因是氧化应激在激素性股骨头坏死的发生、发展过程中起关键作用的基因[15,16]。N-乙酰-L-半胱氨酸(NAC)、依布硒等抗氧化剂能有效阻止激素诱导的成骨细胞凋亡,沉默p66shc也能达到类似效果[17]。3-吲哚甲醇可以通过抑制ROS的过量产生和增强Nrf 2通路的表达从而达到抑制糖皮质激素性骨细胞凋亡的效果[18]。细胞发生凋亡时,线粒体功能发生障碍,Bak/Bax介导的孔道呈过表达状态,使Cyt-c从线粒体释放到胞浆中,从而线粒体呼吸链失平衡,电子从呼吸链中逃逸并与O2作用产生超氧阴离子(O2-),产生氧化应激。
AIF作为第一个被鉴定出可以不依赖于胱天蛋白酶(caspase)信号通路而直接介导细胞发生凋亡的分子,当凋亡程序触发是AIF从线粒体释放易位到核,与染色体DNA结合,引起细胞染色体凝聚及DNA大片段碎裂(50 kb)的作用。在细胞凋亡过程中,AIF被钙蛋白酶及组织蛋白酶进一步水解,最终形成了57 kDa的可溶性且具有凋亡诱导活性的蛋白释放入细胞质中,发挥促凋亡作用[19,20]。有研究报道,AIF诱导的凋亡过程中,细胞内 Ca2+水平的增加(维持10 min左右)是AIF加工和释放的先决条件,而瞬时Ca2+水平的增加是不足以引发AIF蛋白水解的,Ca2+一方面刺激线粒体分泌ROS,另一方面激活钙蛋白酶,依次切割膜结合的AIF,并通过 Bax/Bak介导的孔道或 Ca2+依赖性线粒体通透性转换,从线粒体释放可溶性片段[21]。
然而激素性股骨头坏死的发病机制仍不清楚,本实验着手目前的研究热点话题:成骨细胞凋亡,通过探讨MC3T3-E1凋亡信号通路,阐述 ROS-AIF之间的关联。本实验中,建立激素性股骨头坏死的细胞模型,检测ROS及AIF水平均明显升高,再次验证地塞米松确实能引起氧化应激反应,并引起成骨细胞凋亡。N-乙酰-L-半胱氨酸(NAC)作为抗氧化剂属于ROS抑制剂,能抑制ROS的水平和细胞凋亡[22],NAC组检测ROS和AIF水平均明显降低,说明ROS和AIF之间存在一种关联。Ca2+作为刺激AIF释放的前提条件,在这条信号通路中起着重要作用,Ca2+通过激活钙蛋白酶、组织蛋白酶和AIF(67kDa)使其裂解为成熟的AIF(57 kDa)形式,并通过线粒体膜 Bax/Bak调节的孔道释放到细胞质中,与 DNA结合,发挥细胞凋亡的作用。PD151746作为选择性的钙蛋白酶-1的抑制剂,能有效抑制钙蛋白酶-1的活性,抑制PARP-1和AIF的释放,发挥抗凋亡的作用。激素组检测ROS水平无明显变化,AIF水平明显降低,成骨细胞凋亡率减少。激光共聚焦检测各组Ca2+水平,含量由高到低分别为激素组、PD组、NAC组和正常组,其他三组与正常组比较有统计学意义;PD组、NAC组与激素组比较也具有统计学意义,为Ca2+作为刺激AIF释放的前提条件提供了有力证明。NAC能抑制该通路的 ROS,PD151746能抑制钙蛋白酶活性,从而抑制本实验的重要因子Ca2+,进而抑制AIF的释放,NAC和PD151746都是通过该通路的因子来发挥作用的,从而推出该通路的作用(见图7)。

图7 本实验ROS/PARP-1/AIF信号通路流程图
本实验建立激素性股骨头坏死的细胞模型,检测各试验组的ROS含量、Ca2+含量、AIF、PARP-1和Cyt-c的表达水平及细胞凋亡率,验证了ROS-Ca2+-PARP-1-AIF的凋亡信号通路在激素性股骨头坏死发展中的作用,并通过抑制 ROS产生和钙蛋白酶的活性,能减少成骨细胞凋亡,保护成骨细胞的作用。总之,本实验为激素性股骨头坏死找到一条新的凋亡信号通路(ROS/PARP-1/AIF),希望能为临床治疗激素性股骨头坏死提供一条可靠的实验依据。
