RIP3在H1N1流感病毒感染中发挥促炎症病理作用
2019-01-07秦波音王超任晓楠谭丹陈丽香方钟李顺周晓辉
秦波音,王超,任晓楠,谭丹,陈丽香,方钟,李顺,周晓辉
(复旦大学附属公共卫生临床中心,上海 201508)
随着每年的流感流行,流感已成为人类面临的主要公共卫生问题之一。每年约15%的全球人口因流感病毒感染而导致严重的发病率和死亡率[1-2]。从1918年西班牙大流感(H1N1亚型)引起约5000万人的死亡,到1968年香港流感(H3N2型)造成约100万人的死亡,直至2009年首次出现在墨西哥(甲型H1N1型)后在多国迅速流行,造成约1万人死亡[3-4]。甲型流感病毒的感染已对人类健康产生极大的威胁并造成了巨大的经济损失。深入探究甲型流感病毒感染致病机制,对抗流感病毒疫苗和药物的研发具有重要意义。
甲型流感病毒的感染可引起严重的急性肺炎,这种原发性病毒性肺炎可能会导致急性呼吸窘迫综合征(ARDS),这是一种高死亡风险的呼吸综合征。许多宿主因素与流感感染引起的ARDS有关,其中“细胞因子风暴”是机体天然免疫反应失调而引起ARDS的一个关键因素[5-7]。近期的研究表明,细胞死亡特别是细胞坏死可导致肺支气管上皮的严重退化,虽然在一定程度上控制了病毒的复制,但如引发起过度炎症反应则是严重的病理病变和高死亡率发生的重要原因[8-10]。
细胞程序性坏死关键调控分子RIP3参与流感感染后的确切作用还有待探讨。本研究通过H1N1 PR8流感病毒分别感染RIP3-/-小鼠和C57BL/6小鼠,结果显示RIP3-/-组小鼠生存率显著提高,两组小鼠病毒学方面虽无明显差异,但RIP3-/-组小鼠的病理改变和炎症应答较对照组减轻。
1 材料与方法
1.1 材料
1.1.1 病毒
H1N1病毒株A/ Puerto Rico/8/34 (简称PR8),由中国科学院上海巴斯德研究所孟广勋教授惠赠。流感病毒通过鸡胚和MDCK细胞培养滴定后,-80℃放置备用,病毒感染实验均在上海市公共卫生临床中心内的动物生物安全二级实验室(ABSL-2)中开展。
1.1.2 实验动物及分组
SPF级6~7月龄C57BL/6小鼠和RIP3-/-(C57BL/6背景)小鼠共44只,雌雄各半。C57BL/6小鼠来源于上海市(复旦大学附属)公共卫生临床中心实验动物部【SCXK(沪)2015-0002】,RIP3-/-小鼠由北京生命科学研究所王晓东院士惠赠,两品系小鼠均饲养于上海市(复旦大学附属)公共卫生临床中心实验动物部SPF区域【SYXK(沪)2015-0008】中。病毒感染前一天将小鼠转移到ABSL-2。实验共分为4组:RIP3-/-小鼠解剖组(A组)12只、RIP3-/-小鼠生存曲线组(B组)10只、C57BL/6小鼠解剖组(C组)12只和C57BL/6小鼠生存曲线组(D组)10只。所有操作均符合实验动物伦理学要求(伦理审批号:IACUC2018-A044-02)。
1.1.3 实验试剂
DMEM培养液(Gibco,1868707),异氟烷(上海雅培制药有限公司,B506),多聚甲醛固定液(武汉谷歌生物科技有限公司,163307),Total RNA抽提试剂盒 (QIAGEN GmbH,52906),One-Step SYBR PrimeScriptPLUS RT-PCR kit (Perfect Real Time,RR096A),MS INFLAMMATION CBA KIT(BD,552364)。
1.1.4 实验仪器
CO2培养箱(3111,Thermo,美国),匀浆机分散机(607EUR,Biospec,美国),冷冻离心机(Micro 17R,Thermo,美国),精密高温干燥箱(DHG-9070C,上海之信仪器有限公司,中国),荧光定量PCR仪(ViiA7,ABI,美国),超微量分光光度计(K5600,北京凯奥科技发展有限公司,中国),流式细胞仪(LSR Fortessa,BD公司,美国)。
1.2 方法
1.2.1 感染方法和样本采集
将4组实验小鼠分别标记称重,小鼠经异氟烷麻醉后,用40 μL含5.25×103TCID50PR8的DMEM病毒液滴鼻感染,将流感病毒液通过小鼠的一个鼻孔缓慢滴入,至完全吸收,滴鼻动作过程需轻柔。感染完成后将小鼠放回独立送风隔离笼具(IVC)中正常饲养。感染后14 d内,每天观察小鼠状态并进行体重称量,记录小鼠生存情况(若体重下降大于等于25%则记为伦理死亡),在感染后第3、7天分别处死A组和C组小鼠各6只(3雄/3雌)。取整个肺组织称重并拍照,左叶肺4%多聚甲醛固定,剩下肺分装后速冻于液氮,转移保存于-80℃冰箱待用。小鼠体重变化计算:根据每日体重变化,计算体重变化率=(感染后当天体重-0 d体重)/0 d体重×100%,小鼠肺指数计算:根据处死小鼠的肺湿重和体重计算肺指数,肺指数=小鼠的肺重/小鼠的体重×100%[11]。
1.2.2 qRT-PCR 检测肺病毒载量
取右叶部分肺组织,以0.05 g肺组织/500 μL PBS 的比例匀浆。使用Total RNA抽提试剂盒抽提肺组织中的总RNA,抽提产物用超微量分光光度计测定核酸浓度和吸光度值(A260/280为1.90~2.25)。将抽提好的RNA用One-Step SYBR RT-PCR kit进行肺病毒载量检测。采用实验室建立的检测方案[11],扩增体系为25 μL: TaqMan PCR基础液12.5 μL,引物10 μmol/ L,RNA模板2.5 μL。按照以上体系加样后,通过荧光定量PCR仪进行扩增。扩增程序为:42℃ 10 min;95℃ 1 min;95℃ 15 s,60℃ 45 s,45个循环。管家基因3-磷酸甘油醛脱氢酶(GAPDH)的上游引物:(5′-AGGTCGGTGAACGGATTTG-3′);下游引物: (5′-TGTAGACCATGTAGTTGAGGTCA-3′)。流感病毒的上游引物: (5′-AAGACCAATCCTGTCACCTCTGA-3′); 下游引物: (5′-CAAAGCGTCTACGCTGC AGTCC-3′)。根据2-ΔΔCt的方法计算组织总RNA中的相对病毒载量。
1.2.3 CBA检测细胞因子
相关炎性细胞因子的检测均严格参照流式微珠阵列术(BD CBA Mouse Inflammation Kit,美国)说明书进行操作。
1.2.4 肺组织病理检测
取实验小鼠肺左叶,置于4%多聚甲醛溶液中进行固定,石蜡包埋,常规HE染色后,光镜下观察组织病理学变化。
1.3 统计学方法
2 结果
2.1 RIP3缺失对小鼠体重和死亡率的影响
流感病毒感染后,每日称重,观察小鼠状态并记录小鼠死亡情况。WT组和RIP3-/-组小鼠分别在攻毒后第2天和第3天起活动开始减少,反应迟钝。第3天后,两组小鼠均出现竖毛蜷缩、厌食和体重迅速下降。第7天后WT组小鼠出现弓背死亡,两组小鼠体重下降至第8~9天开始逐渐恢复。第3天后,两组小鼠的体重降低比率为:WT组> RIP3-/-组,但两组小鼠体重总体改变趋势差异无显著性,均为感染后前8天体重逐渐降低,第8天后体重开始逐渐恢复(图1)。WT组小鼠第7天出现死亡,至第14天时,其死亡率为87.5%,RIP3-/-组小鼠第9天出现死亡,至第14天时,其死亡率为50%,故RIP3-/-组小鼠死亡率显著低于WT组(P< 0.05,图2)。提示RIP3的缺失可降低小鼠死亡率。
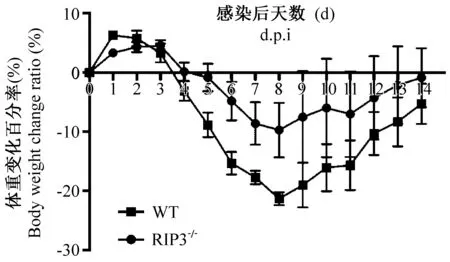
图1 攻毒后小鼠体重变化百分率Figure 1 The body weight change ratio of the mice after virus inoculation
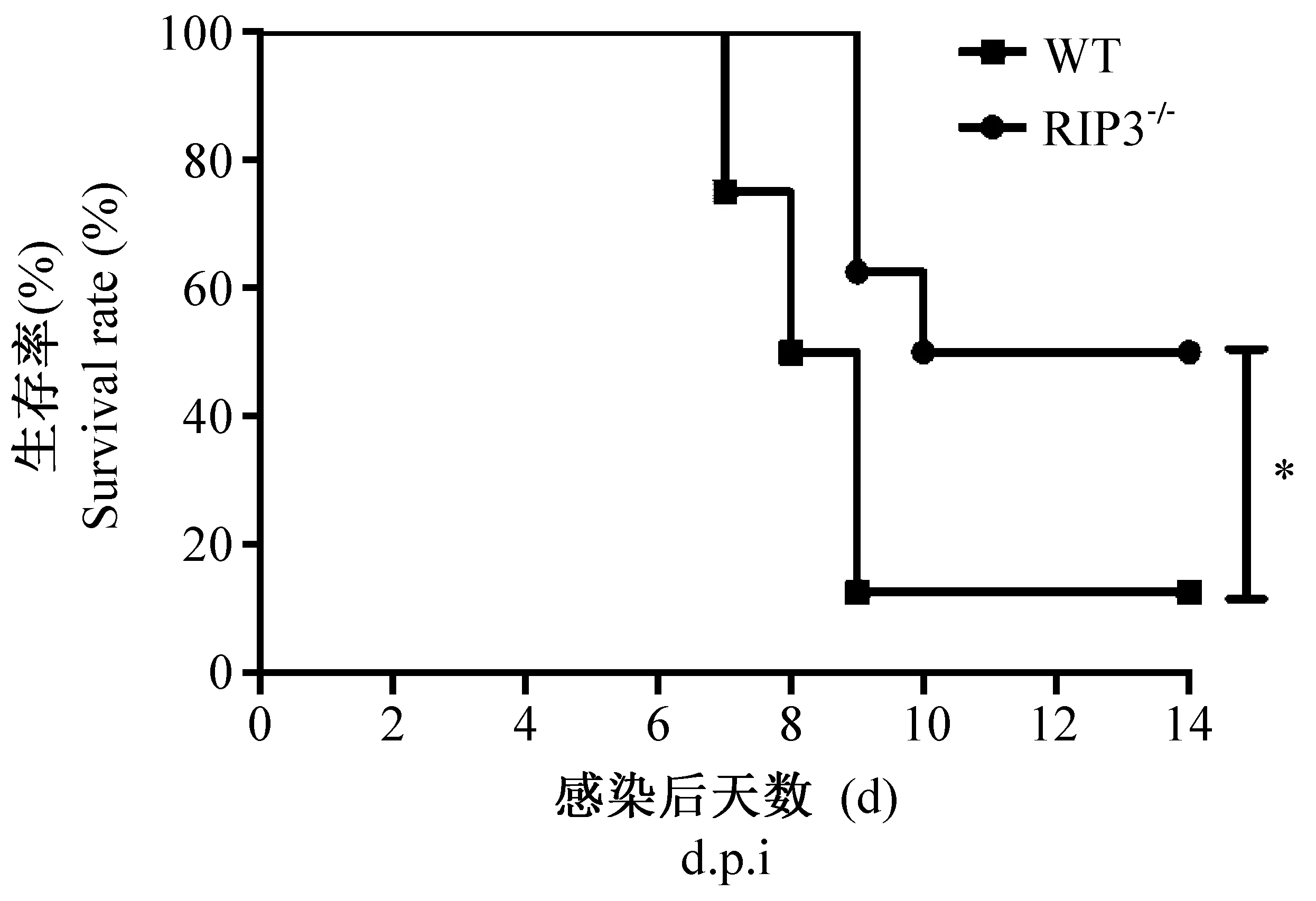
注:WT组与RIP3-/-组相比差异有显著性,*P< 0.05。图2 攻毒后小鼠生存率Note. Significant difference between the groups of WT and RIP3-/- mice, *P< 0.05.Figure 2 Survival rates of the mice after virus inoculation
2.2 RIP3缺失对病毒载量和肺指数的影响
在感染后第3、7天分别对两组小鼠进行解剖取材。取整个肺组织测得肺指数,用肺匀浆上清进行病毒载量分析。结果显示两组小鼠病毒载量在第3天和第7天无明显差异。而从肺指数上看,两组小鼠第7天比第3天肺炎症都严重,但差异均无显著性(图3)。可见,流感病毒PR8感染后,RIP3的缺失对病毒载量和肺指数基本无影响。
2.3 RIP3缺失对小鼠肺组织病理学损伤
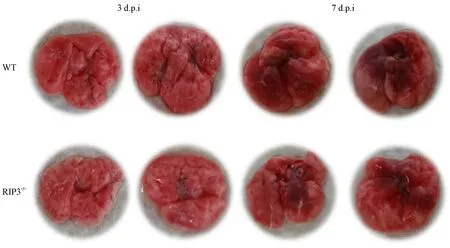
图4 RIP3-/-和WT小鼠肺大体病理改变(肉眼观察)Figure 4 Gross appearance of the lungs of RIP3-/- and WT mice (unaided viewing)
在感染后第3、7天分别对两组小鼠肺组织取材发现,肉眼可见两组小鼠均出现不同程度的肺病理改变并伴有充血现象。感染后第3天,WT组小鼠肺病变范围达10%~20%,RIP3-/-组小鼠未见显著病变;感染后第7天,两组小鼠均较第3天充血严重,但WT组小鼠肺病变范围达70%~80%,而RIP3-/-组只有30%~40%(图4)。HE染色镜下观察(图5):两组小鼠感染后第7天病理损伤均比第3天严重:肺泡间隔增宽,肺炎症细胞浸润增加。而同一时间点,RIP3-/-组小鼠较WT组小鼠病理损伤较轻,在感染后第3天,RIP3-/-组较WT组肺泡结构完整,炎症细胞浸润较少;感染后第7天,WT组肺间隔增宽显著,肺泡结构明显破坏, 肺实变明显,肺泡壁毛细血管扩张充血出血,而RIP3-/-组小鼠则相比损伤较轻。表明流感病毒PR8感染后, RIP3-/-的缺失可减少小鼠肺组织病理损伤。
2.4 RIP3缺失对炎症因子释放的影响
为研究RIP3信号通路在小鼠感染PR8后,在诱导机体产生炎症细胞因子中发挥的作用。用CBA实验对感染后第3、7天的WT和RIP3-/-小鼠肺组织匀浆中相关细胞因子进行检测。发现感染后第3天,TNF-α在RIP3-/-小鼠中显著减少(P< 0.05),感染后第7天,IFN-γ在RIP3-/-组小鼠中显著增多(P< 0.05),而IL-6、MCP-1水平在两个时间点则均未达到统计学差异(图6)。
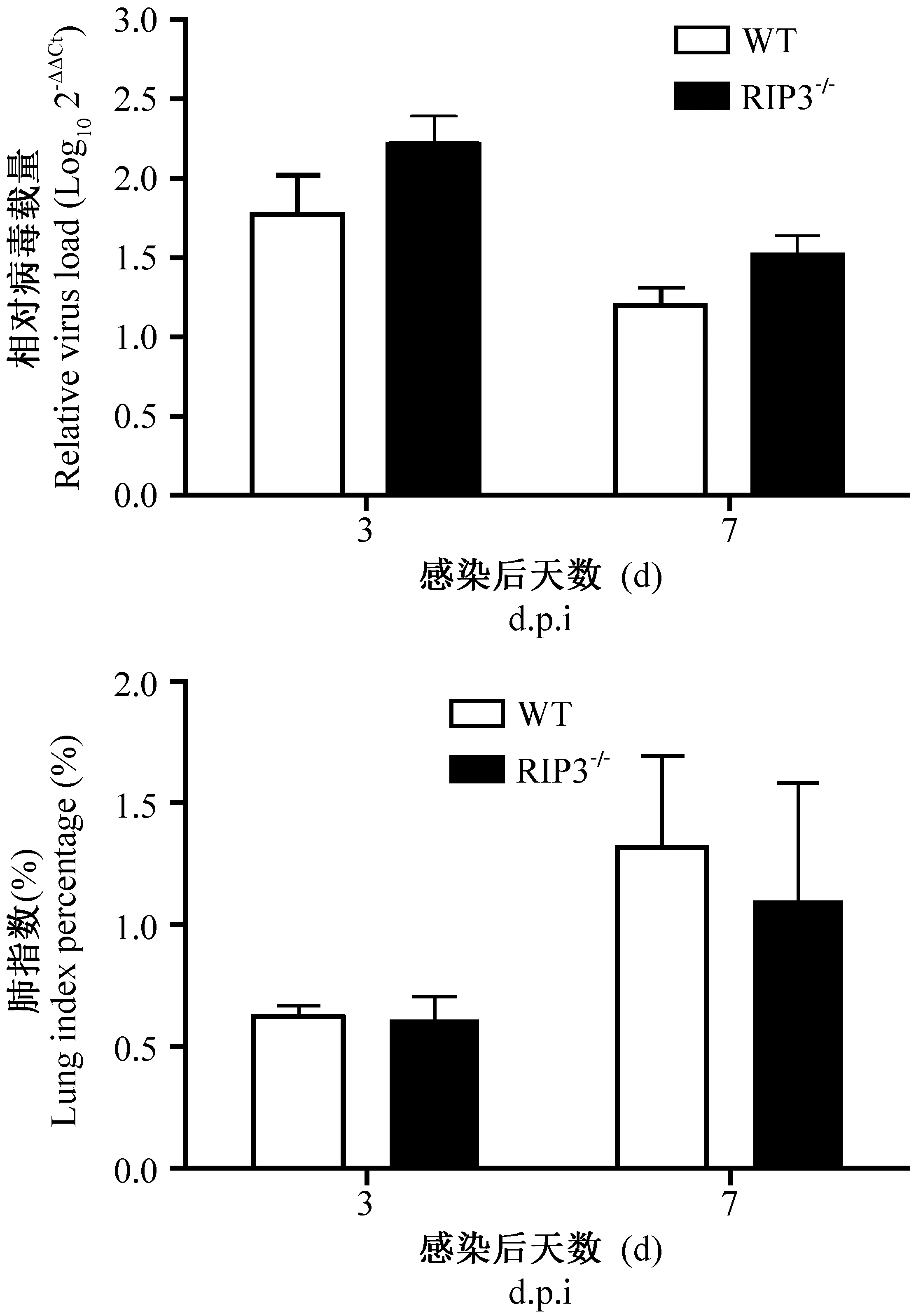
图3 攻毒后小鼠肺病毒载量和肺指数Figure 3 Viral loads and lung weight body weight ratios in the WT and RIP3-/- mice after virus inoculation
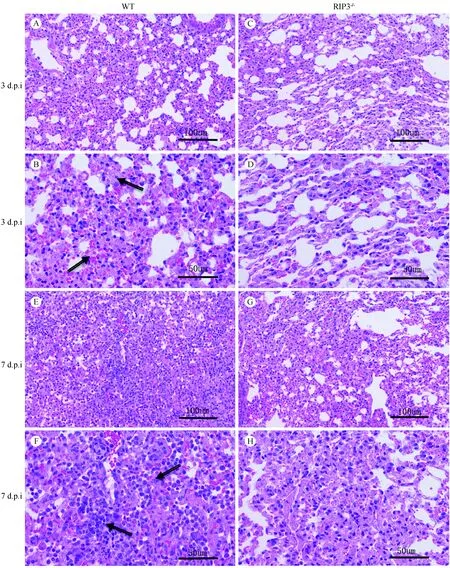
注:B箭头表示肺泡间隔显著增厚,有大量血细胞渗出;F箭头表示肺泡结构完全破环,炎性细胞大量浸润。图5 WT和RIP3-/-小鼠肺的病理改变(HE染色)Note. B. Arrow indicates significant thickening of the alveolar septum with numerous blood cells. F. Arrow represents complete breakdown of the alveolar structure with infiltration of a large number of inflammatory cells.Figure 5 Histopathological changes in the lung tissues of WT and RIP3-/- mice (HE staining)
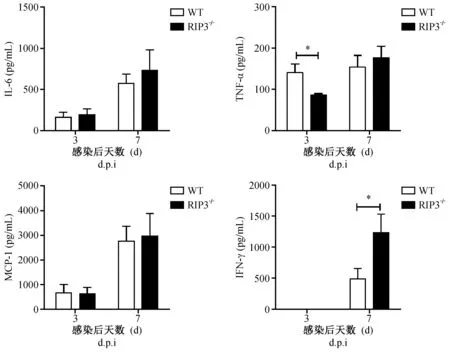
注:WT组与RIP3-/-组相比差异有显著性,*P< 0.05。图6 PR8攻毒后小鼠细胞因子应答Note. Significant difference in cytokines of the groups of WT and RIP3-/- mice, *P< 0.05.Figure 6 Levels of different cytokines in the WT and RIP3-/- mice after infection of PR8 influenza virus
3 讨论
甲型流感病毒(IAV)是一种带有负股、单链、分节的RNA基因组的包膜病毒,它是禽类和哺乳动物中流感病毒的主要病原体。急性IAV感染伴随着被感染的肺原发性上皮细胞和成纤维细胞的溶解,以及在体内呼吸道上皮细胞的破坏。在病毒复制的生命周期或对该病毒的免疫应答中,宿主细胞起到重要的作用[10,12]。有报道指出,细胞死亡例如细胞凋亡,可能是一种宿主防御机制,限制病毒在感染早期的传播和宿主的免疫病理[13]。
真核细胞的死亡机制包括细胞凋亡(apoptosis)、自噬(autophagy)和坏死(necrosis)。凋亡一般不引起炎症,而坏死与自噬则可能导致炎症。坏死的形态学特点明显异于前两者,表现为细胞膜和细胞核溶解,细胞内容物外溢,常伴随炎症的发生。而近些年的研究表明,在一定条件下细胞坏死也有信号通路参与调控,称为程序性坏死(necroptosis或programmed necrosis)。2009年,Cho[14]和Zhang[15-16]等先后发表3篇报道,揭示了受体相互作用蛋白激酶(receptor-interacting proteins, RIPs)参与调控细胞坏死的分子机制。RIPs家族成员中RIP1和RIP3可通过RHIM基序(RIP homotypic interaction motif)相互作用,二者相互结合及相互磷酸化对程序性坏死起关键调节作用。
近期研究表明,在体内无节制的细胞坏死可导致肺支气管上皮的严重退化,尽管一定程度上控制了流感病毒的复制,但还是增加了宿主的死亡率[17]。此外,一些高致病性的H1N1和H5N1型甲型流感病毒感染后,宿主对这些毒株的过度免疫应答和炎症反应是引起严重的病理病变和高死亡率的重要原因[8-10]。虽然有研究报道:Shoko Nogusa等[18]用4000 EID50(鸡胚半数感染量)的H1N1 PR8对RIP3-/-和WT小鼠进行接种研究,该研究认为细胞程序性坏死关键分子RIP3在IAV感染后,RIP3驱动的细胞死亡和炎性小体激活并共同作用,可消除受感染细胞从而限制病毒传播,提示RIP3在机体对抗IAV中起到保护作用。
但本研究中使用细胞培养扩增来源的H1N1 PR8(5.25×103TCID50)感染6~7月龄的RIP3-/-和WT组小鼠,结果发现,RIP3-/-组小鼠生存率显著高于WT组小鼠,且WT组小鼠第8天出现死亡,而RIP3-/-组小鼠第9天才出现死亡。影响生存率因素主要为以下两方面:病毒方面因素及宿主自身的免疫应答方面。本研究对感染小鼠后第3天和第7天肺病毒载量、肺组织病理及肺炎症应答作了进一步检测。结果显示,两组小鼠的病毒载量并无显著性差异;但RIP3-/-组小鼠的肺组织大体病理表现明显轻于WT组小鼠,而HE显示炎症病理也轻于WT组,这表明RIP3-/-组小鼠的肺炎症及损伤较WT组显著减轻。提示造成高死亡率及严重体重损失很可能与体内的高炎症应答有关,而并非受病毒因素的影响。细胞因子检测显示,RIP3-/-组小鼠肺内部分炎性细胞因子(TNF-α)产生的减少,与炎症病理减轻表形一致;而第7天时RIP3-/-组分泌的IFN-γ显著高于WT组,但具体机制尚不清楚。IFN-γ是一类具有免疫调节效应的细胞因子,它的产生在病毒入侵后可以限制病毒的复制,并增强宿主免疫对机体发挥保护作用。
有研究报道,在LPS诱导的细胞炎症模型中,RIP3缺失的骨髓来源的巨噬细胞和树突状细胞均不能产生炎性细胞因子[19-20],揭示了RIP3介导的程序性坏死在促炎细胞因子产生中的促进作用。但炎症是一把双刃剑。根据Shoko Nogusa等的研究及本文的实验结果,我们推测由于在RIP3-/-组小鼠中,程序性坏死信号通路在关键分子RIP3敲除后,坏死通路被抑制,从而减少了促炎性细胞因子的产生,而拥有完整坏死通路的WT组则促发了大量炎性细胞因子的产生。炎症可以限制病毒复制,起到一定保护作用;但炎症过度的情况下也会导致宿主的炎症病理损伤,从而引起高病死率。本研究报道了与Shoko Nogusa等不一致的结果,可能是由于病毒来源不同(鸡胚来源或细胞培养来源)、病毒滴度高低不同(需用同一方法滴定才能比较)、小鼠月龄不同,导致炎症处于不同的状态,从而导致不同的结局。
总之,在本研究实验条件下,观察到RIP3介导的程序性坏死信号通路在流感病毒H1N1 PR8引起的急性感染中起到一定的炎症病理作用。深入探讨RIP3介导的程序性坏死信号通路在流感病毒中的作用有助于揭示其致病机制,从而可能为研发临床治疗流感病毒感染的新药提供潜在的靶标。
