慢病毒载体介导HCV受体基因OCLN/CD81转染对树鼩骨髓间充质干细胞的影响
2019-01-07陆彩霞孙晓梅王文广匡德宣李娜仝品芬李明学代解杰
陆彩霞,孙晓梅,王文广,匡德宣,李娜,仝品芬,李明学,代解杰*
(1. 中国医学科学院/北京协和医学院医学生物学研究所树鼩种质资源中心; 2. 中国医学科学院医学生物学研究所实验树鼩标准化与应用研究省创新团队, 昆明 650118)
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)是一群来源于骨髓组织中的非造血细胞,具有自我更新和多向分化潜能的细胞[1]。BM-MSCs特性稳定,易于获得及扩增,连续传代培养和冷冻保存后仍具有多向分化潜能;能够与各种病毒载体结合,进行各种基因的转染,既能保持本身基因的稳定性,还能高效表达所转染的基因[2]。
Cluster designation 81(CD81)是四次跨膜蛋白超家族成员之一[3],研究发现,CD81是HCV入胞的受体,通过与HCV E2结合,使HCV吸附在细胞表面,在HCV入胞的早期阶段发挥作用。 Occludin(OCLN)是构成紧密连接的组成成分之一,在进化上保守,小鼠、人类和犬的OCLN基因有90%的同源性[4-5]。Dorner等[6]将表达人HCV受体CD81、SR-BI、Claudin-1、和OCLN的重组腺病毒载体静脉注射小鼠后,使小鼠获得了对HCV-CRE的感染,并证实能表达CD81和OCLN的动物都能成功感染HCV-CRE。国内外很多学者将这些受体转染非肝源性细胞,发现这些原本无法被HCV感染的细胞获得了HCV易感性[6-8],从而认为CD81和OCLN是HCV入胞的两个最为关键的受体[6]。
树鼩(tree shrew,TupaiaBelangeri)是比大小鼠等啮齿类动物更接近非人灵长类的动物[9],树鼩的CD81和OCLN与人类CD81和OCLN同源性分别达93%和88%[10]。树鼩作为一种新型实验动物,在生物医学研究中的应用范围越来越广,可用于肝炎病毒、柯萨奇病毒、单纯疱疹病毒等病毒类疾病的研究和阿尔茨海默、抑郁症等神经系统疾病的研究[11-15]。利用树鼩BM-MSCs开展慢病毒载体介导HCV受体(OCLN/CD81)基因转染实验,研究转染后对树鼩BM-MSCs生物学特性的影响和受体的表达情况,为下一步利用树鼩BM-MSCs开展HCV研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物
F1 代成年普通级树鼩,雌雄不限,体重 110~130 g,来自中国医学科学院医学生物学研究所树鼩种质资源中心【SCXK(滇) K2013-0001】,实验在中国医学科学院医学生物学研究所进行【SYXK(滇) K2013-0001】。所有操作均符合中国医学科学院医学生物学研究所动物伦理审查的要求(伦理审批号:医科生伦字[2016]7号)。
1.1.2 实验试剂
人淋巴细胞分离液(天津灏洋生物制品有限公司)、DMEM/F12(Thermo,美国)、高糖DMEM(HyClone,美国)、胎牛血清(Thermo)、地塞米松(Enzo)、3-异丁基-甲基黄嘌呤(IBMX)、胰岛素、吲哚美辛(Sigma)、噻唑蓝(MTT)、DMSO(Sigma)、茜素红(Solarbio)、BMP-2(PeproTech,美国)、油红O(Sigma)、RNAzol(MRC,cat.no:RN 190)、All-in-OneTM First-Strand cDNA Synthesis Kit(GeneCopoeia,cat.no:AORT-0020)、All-in-OneTM qPCR Mix(GeneCopoeia,cat.no:AORT-0020)、胰酶、肝素钠、青霉素、链霉素、4%多聚甲醛、CCK-8试剂盒(碧云天生物技术)。
1.1.3 实验仪器
倒置荧光显微镜(Nikon Ti,日本)、二氧化碳孵箱(Thermo,美国)、酶标仪(BioTek,美国)、细胞自动计数仪(Bio-Rad,美国),流式细胞仪(BD Accuri C6,美国),实时荧光定量仪(Bio-Rad,美国),小型离心机(CT15RE,日本),垂直电泳槽(Bio-Rad,美国)、半干转膜仪(Bio-Rad,美国)、水平脱色摇床、凝胶成像系统(Bio-Rad,美国)。
1.1.4 BM-MSCs细胞
由本实验室分离鉴定保存,具体方法见我们之前的报道[11]。
1.2 方法
1.2.1CD81和OCLN慢病毒载体的构建
构建过表达人CD81(NM_004356.3)和OCLN(U53823.1)慢病毒载体,分别含有GFP和RFP荧光,标记为LV-CD81和LV-OCLN。病毒滴度测定采用稀释计数法,制备好的慢病毒载体置于-80℃冰箱保存备用。
1.2.2 慢病毒载体转染树鼩BM-MSCs
采用1/2小体积感染法,即取P3代树鼩BM-MSCs以5×104个/mL接种6孔板,待第二天细胞长至约60%汇合时,吸去旧培养基,加入1/2体积新鲜培养基。按MOI=100,换算为对应的病毒原液体积,并按体积将病毒原液加入细胞中,摇匀,置于37℃、5% CO2孵箱中感染4 h后取出细胞,直接往含病毒的培养基中加入另外1/2体积的新鲜培养基。感染后第2天,吸去含病毒的培养基,换上新鲜的培养液,继续37℃、5% CO2孵箱中培养。感染72 h后,进行荧光显微镜拍照和流式细胞仪分析感染效率。
1.2.3 流式细胞仪(FACS)分析慢病毒感染效率
将慢病毒感染72 h后的BM-MSCs细胞用0.25%的胰蛋白酶溶液消化,用基础培养基混悬细胞,收集于1.5 mL的EP管中,3500 r/min离心3 min,弃上清。添加0.1% BSA-PBS 1 mL混悬细胞,3500 r/min离心3 min,弃上清。添加4% formaldehyde 100 μL,再添加PBS 400 μL。混悬细胞后,将细胞转移至上样管中,上机分析样品。
1.2.4 慢病毒转染后树鼩BM-MSCs生长曲线测定
将慢病毒感染后的树鼩BM-MSCs及未感染慢病毒的对照组第3代树鼩BM-MSCs用0.25%胰蛋白酶溶液消化后制成单细胞悬液。取10 μL细胞与台盼蓝染液按1∶1混匀后,再取10 μL加入到细胞计数板,将细胞计数板插入到伯乐细胞计数仪上计数,按细胞密度为4×104个/mL接种96孔细胞板,每孔取200 μL, 每组每个时间点设3个复孔,放入37℃、5% CO2孵箱中培养。分别于培养的1d、2d、3d、4d、5d、6d、7d检测各组细胞光密度值。检测前,吸走原有培养基,每孔加入10 μL CCK-8溶液与100 μL培养基混合液,在培养箱孵育4 h。酶标仪(450 nm)读取各孔光密度(OD)值,并绘制细胞生长曲线。
1.2.5 慢病毒转染后树鼩BM-MSCs向脂肪细胞诱导
将感染慢病毒的BM-MSCs用0.25%胰蛋白酶溶液消化后制成单细胞悬液,细胞计数后按照2×104个/mL接种于12孔板中,每孔1 mL,常规培养基培养至细胞生长汇合至80%左右时,更换培养基为成脂诱导液(DMEM/F12 + 100 U/mL青霉素 + 100 μg/mL链霉素溶液 + 10% FBS + 1 μmol/L地塞米松 + 0.2 mmol/L吲哚美辛 + 0.01 mg/mL胰岛素 + 0.5 mmol/L IBMX)。放入37℃、5% CO2孵箱中继续培养,每隔48 h换液。诱导2周后进行油红O染色。
1.2.6 慢病毒转染后树鼩BM-MSCs向成骨细胞诱导
将感染慢病毒的BM-MSCs用0.25%胰蛋白酶溶液消化后制成单细胞悬液,细胞计数后按照2×104个/mL接种与12孔板中,每孔1 mL,常规培养基培养至细胞生长汇合至80%左右时,更换培养基为成骨诱导液(高糖DMEM + 50 ng/mL BMP-2 + 10% FBS + 100 U/mL青霉素 + 100 μg/mL链霉素溶液)。放入37℃、5% CO2孵箱中继续培养,每隔48 h换液。诱导18 d后进行茜素红染色。
1.2.7 慢病毒转染后树鼩BM-MSCs干性基因检测
提取慢病毒转染前后的树鼩BM-MSCs总RNA,提取方法按MRC的“Trizol法提取总RNA”试剂盒说明书进行。用设计的LIN28A、NANOG、OCT4和SOX2引物(见表1)进行qRT-PCR定量检测。干性基因相对表达量采用基因相对定量分析法(2-ΔΔCT法),以GAPDH为内参基因。
1.2.8 慢病毒感染后CD81和OCLNmRNA表达检测
细胞总RNA提取方法按MRC的“Trizol法提取总RNA”试剂盒说明书进行。用设计的CD81和OCLN引物(见表2)进行qRT-PCR定量检测。CD81和OCLNmRNA表达量采用基因相对定量分析法(2-ΔΔCT法),以GAPDH为内参基因。

表1 干性基因引物列表Table 1 Primer sequences
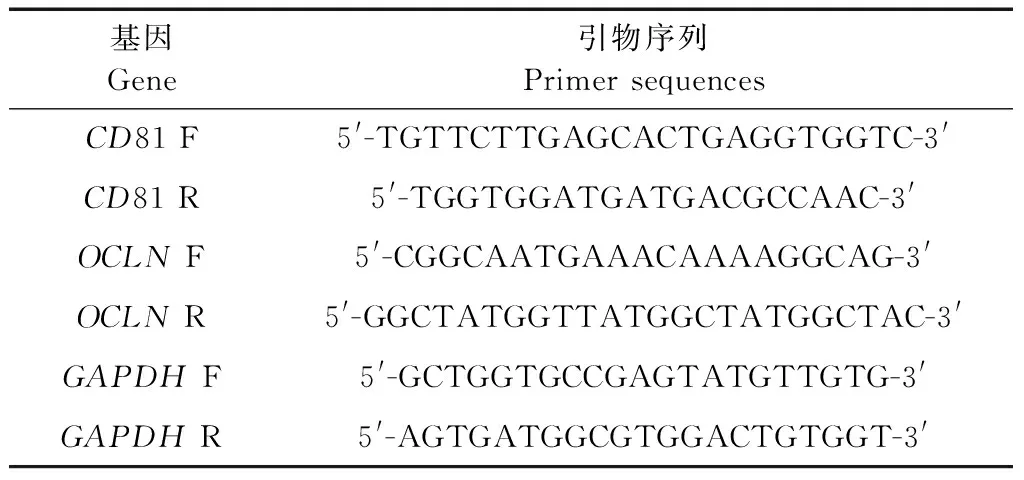
表2 CD81和OCLN引物列表Table 2 Primer sequences of CD81 and OCLN
1.2.9 慢病毒感染后CD81和OCLN 蛋白表达检测
采用Western blot检测CD81和OCLN蛋白表达水平。分别配置10%和12%的分离胶,取等量蛋白量(含细胞蛋白25 mg)上样行电泳。电泳条件:浓缩胶恒压80 V,20 min,分离胶恒压 100 V,约60 min。转膜后,置于5%的脱脂奶粉中,室温封闭30 min。加入CD81和OCLN一抗,室温孵育60 min。洗膜后加入二抗,室温摇床上孵育1.5 h, 用1X TBST在室温摇床上充分脱色后,用TBST洗膜,最后采用ECL底物化学发光法在凝胶成像系统显色成像。
1.3 统计学方法
2 结果
2.1 CD81和OCLN 过表达慢病毒载体的构建
CD81和OCLN慢病毒阳性重组克隆均通过测序,证明载体构建成功。LV-CD81病毒滴度为1× 108TU/mL, LV-OCLN病毒滴度为3×108TU/mL。
2.2 含人 CD81和OCLN的慢病毒转染效率
转染72 h后,荧光倒置显微镜下观察,在MOI=100时,可见荧光细胞几乎满视野,细胞呈条索状(图1)。流式细胞仪检测LV-CD81转染效率达99.4%,LV-OCLN转染效率22.6%(图2)。
2.3 含人 CD81和OCLN的慢病毒转染对树鼩BM-MSCs增殖能力的影响
P3代树鼩BM-MSCs转染含人CD81和OCLN分子的慢病毒后,均在3 d进入对数生长期,之后呈现下降趋势,7 d又开始回升。转染基因后细胞增殖的总体趋势与未转染基因的BM-MSCs相似(图3),但LV-OCLN组细胞增殖活力相对于未转染组和LV-CD81组低。
2.4 慢病毒转染树鼩BM-MSCs后成脂诱导鉴定
BM-MSCs成脂诱导6 d后,镜下可见细胞变圆变大,细胞内有小的脂滴形成,成“葡萄样”改变,随着培养时间的增加细胞内脂滴逐渐变大,诱导14 d后油红O染色可见脂滴被染成红色。正常对照组BM-MSCs红色脂滴较转染了慢病毒的BM-MSCs产生的脂滴多(图4)。
2.5 慢病毒转染树鼩BM-MSCs后成骨诱导鉴定
慢病毒转染BM-MSCs后成骨诱导18 d后进行茜素红染色,镜下可观察到红色结节,但成骨对照组红色结节较转染了慢病毒的BM-MSCs产生的红色结节多(图5)。
2.6 慢病毒转染树鼩BM-MSCs后干性基因检测
未转染组均表达干性相关基因LIN28A、NANOG、OCT4,不表达SOX2。LV-OCLN和LV-CD81转染树鼩BM-MSCs后,NANOG基因mRNA表达增高,差异有显著性(P< 0.05),LIN28A基因mRNA表达下降,差异有显著性(P< 0.05)(图6)。
2.7 慢病毒感染后CD81和OCLN mRNA表达
构建的含人CD81/OCLN慢病毒载体在转染树鼩BM-MSCs后,CD81和OCLN的mRNA表达均较未转染组高表达,差异有显著性(P< 0.05)(图7)。
2.8 慢病毒感染后CD81和OCLN 蛋白表达
Western blot 结果显示转染组OCLN蛋白和CD81蛋白水平均高于未转染组,差异有显著性(P< 0.05)(图8)。
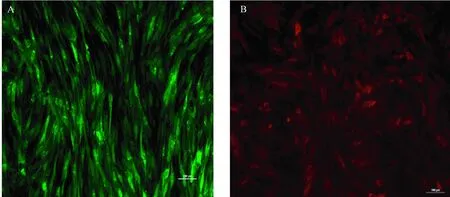
注:A. 含人CD81慢病毒转染BM-MSCs; B. 含人OCLN慢病毒转染BM-MSCs。图1 慢病毒转染后荧光倒置显微镜观察(×100)Note. A. LV-CD81-BM-MSCs. B. LV-OCLN-BM-MSCs.Figure 1 Detection of transfection efficiency of LV-OCLN and LV-CD81 by FACS using a fluorescence inverted microscope (×100)
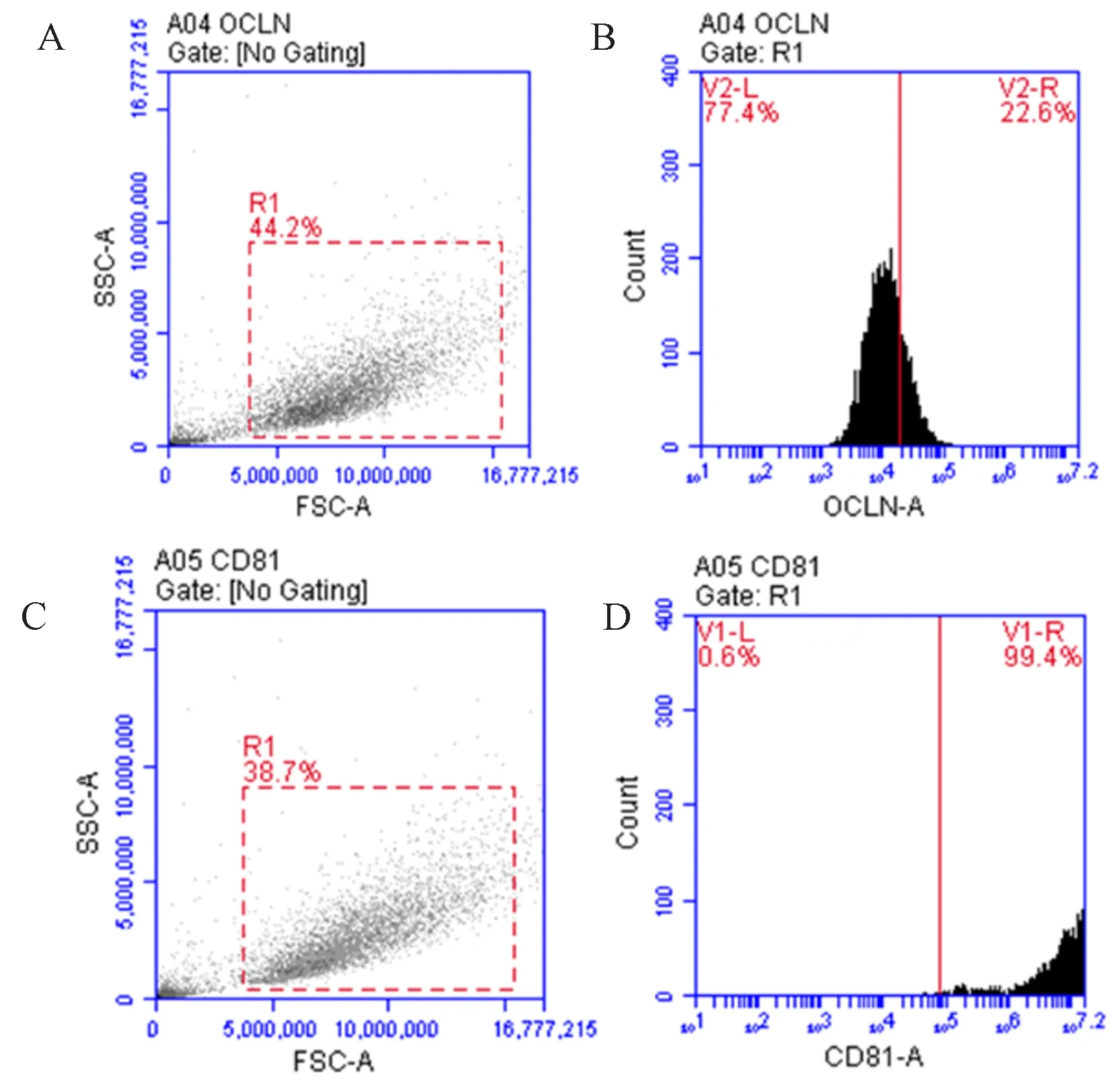
注:A-B. 流式细胞仪检测LV-OCLN转染效率;C-D. 流式细胞仪检测LV-CD81转染效率。图2 流式细胞仪检测转染效率Note: A-B. Detection of transfection efficiency of LV-OCLN by FACS. C-D. Detection of transfection efficiency of LV-CD81 by FACS.Figure 2 Detection of transfection efficiency of LV-OCLN and LV-CD81 by FACS
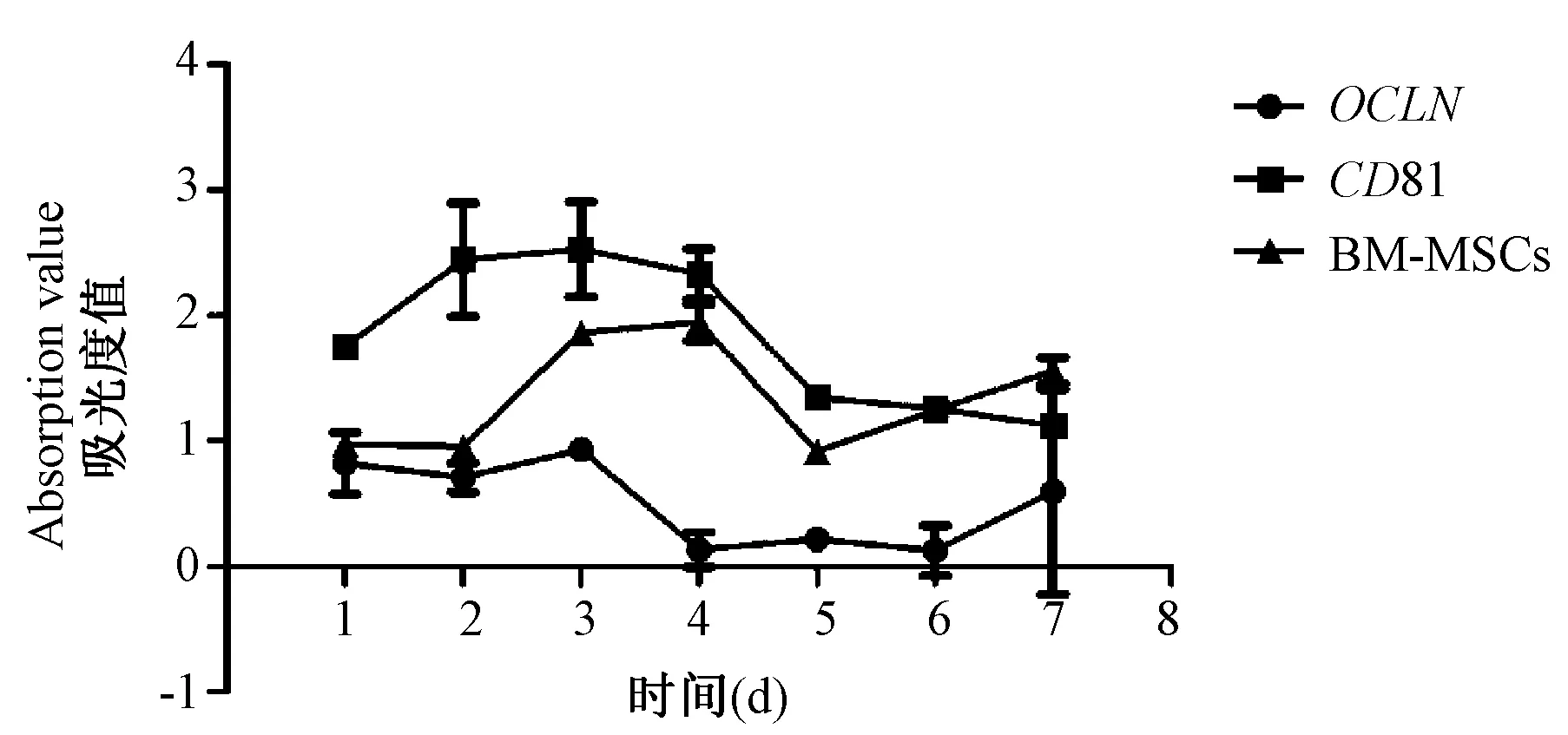
图3 含人CD81和OCLN分子的慢病毒转染后树鼩BM-MSCs 的生长曲线Figure 3 Growth curve of tree shrew BM-MSCs transfected with CD81/OCLN lentiviral vector

注:A.成脂对照组;B. LV-CD81-BM-MSCs;C. LV-OCLN -BM-MSCs。图4 慢病毒转染树鼩BM-MSCs后成脂诱导第14天后油红O染色(×100)Note. A. Control group of adipogenic induction. B. LV-CD81 group of adipogenic induction. C. LV-OCLN group of adipogenic induction.Figure 4 Adipogenic induction of BM-MSCs after transfection with lentivirus at day 14 by oil red O staining (×100)
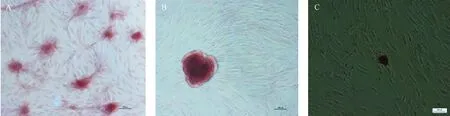
注: A. 成骨对照组; B. LV-OCLN -BM-MSCs; C. LV-CD81-BM-MSCs。图5 慢病毒转染树鼩BM-MSCs后成骨诱导第18天后茜素红染色(×100)Note. A. Control group of osteogenic induction. B. LV-OCLN group of osteogenic induction. C. LV-CD81 group of osteogenic induction.Figure 5 Osteogenic induction of BM-MSCs after transfection with lentivirus at day 18 by alizarin red staining (×100)
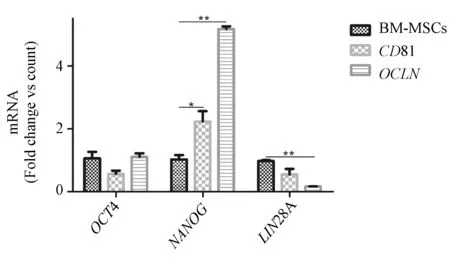
图6 慢病毒转染树鼩BM-MSCs后干性基因检测Figure 6 Pluripotency marker detection of BM-MSCs after transfection with lentivirus
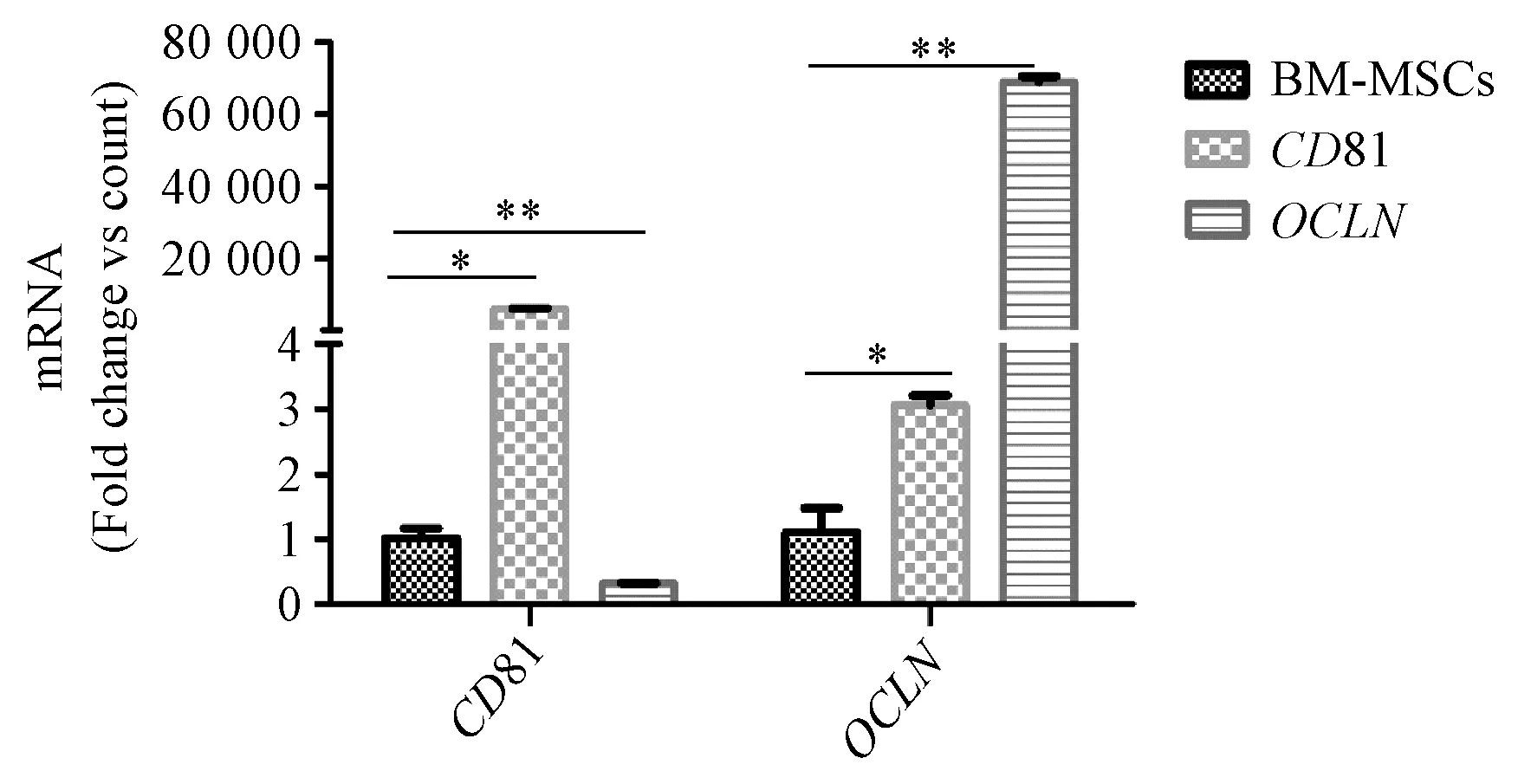
图7 慢病毒转染后CD81和OCLN mRNA表达Figure 7 mRNA expression of CD81 and OCLN after lentivirus infection
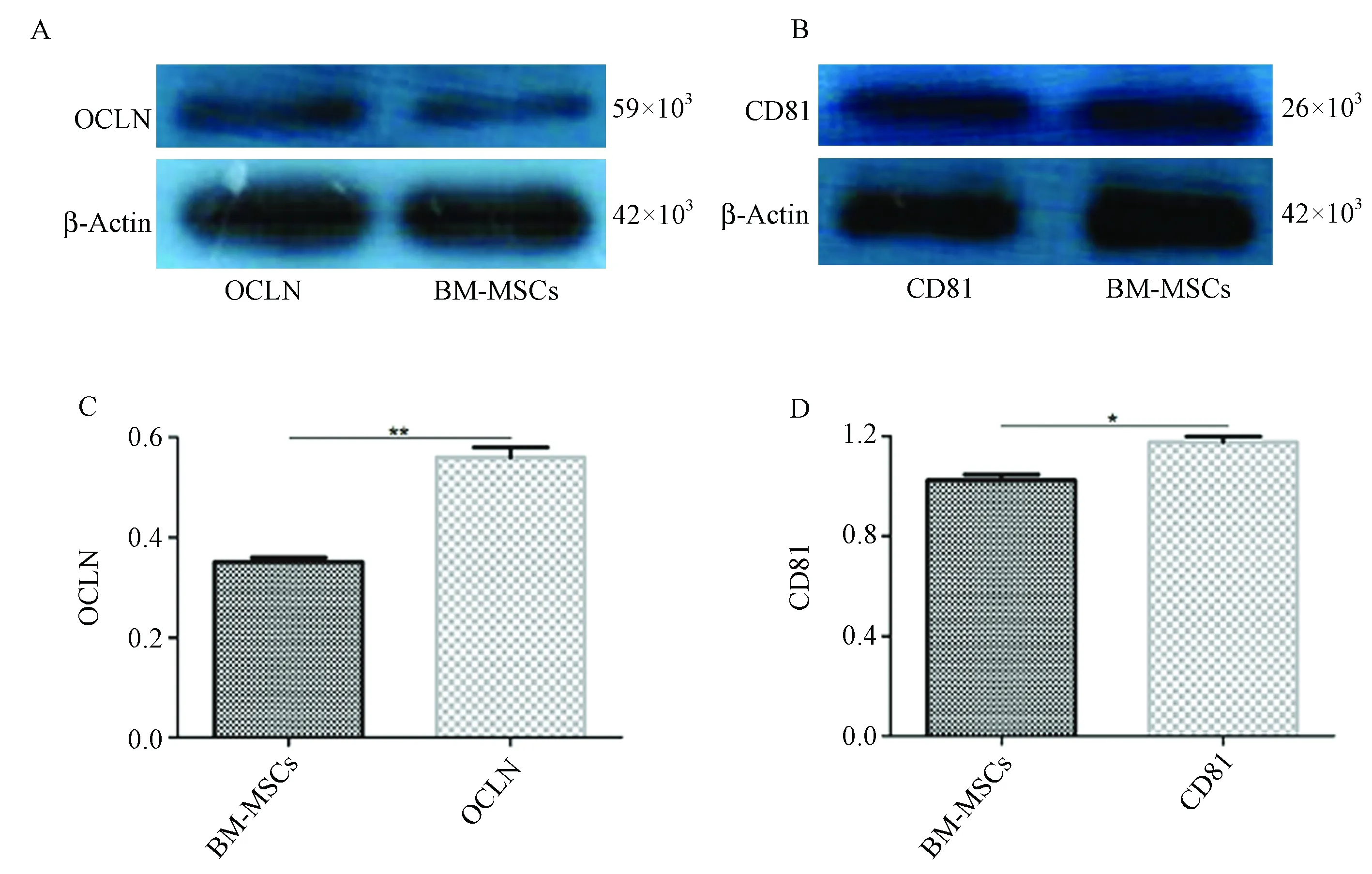
注:A-C. 慢病毒转染后OCLN蛋白表达;B-D. 慢病毒转染后CD81蛋白表达。图8 慢病毒转染树鼩BM-MSCs后CD81/OCLN基因的蛋白表达Note. A, C. The OCLN protein expression of BM-MSCs after transfection with lentivirus. B, D. The CD81 protein expression of BM-MSCs after transfection with lentivirus.Figure 8 CD81 and OCLN protein expression of BM-MSCs after transfection with lentivirus
3 讨论
BM-MSCs起源于中胚层,除了可以向成骨细胞,脂肪细胞,心肌细胞,肝和胆道上皮细胞等中胚层细胞分化,同时又有向外胚层的神经元细胞和内胚层的肝卵圆细胞分化的潜力。BM-MSCs不涉及道德及伦理学方面的问题,且容易在体外培养,具有高度的扩增能力,能够与各种病毒载体结合,进行各种基因的转染,既能保持本身基因的稳定性,还能高效表达所转染的基因[2]。
基因转染的方法有非病毒载体和病毒载体转染两种。病毒载体主要有逆转录病毒介导、慢病毒介导法、腺病毒介导以及腺相关病毒介导等,各有利弊。慢病毒可以感染分裂和不分裂的细胞,感染细胞时病毒基因组整合于宿主染色体上,能稳定长期表达,免疫原性低,安全性较好,已成功感染了造血干细胞、神经细胞、胰岛细胞、肝细胞、视网膜色素上皮细胞、肌肉细胞和气道上皮细胞等[16-18]。腺病毒载体感染细胞时病毒基因组并不整合到染色体上,只瞬时表达外源基因,免疫原性高,反复应用易引起免疫反应[19]。苏玉金等[20]报道慢病毒载体转染SD大鼠BM-MSCs效率高于腺相关病毒转染BM-MSCs(AAV转染率为49.1%,LV转染率为91.4%)。我们在实验前期曾尝试用腺病毒载体和Lipofectamine 2000脂质体介导转染树鼩BM-MSCs,但发现两者的转染效率都很低。而在用慢病毒转染树鼩BM-MSCs时,发现在感染复数(MOI)为100时, LV-CD81转染效率达99.4%,LV-OCLN转染效率22.6%,转染效率的高低可能与所携带的外源基因的大小有关(CD81,711 bp,OCLN,1569 bp)。
武成聪等[21]在研究重组腺病毒在不同感染复数下转染兔BM-MSCs,发现随感染复数值的增加,BM-MSCs贴壁能力减弱,部分细胞老化、死亡,转染效率在5%~12%之间。感染复数达250时,成骨分化潜能受到影响,最适感染复数为100。在我们的研究中发现,在不加入助转剂(polybrene)时,含人OCLN/CD81慢病毒载体转染树鼩BM-MSCs的最适感染复数为100,细胞状态良好,未出现死亡现象,转染效率较高。助转剂的加入可以降低病毒用量,同时提高转染效率,我们发现在加入终浓度为4 μg/mL的助转剂时,在MOI为30时,即可达到理想的转染效率(数据未给出)。MOI为100时,转染含人OCLN/CD81慢病毒载体后,树鼩BM-MSCs生长曲线总体趋势一致,但LV-OCLN组在生长后期出现增殖缓慢,推测可能与转入的外源基因片段大有关。
在多向分化潜能上,转染了含人OCLN/CD81慢病毒载体后,树鼩BM-MSCs虽然依然能向成脂成骨诱导分化,但诱导的脂肪细胞和成骨细胞比未转染组少。说明在MOI为100时,其多向分化潜能受到一定的影响。多向分化潜能性基因或干性维持基因(如LIN28A、NANOG、OCT4、SOX2)特定表达于具有多向分化潜力的细胞,对干细胞的多向分化具有调节作用, 其表达量随着干细胞的分化而逐渐下降[22-24]。对成体干细胞的研究发现,随着年龄的增长干细胞自身增殖及分化功能减退[25-26],推测可能与干细胞的干性维持相关的基因表达下降有关[27-28]。Tsai 等[23]发现OCT4及NANOG基因在成体MSCs同样高表达,而敲除OCT4 及NANOG基因后,MSCs 的增殖及分化均明显下降,而自发性分化现象明显增加。我们应用PCR技术评估了慢病毒载体介导的HCV受体基因OCLN/ CD81转染对树鼩BM-MSCs 内LIN28A、NANOG、OCT4、SOX2基因的表达情况,结果显示SOX2在转染和未转染细胞中基本检测不出来,可能是树鼩BM-MSCs不表达该基因。OCT4表达量在转染和未转染细胞中表达量无显著性差别,而NANOG表达量转染组比未转染组高,表达量有显著性差异。LIN28A基因表达量转染组比未转染组低,差异有显著性。这些差异的出现说明外源基因的导入,对树鼩BM-MSCs干性相关基因的表达有一定的影响,这些变化也间接影响了其多向分化潜能。
构建的含人OCLN/CD81慢病毒载体在转染树鼩BM-MSCs后,CD81和OCLN的mRNA表达和蛋白表达均较未转染组高表达,有显著差异,说明我们构建的慢病毒载体能成功地转染树鼩BM-MSCs并表达转入的外源基因,这为下一步在转染HCV受体(OCLN/CD81)的树鼩BM-MSCs上进行HCVcc相关感染实验提供了基础。
