葡萄糖代谢异常导致SIVmac239感染北平顶猴急性期体重变化
2019-01-07张瀚丹宋天章杨柳萌郑永唐
张瀚丹,宋天章,杨柳萌,郑永唐*
(1. 大理大学药学与化学学院,云南大理 671000; 2. 中国科学院昆明动物研究所、云南省活性多肽研究与利用重点实验室/中国科学院动物模型与人类疾病重点实验室,国家昆明高等级生物安全灵长类动物实验中心,昆明 650223)
人类免疫缺陷综合征(acquirid immunodeficiency syndrome,AIDS),简称艾滋病,是由人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染引起的一种严重致死性传染病。目前,全球年均HIV新发感染者可达210万人,且每年约有110万人死于艾滋病引起的各种相关性疾病。根据艾滋病患者的临床表现,可将整个病程分为3个时期:(1)急性感染期:通常出现在HIV初次感染后2~4周,患者常无特异性临床表现,可表现为持续发热、腹泻、皮疹等症状;(2)无症状期:无明显临床表现,部分患者出现腹股沟等部位淋巴结肿大等症状,高效抗逆转录病毒治疗(highly active antiretroviral therapy, HAART)可使患者长期停留于无症状期,从而有效延长艾滋病患者寿命;(3)艾滋病期:患者表现出典型的艾滋病相关消瘦综合征,并且出现多种机会性感染及肿瘤,最终死亡。艾滋病患者体重下降是艾滋病疾病进展的重要表现,是艾滋病期的典型特征,与艾滋病患者的预后及死亡率变化密切相关。赵晓梅等[1]对HIV感染者的流行病学研究中显示,HIV感染者的体重既有减低,也有升高。急性感染期HIV感染引起的体重变化及相关机制依然不明确且鲜见研究报道。
持续炎症反应、脂类代谢异常及葡萄糖代谢异常是诱发体重变化的3大主要原因。首先,以TNF-α、IL-6为主的多种促炎细胞因子的持续存在,通过多种机制影响体重变化。TNF-α可以通过旁分泌或自分泌的方式作用于脂肪细胞,抑制脂肪细胞分化为成熟脂肪细胞,继而促进脂肪细胞凋亡及分解[2],减少机体脂肪蓄积。Hotamisligil等[3]研究发现:肥胖患者多伴有IL-6等多种促炎细胞因子诱导的全身持续性低度炎症反应;Mohamed等[4]研究表明,脂肪组织分泌大量的IL-6,其含量与肥胖程度呈正相关。脂代谢异常是诱导体重变化的另一重要因素。脂代谢异常常见于肥胖患者,主要表现为血液中总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-CH)和甘油三酯(TG)升高,高密度脂蛋白胆固醇(HDL-CH)降低[5]。高蛋白、高脂肪、高能量的“三高”饮食的过量摄入,会引起高胆固醇血症、高甘油三酯血症以及低密度脂蛋白胆固醇升高,加速体重增加[6]。随着肥胖程度的增加,血脂异常率也逐步递增[7],大量的内脏脂肪堆积产生脂解作用,使游离脂肪酸释放增多或脂蛋白脂肪酶的活性改变,导致TG、TC及LDL-CH合成增加[8]。因此,TG等的升高可作为体重增加的预测因素。第三,以糖尿病患者为代表的糖代谢异常表现对体重变化的诱导也具有重要影响。胰岛素抵抗现象导致血糖无法被有效利用,从而引起体重下降。同时,为了维持血糖的稳定,II型糖尿病患者可代偿性的分泌大量胰岛素,过多的胰岛素从血浆转运到中枢神经系统,作为调节肥胖的负反馈信号,减少食物摄取并使体重减轻[9]。
本实验室首先建立了艾滋病北平顶猴实验动物模型[10],在SIVmac239感染后可有效地模拟人HIV感染相关的临床表现,模型感染急性期病毒载量及CD4+T细胞数量变化与HIV感染者急性期变化基本一致。因此,本实验选用SIVmac239感染的北平顶猴为研究对象,探讨急性期体重变化的原因及可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
雄性北平顶猴购于中国科学院昆明动物研究所灵长类研究中心【SCXK(滇)K2017-0003】。实验动物饲养于中国科学院昆明动物研究所灵长类研究中心【SYXK(滇)K2017-0008】,单兽笼饲养,保证标准光照周期(12 h光明,12 h黑暗),给予标准饲料及苹果等瓜果类喂养。根据北平顶猴感染后17周内体重变化,分别挑选出3只体重变化最明显的北平顶猴作为体重增加组与体重减少组。本研究中所涉及的一切实验规程均获得中国科学院昆明动物研究所伦理委员会的批准(批准号:2015SYDW-2015021)。
1.1.2 实验仪器
ELX-800酶标仪(BioTek,美国);37℃恒温箱(上海齐欣,中国);Cobas 8000全自动生化免疫分析仪(Roche,瑞士);定量PCR仪(ABI ViiATM7 Real-Time PCR System, 美国);超低温冰箱(Haire, 中国)。
1.1.3 实验试剂
盐酸氯胺酮注射液(江苏中牧);氯化钠注射液(昆明南疆);猴IL-6、TNF-α、胰岛素ELISA检测试剂盒(江苏雨桐,F4483B、F4490B、F6249A);Diethylpyrocarbonate(AMRESCO,E174);High Pure Viral RNA Kit(Roche, 11858882001);RNA-directTMRealtime PCR Master Mix(toyobo, QRT101)。
1.2 方法
1.2.1 SIVmac239病毒接种
0.2 mL/kg盐酸氯胺酮注射液肌肉注射麻醉,待动物彻底麻醉后,0.9%氯化钠注射液将病毒稀释为2000 TCID50/mL,下肢胫后静脉接种2 mL。
1.2.2 动物血浆分离及体重称量
北平顶猴夜间禁食,12 h后于次日清晨采血。0.2 mL/kg盐酸氯胺酮注射液肌肉注射麻醉,待动物彻底麻醉后,进行体重称量,下肢胫后静脉抽取静脉血至含EDTAK2的真空管,1500 r/min离心15 min,吸取上层血浆,分装后于-80℃冻存。抽血后2 h内完成血浆分离及样品冻存。
1.2.3 ELISA方法检测IL-6、TNF-α、胰岛素
分别采用猴IL-6、TNF-α、胰岛素ELISA 检测试剂盒测定血浆中IL-6、TNF-α、胰岛素含量。按照试剂盒说明书操作,酶标仪于波长450 nm 处检测样品的吸光度值,根据标准曲线计算样品的IL-6、TNF-α及胰岛素浓度。
1.2.4 血脂四项、血糖检测及胰岛素抵抗
采用Cobas 8000全自动生化免疫分析仪检测血浆总胆固醇、甘油三酯、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇和血糖。稳态模型评估胰岛素抵抗指数(HOMA-IR)是目前使用最广泛的用于评价胰岛素敏感性、胰岛素抵抗水平的指标,用于评价感染前后北平顶猴胰岛素抵抗水平。HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(mU/L)/22.5。
1.2.5 Real-time PCR检测血浆中病毒载量
按High Pure Viral RNA Kit中的实验步骤提取血浆中总RNA:向1.5 mL RNase free Eppendorf管中加入400 μL binding buffer,2 μL poly (A) carrier RNA,再加入200 μL血浆,震荡混匀,室温下保持10 min;转移到过滤柱内,9342 r/min离心20 s;弃去收集管及其中的液体,换上新收集管,加入500 μL inhibitor removal buffer, 9342 r/min 离心1 min;弃去收集管及其中的液体,换上新收集管,加入450 μL洗涤缓冲液,9342 r/min 离心1 min,重复1次;弃去收集管,将过滤柱放到新收集管,11 908 r/min 离心10 s;弃去收集管,换上1.5 mL RNase free Eppendorf管,开口在生物安全柜放置10 min;加入50 μL Elution Buffer,9342 r/min 离心1 min,得到RNA。利用RNA-directTMRealtime PCR Master Mix进行Real-time PCR。SIV引物参照本实验室以往研究[11],引物序列为:5′-TCGGTCTTAGCTCCATT AGTGCC-3′ (上游), 5′-GCTTCCTCAGTGTG TTTCACTTTC-3′ (下游)和5′-CTTCTGCGTG AATGCACCAGATGACGC-3′ (探针),由宝生物工程(大连)有限公司合成。利用美国ABI公司ViiATM7实时荧光定量PCR仪完成检测,反应条件为:90℃,30 s;61℃,21 min;95℃,30 s;95℃,15 s,60℃,1 min,进行 45个循环。
1.3 统计学方法
所得数据采用GraphPad Prism 6.02软件处理,组间比较采用t检验,P< 0.05时认为差异具有统计学意义,运用Pearson分析进行线性相关分析。
2 结果
2.1 北平顶猴体重变化及分组
纳入实验的北平顶猴基本信息如表1。12只北平顶猴均为雄性,年龄8~10岁,感染前进行3个月的适应性饲养,期间无明显体重变化。部分实验动物偶尔出现腹泻症状,但是对于实验动物体重,进食等并无影响。根据实验动物个体感染前体重,进行感染后体重变化比率的分析。如图1所示,感染第17周体重变化大于4%的个体分别纳入体重增加组(weight increase group)和体重减少组(weight decrease group)。体重增加组北平顶猴编号为:08267、08327、09219;体重减少组北平顶猴编号为:08275、09221、09239。

表1 雄性北平顶猴信息Table 1 Information on the male northern pig-tailed macaques
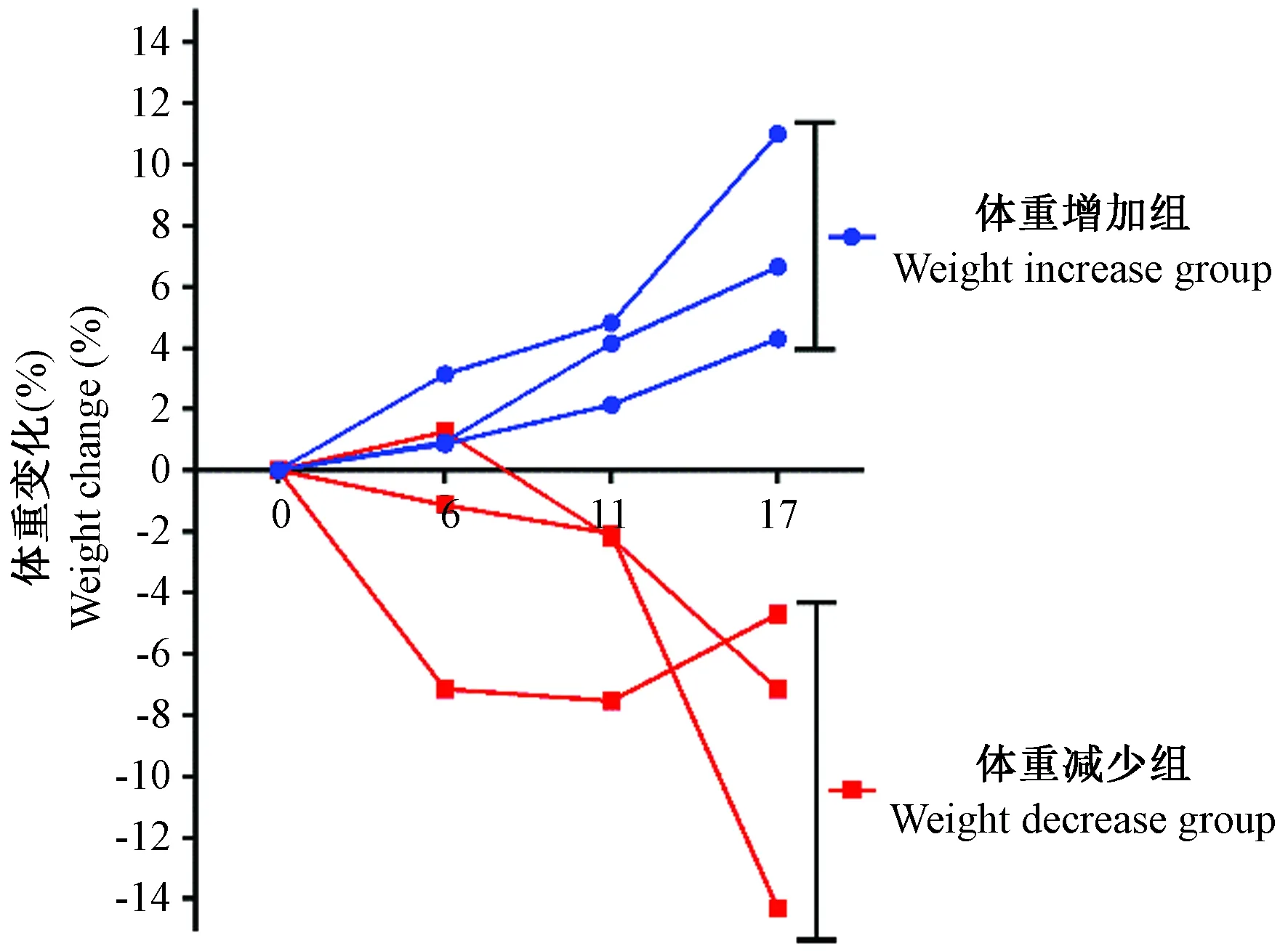
图1 体重增加组及体重减少组北平顶猴SIVmac239感染急性期体重变化Figure 1 Weight changes in the weight increase group and the weight decrease group in the northern pig-tailed macaques in acute stage of SIVmac239 infection

图2 SIVmac239感染北平顶猴急性期血浆TNF-α (A)和IL-6 (B)变化Figure 2 Changes of plasma TNF-α (A) and IL-6 (B) in the northern pig-tailed macaques in acute stage of SIVmac239 infection
2.2 血浆IL-6和TNF-α变化
血浆IL-6和TNF-α是评价急性全身性炎症反应的重要指标,也是引起脂肪代谢变化继而引起体重变化的关键因子。如图2所示,SIVmac239感染前后,两组实验动物IL-6及TNF-α水平基本保持一致。血浆TNF-α感染后似乎有上升趋势,但并无统计学差异。此外,体重增加组与体重减少组相比,血浆IL-6及TNF-α水平在各时间点均无统计学差异。
2.3 血浆TC、TG、HDL-CH和LDL-CH变化
血脂四项是评价机体脂类代谢的重要指标。如图3所示,SIVmac239感染急性期,体重增加组与体重减少组实验动物血浆TC、TG、HDL-CH和LDL-CH均未出现明显变化。两组相比,血浆TC、TG、HDL-CH、LDL-CH也无明显差异。但是,感染前体重减少组LDL-CH水平明显低于体重增加组,具体原因尚不明确。
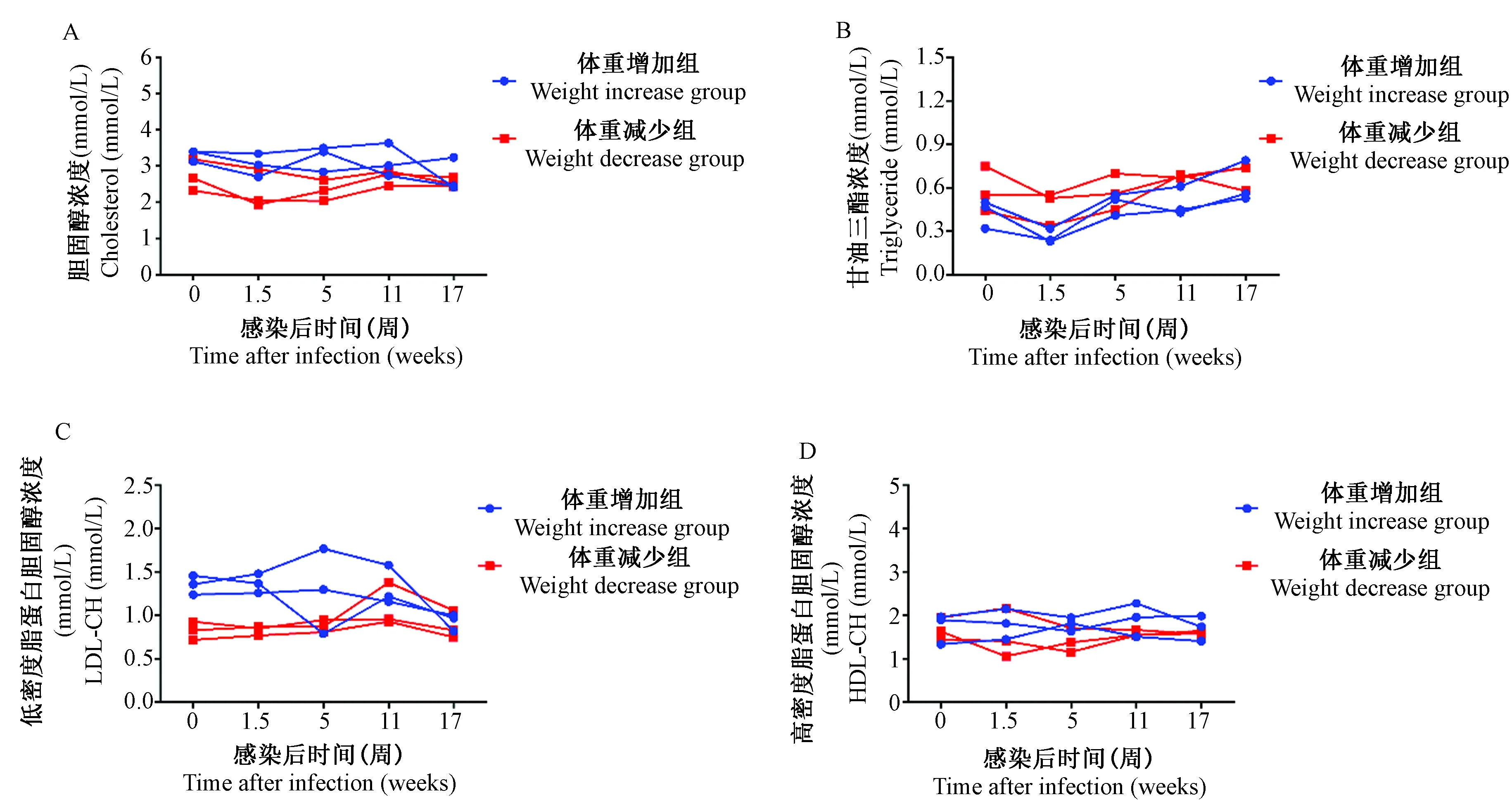
注:A. 胆固醇;B. 三酰甘油;C. 低密度脂蛋白胆固醇;D. 高密度脂蛋白胆固醇。图3 SIVmac239感染北平顶猴急性期的血浆血脂变化Note. A. cholesterol; B. triglyceride; C. low-density-lipoprotein cholesterol; D. high-density-lipoprotein cholesterol.Figure 3 Changes of plasma lipid level in the northern pig-tailed macaques in acute stage of SIVmac239 infection
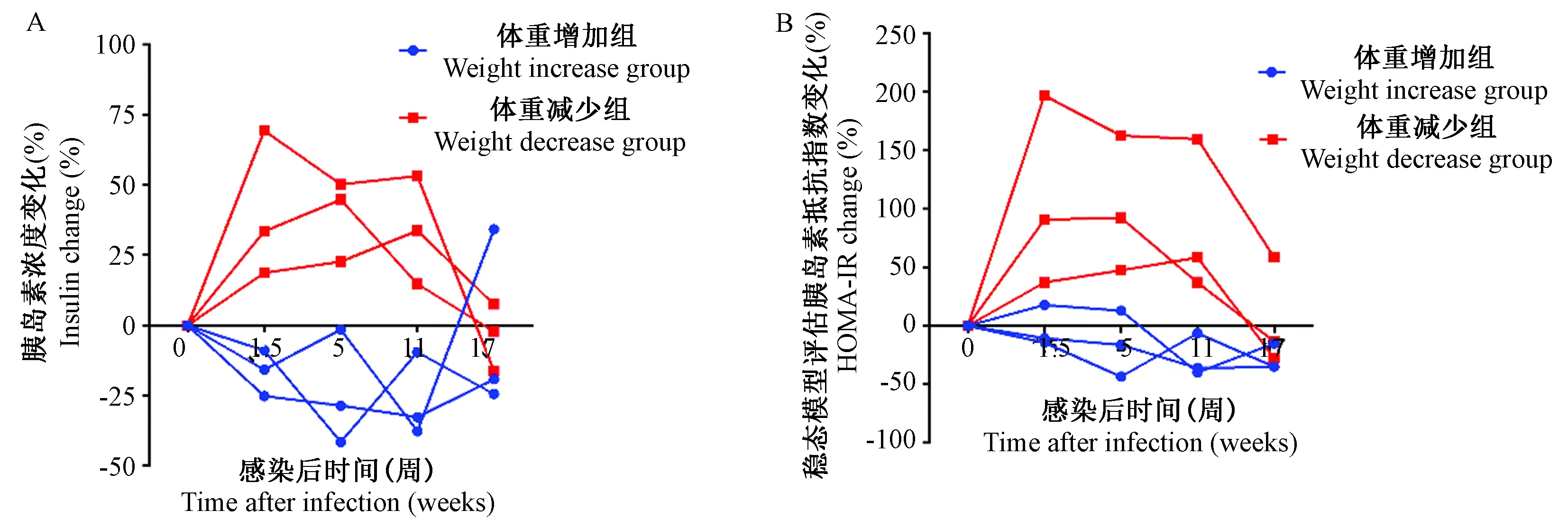
注:A. 胰岛素浓度变化;B. 胰岛素抵抗指数(HOMA-IR)变化。图4 SIVmac239感染北平顶猴急性期的葡萄糖代谢变化Note. A. Changes of insulin concentration; B. Changes of insulin resistance index (HOMA-IR).Figure 4 Changes of glucose metabolism in the northern pig-tailed macaques in acute stage of SIVmac239 infection
2.4 葡萄糖代谢变化
与感染前相比,SIVmac239感染后,体重增加组及体重减少组均出现明显的血浆胰岛素水平变化。体重减少组感染后第1.5、5及11周血浆胰岛素水平明显升高,第17周血浆胰岛素水平恢复正常(图4A)。与之相比,体重增加组感染后血浆胰岛素水平明显下降。通过HOMA-IR指数分析显示(图4B),体重减少组在感染后第1.5、5及11周胰岛素抵抗指数明显增加,感染后体重增加组胰岛素抵抗指数无明显增加。
2.5 北平顶猴血浆病毒载量
对北平顶猴血浆病毒载量进行长期监测发现(图5):感染后病毒载量持续升高,并于第2~3周达到峰值,两组之间无明显差异。随后体重增加组血浆病毒载量持续下降,并于感染后第11周,血浆病毒载量小于103copies/mL。与之相比,体重减少组感染后第3~5周,血浆病毒载量出现明显下降;第5周后,血浆病毒载量较为稳定,感染后第11周,体重减少组病毒载量大于5×103copies/mL。
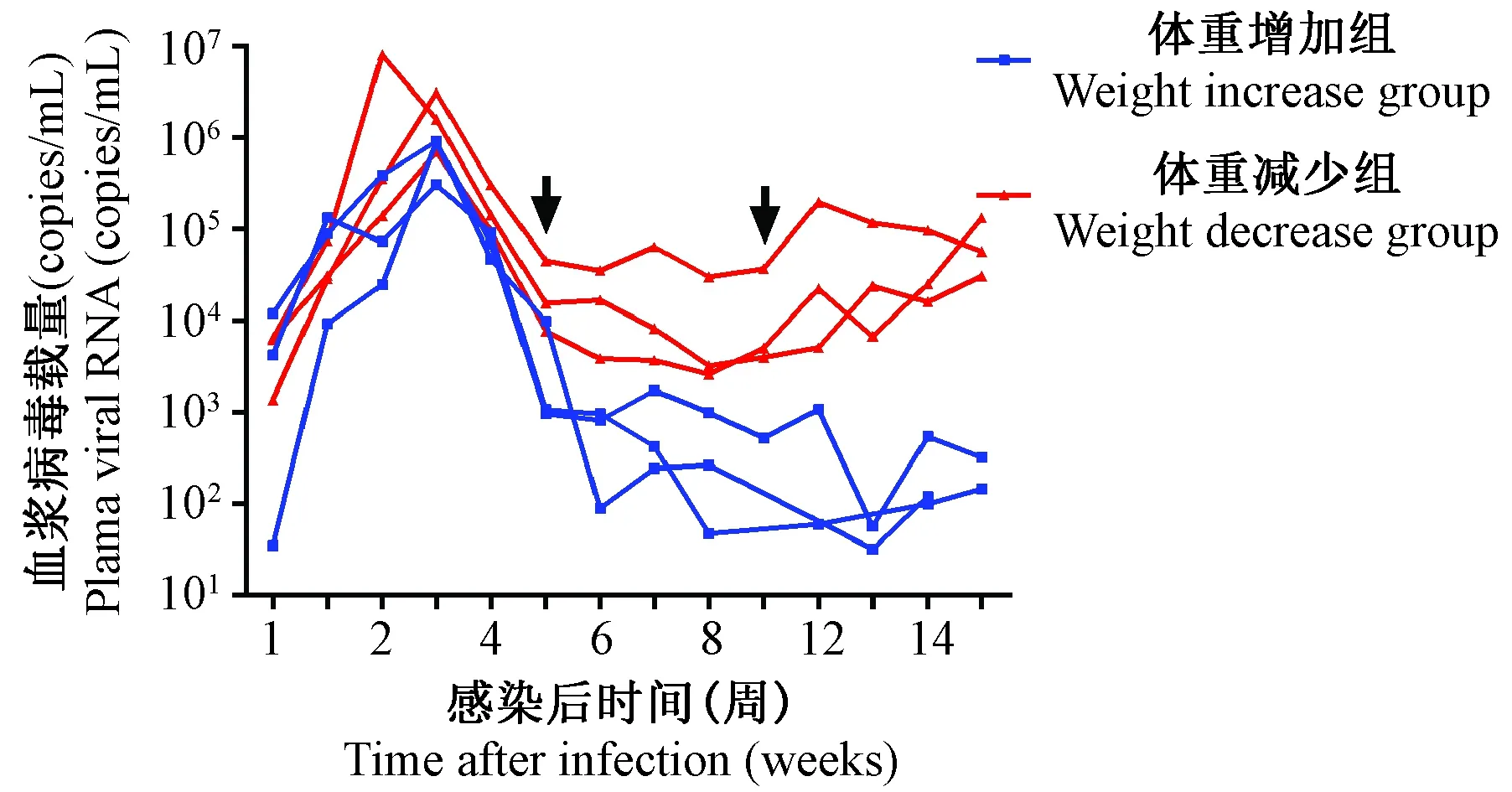
图5 SIVmac239感染北平顶猴急性期的病毒载量Figure 5 Plasma viral load in the northern pig-tailed macaques in acute stage of SIVmac239 infection
2.6 病毒载量与胰岛素抵抗相关性分析
通过对SIVmac239感染后第5周和第11周的北平顶猴血浆胰岛素抵抗水平与血浆病毒载量的相关性分析发现:北平顶猴感染第5周、第11周时,其胰岛素抵抗水平与病毒载量呈正相关(r值分别为0.8571、0.8426;P值分别为0.0081、0.0098),胰岛素抵抗现象随着血浆病毒载量的增加而增强(图6)。
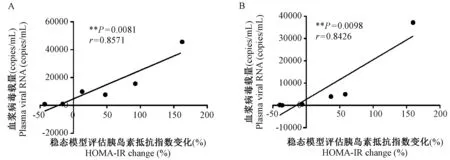
图6 SIVmac239感染北平顶猴后第5周(A)和第11周(B)病毒载量与胰岛素抵抗相关性分析Figure 6 Correlations between plasma viral load and insulin resistance at the 5th week (A) and 11th week (B) after SIVmac239 infection in the northern pig-tailed macaques
3 讨论
本研究显示,SIVmac239感染急性期,北平顶猴个体之间体重变化差异明显,体重明显增加及减少的实验动物个体均存在。体重减少组与体重增加组血浆TNF-α、IL-6以及血脂四项无明显变化。有趣的是,两组实验动物均出现明显的葡萄糖代谢异常表现。体重增加组感染后胰岛素水平下降;而体重减少组表现出明显的血浆胰岛素水平升高,并伴有显著的胰岛素抵抗现象。
Taylor等[12]研究发现进入艾滋病期的HIV感染者,其体重下降与IL-6水平升高明显相关。Wig等[13]发现AIDS患者的血浆TNF-α浓度与艾滋病长期消瘦有重要联系。HIV感染急性期,CD4+T细胞大量消耗及肠道黏膜损伤导致的微生物易位共同引起全身性的反应,诱导IL-6和TNF-α等炎症因子的产生[14]。然而,在本研究中,北平顶猴SIVmac239感染急性期,体重增加组与体重减少组的血浆IL-6和TNF-α水平无明显差异,表明它们不是导致SIV感染急性期北平顶猴体重变化的原因。此外,Willig等[15]发现AIDS患者体重受血脂异常的影响。HIV感染慢性期,患者出现TC、LDL-CH和HDL-CH的降低并伴有TG的升高[16]。长期HAART治疗也会引起脂类代谢异常及再分布的现象。本研究中,SIVmac239急性感染期北平顶猴血浆TC、TG、HDL-CH及LDL-CH与感染前相比均无明显差异。因此,SIVmac239感染急性期,北平顶猴脂类代谢并不对其体重变化造成影响。
胰岛素是由胰岛β细胞分泌的一种多肽类激素,是诱导血糖下降的唯一激素,与体重控制之间存在着直接联系。SIVmac239感染急性期,体重增加组与体重减少组北平顶猴胰岛素出现不同的变化趋势。体重增加组的胰岛素明显减少,这与Noumegni等[17]发现AIDS患者胰岛素水平降低导致体重增加相一致,但具体原因尚不明确。此外,Guillen等[18]在对秘鲁感染HIV的成年人研究中发现,AIDS患者的HOMA-IR指数与体重指数之间存在相关性。本研究也同样发现,体重减少组血浆胰岛素水平明显升高,HOMA-IR指数明显增加,出现胰岛素抵抗表现。因此,葡萄糖代谢异常是SIVmac239感染北平顶猴急性期导致体重变化的主要因素。
胰岛素的信号转导主要通过磷脂酰肌醇-3-激酶(PI-3K)途径。活化的过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor γ, PPAR-γ)能够促进PI-3K亚单位p85的表达,并在转录水平增加c-Cb1相关蛋白(CAP),从而促进信号转导,改善胰岛素抵抗[19]。然而,HIV复制过程中辅助蛋白Vpr可通过抑制PPAR-γ活性而影响胰岛素信号转导,从而导致胰岛素抵抗和胰岛β细胞功能异常[20],致使AIDS患者胰岛素抵抗发生率大于非AIDS患者[21]。同时,兰丽娟等[22]发现,HIV病毒载量是HOMA-IR的独立影响因素,高病毒载量对AIDS患者的胰岛素抵抗及胰岛β细胞功能产生负面影响。在本研究中,北平顶猴SIVmac239感染后5周,两组北平顶猴的血浆病毒载量开始出现不同的变化,到第11周时,两组间的血浆病毒载量相差最大。我们通过对第5周和第11周的HOMA-IR指数变化与病毒载量的相关性分析发现,病毒载量与胰岛素抵抗具有相关性。SIVmac239感染急性期,体重减少组实验动物病毒载量明显高于体重增加组,高病毒载量的存在严重影响胰岛β细胞的功能,进而出现明显的胰岛素抵抗及体重下降表现。
本研究发现,SIV急性感染期,葡萄糖代谢异常是导致体重明显下降的主要原因。峰值后持续存在的高病毒载量损伤胰岛β细胞,导致胰岛素抵抗,进而诱导体重下降。相比之下,急性期胰岛素水平下降可能是体重增加的主要原因,但机制尚不明确。因此,HIV感染急性期对于葡萄糖代谢相关指标的监测有助于及时判断胰岛功能的损伤,有利于疾病进展程度的预测及相应治疗策略的实施。
