双氢青蒿素联合奥沙利铂对人结肠癌HCT116细胞的增殖及凋亡的影响
2019-01-03刘丹丹周峰旭李凌晨
李 霁,刘丹丹,周峰旭,李凌晨,纳 鑫
昆明医科大学药学院暨云南省天然药物药理重点实验室,昆明 650500
结肠癌的死亡率位居我国恶性肿瘤的第三位,结肠癌治疗采用手术为主,化疗为辅的方法进行治疗。奥沙利铂(Oxaliplatin,L-OHP)是治疗结直肠癌的一线药物,已应用多年,但因易产生多药耐药及发生末梢神经炎而限制了其使用[1,2]。青蒿素为我国首次从黄花蒿中提取的一种高效低毒的抗疟药,研究发现青蒿素及衍生物除具有抗疟作用外,还具有抗病毒和抗肿瘤作用。Efferth等[3]对55个肿瘤细胞株研究发现结肠癌等肿瘤细胞对青蒿素类化合敏感,双氢青蒿素(Dihydroartemisinin,DHA)为青蒿素类化合物在体内的主要活性代谢产物,与其他青蒿素类药物相比显示出较强的抗肿瘤活性且毒性较低[4,5]。因此本研究将双氢青蒿素和奥沙利铂联合应用,观察体外两药联合对结肠癌细胞株HCT116增殖和凋亡的影响,为双氢青蒿素抗肿瘤的临床应用提供依据。
1 材料与方法
1.1 试剂与材料
双氢青蒿素(Fluka公司,美国);奥沙利铂(江苏恒瑞医药股份有限公司,中国);RPMI 1640培养基(GIBCO公司,美国);胎生牛血清(GIBCO公司,美国);二甲基亚砜(Amresco公司,美国);二甲基四氮唑蓝(Amresco公司,美国);十二烷基硫酸钠(北京鼎国生物技术有限公司,中国);异丁醇(上海化学试剂公司生产,中国);浓盐酸(成都市欣海兴化工试剂厂,中国);Annexin V-FITC(欣博盛公司,中国);Bax、Bcl-2抗体(Abcom公司,英国)。
1.2 仪器与设备
酶标仪(Molecular Devices公司,美国;型号Plus384);倒置显微镜(OLYMPUS公司,日本;型号CKX31);流式细胞仪(Beckman公司,美国;型号Coultet FCS500);CO2培养箱(Hereaus公司,德国;型号3111.REL#5)
1.3 细胞培养
HCT116细胞(Hunman colon tumor-116)保存于云南省天然药物药理重点实验室,于10%新生牛血清RPMI1640培养液中,5% CO2,37 ℃孵育培养。
1.4 MTT测定细胞增殖抑制率
取对数期的细胞接种于96孔培养板中,每孔含细胞8×103个,培养12小时后加入DHA,L-OHP,每组样本设3个复孔,空白对照组加入等体积的AS,溶媒对照组0.5%DMSO。48小时后,每孔加入MTT溶液(5 mg/mL)20 μL,于37 ℃继续孵育4 h终止培养,加入三联液100 mL,过夜后比色,选择570 nm和630 nm为测定波长,在酶联检测仪双波长法上测定每孔吸光度(OD),记录结果。抑制率=(1-实验组OD/空白组OD)×100%。
1.5 联合用药药效评价
采用金正均Q值法分析两药联合效应,公式Q=Ea+b/(Ea+Eb-Ea×Eb),其中Ea、Eb表示a、b两药单独作用时的细胞抑制率,Ea+b表示两药联合作用时的细胞抑制率,式中分母表示“期望合并效应”,分子表示“实测合并效应”,Q值为二者的比值,Q<0.85表示两药联用为拮抗作用,0.85≤Q≤1.15为相加作用,Q>1.15为协同作用。
1.6 AnnexinV-FITC/PI双染检测细胞凋亡
药物作用48小时后,用0.5%胰酶消化细胞,各组样本细胞用冷PBS洗涤二次,并在染色缓冲液中以1×106细胞/ml的浓度重悬。吸取100 μL的细胞至试管中,加入适量荧光标记的Annexin-V和PI。按照说明书提示浓度操作,混匀后避光室温下孵育10 min。孵育后加入300 μL染色缓冲液,立即上流式细胞仪分析,实验重复3次。
1.7 caspase-3,caspase-8活性检测
取对数生长期HCT116细胞,用DHA(10 μmol/L) ,L-OHP(0.02 μmol/L) ,DHA(10 μmol/L) +L-OHP(0.02 μmol/L)联合,设定空白对照组,分别诱导24 h后,收集细胞。加入100 μL 裂解缓冲液,涡旋振荡。然后置于冰上15 min,每5 min 涡旋振荡一次。在4 ℃,500×g下离心5 min,取上清液。对上清液用考马斯亮蓝法进行蛋白定量。取10 μmol/L(大约含20~50 μg) 蛋白的上清液,加入90 μL检测缓冲液和10 μL Ac-DEVD-pNA,在37 ℃避光反应1~2 h,出现黄色时检测其活性。在酶标仪上选择450 nm波长测定吸光度。根据凋亡诱导的细胞的吸光度与空白对照细胞的吸光度的比值计算相对的caspase-3,caspase-8 的活性程度。
1.8 Western blot分析
对数生长期的细胞,按试验要求处理后,收集细胞,PBS洗涤3次,加入细胞裂解液,100 μL,14 000 rpm离心10 min,蛋白定量,取40 μg蛋白加入上样缓冲液,95 ℃下10 min。l0%的聚丙烯酰胺SDS凝胶电泳后转移至硝酸纤维膜上,5%脱脂牛奶封闭后依次加入第一、二抗体,室温下孵育2 h,TBST缓冲液洗涤3次,加入化学发光剂,放人暗盒中并压片,2~5 min后显影、定影。
1.9 单细胞凝胶电泳实验
(1)将处于对数生长期的HCT116细胞,接种于六孔板中,接种密度为5×105个/孔。CO2培养箱中培养4 h。重悬于冷PBS中,并调整细胞浓度为5×103个/mL,置于冰上待用。(2)制备1%常温熔点琼脂糖凝胶,将凝胶涂布于载玻片上,涂布厚度约为0.5 mm,并将制备好的凝胶置于4 ℃冰箱中冷却凝固。同时制备1%低熔点琼脂糖凝胶,最后再在上层涂布一层常温熔点琼脂糖凝胶,形成一个“三明治凝胶”。加入0.5X TBE 电泳缓冲液,30 V ,电泳15 min。最后置于Du red染色液中染色1 h,置于荧光显微镜下,采用CASP彗星分析软件分析。
1.10 统计学分析

2 实验结果
2.1 DHA与L-OHP联合对HCT116人结肠癌细胞增殖的抑制作用
L-OHP与DHA单独和联合使用对HCT116人结肠癌细胞增殖的抑制作用,单独使用L-OHP或DHA对HCT116细胞均具有明显的增殖抑制作用,并具有一定的量效关系。在DHA10 μmol/L与L-OHP 0.01、0.02、0.04、0.08、0.16 μmol/L浓度对HCT116人结肠癌细胞进行联合应用,结果显示其抑制率分别达到49.39%、64.99%、73.48%、75.21%、77.49%,比两药单独使用抑制率显著提高,结果有统计学意义,(**P<0.01)(见表1)。
2.2 金正均Q值进行联合用药作用分析
DHA在10 μmol/L浓度下,L-OHP在0.01 μmol/L、0.02 μmol/L、0.04 μmol/L浓度下Q>1.15,两药联合应用可表现出明显的协同作用。而DHA在10 μmol/L浓度,L-OHP在0.08 μmol/L、0.16 μmol/L浓度下Q值在0.85~1.15之间,两药联合应用表现出相加作用(见表1)。
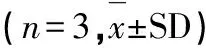
表1 DHA、L-OHP及联合用药对HCT116细胞的抑制率Table 1 Inhibitory effects of DHA and L-OHP and combination on HCT116
注:与10 μmol/L DHA组比较*P<0.05;**P<0.01。与同浓度的L-OHP组比较,#P<0.05;##P<0.01。Q<0.85表示两药联用为拮抗作用,0.85≤Q≤1.15为相加作用,Q>1.15为协同作用。
Note:Compared with 10 μmol/L DHA group*P<0.05;**P<0.01.Compared with the same concentration of L-OHP group,#P<0.05;##P<0.01.Q<0.85 indicates that the two drugs are combined for antagonism,0.85≤Q≤1.15 for additive effect,and Q>1.15 for synergistic effect.
2.3 DHA与L-OHP联合应用对HCT116细胞凋亡的影响
DHA与L-OHP单独和联合作用于结肠癌细胞HCT116 48小时后,对照组凋亡率为3.91%;DHA组在10 μmol/L浓度下凋亡率为19.14%;L-OHP组在0.02 μmol/L浓度下凋亡率为27.31%;两药联合组凋亡率为35.52%比DHA组和L-OHP组均较高,(**P<0.01)(见图1)。
2.4 Western-blot检测Bcl-2及Bax蛋白
Western-blot检测Bcl-2及Bax蛋白,结果显示,DHA组、L-OHP 组以及DHA、L-OHP联合组作用HCT116细胞24 h后,检测Bcl-2/Bax蛋白变化,DHA 、L-OHP联合组与DHA组比较,Bcl-2/Bax降低,**P<0.01 ,DHA 、L-OHP 联合组与L-OHP 比较,Bcl-2/Bax降低,(##P<0.01)(见图2)。
2.5 Caspase-3,Caspase-8 活性检测
对给药后的Caspase-3,Caspase-8进行活性检测,结果显示,DHA组、L-OHP组以及DHA、 L-OHP联合组作用HCT116细胞24h后,DHA、L-OHP 联合组的Caspase-3 活性显著提高,与DHA组和L-OHP组比较有统计学意义P<0.01。DHA组、L-OHP 组以及DHA、L-OHP 联合组作用HCT116细胞24 h后Caspase-8显著提高,与DHA组及L-OHP组比较DHA、L-OHP联合组caspase-8显著提高与L-OHP组比较P<0.05,与DHA组比较P<0.01(见图3)。

图1 DHA 与L-OHP联合对HCT116细胞凋亡的影响Fig.1 Effect of DHA combined with L-OHP on apoptosis of HCT116 cells注:与DHA组比较*P<0.05;**P<0.01,与L-OHP组比较,#P<0.05。Note:Compared with DHA group *P<0.05;**P<0.01,compared with L-OHP group, #P<0.05.
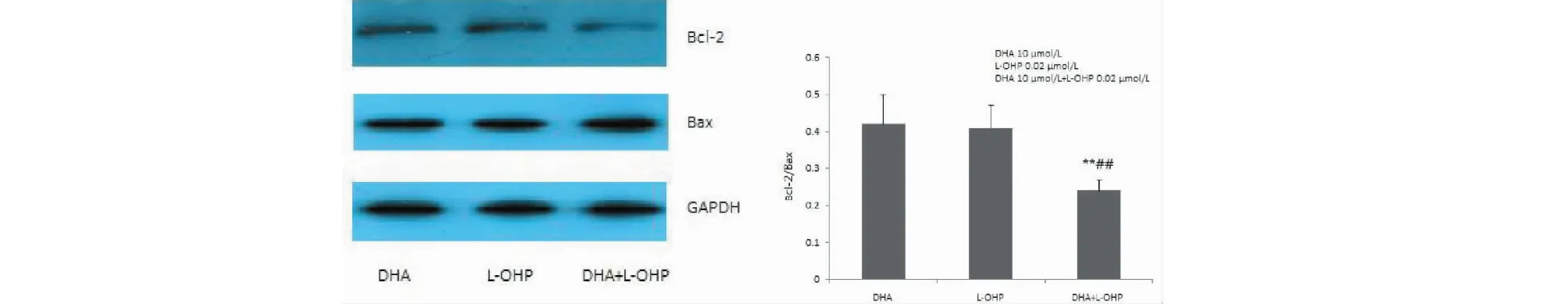
图2 DHA与L-OHP联合对HCT116细胞凋亡相关蛋白的影响Fig.2 Effect of DHA combined with L-OHP on apoptosis-related proteins in HCT116 cells注:与DHA组比较,**P<0.01;与L-OHP组比较,##P<0.01。Note:Compared with DHA group,**P<0.01;compared with L-OHP group,##P<0.01.
2.6 单细胞凝胶电泳实验
给药后进行单细胞凝胶电泳实验,结果显示,DHA组、L-OHP组以及DHA、 L-OHP联合组作用HCT116细胞后,DHA、L-OHP联合组的慧尾率显著提高,与DHA组和L-OHP组比较有统计学意义(P<0.01和P<0.05)(见图4)。
3 讨论
奥沙利铂是临床上一线的治疗结直肠癌的抗肿瘤药物,抗肿瘤作用显著,但奥沙利铂长时间大量使用会产生肾毒性、耳毒性、神经毒性等毒副反应,肿瘤细胞对奥沙利铂的耐药性产生降低了奥沙利铂的疗效,是目前肿瘤化疗失败的重要原因[6]。因此利用毒性较低的具备抗肿瘤活性的化合物使化疗药物增敏从而减少化疗药物用量是一种提高抗肿瘤药物化疗作用降低毒性的重要方法。青蒿素类药物毒性小对包括结肠癌在内的多种肿瘤有效,有研究报道其甚至可以逆转结肠癌的耐药[7,8],因此本研究将双氢青蒿素与奥沙利铂联用观察其对结肠癌细胞HCT116的抑制作用,计算药物联用是否有协同效应,对其凋亡及相关蛋白进行研究,为青蒿素类药物进入抗肿瘤的临床治疗提供依据。
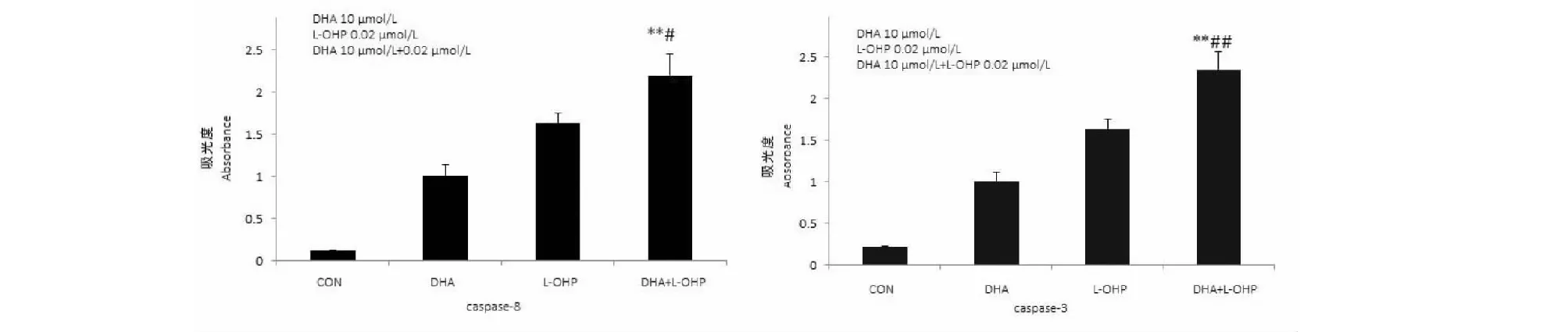
图3 DHA与L-OHP联合用药对HCT116细胞凋亡相关蛋白活性的影响Fig.3 The effects of DHA and L-OHP on activity of apoptosis-related proteins注:检测caspase-3活性,与DHA组比较,**P<0.01;与L-OHP组比较,##P<0.01;检测caspase-8活性,与DHA组比较,**P<0.01;与L-OHP组比较,#P<0.05。Note:Detection of caspase-3 activity,compared with DHA group,**P<0.01;compared with L-OHP group,##P<0.01;detection of caspase-8 activity,compared with DHA group,**P<0.01;and Compared with L-OHP group,#P<0.05.
图4 DHA与L-OHP联合用药对HCT116细胞DNA损伤的影响Fig.4 The effects of DNA damage on DHA and L-OHP注:与DHA组比较,**P<0.01;与L-OHP组比较,#P<0.05。 Note:Compared with DHA group,**P<0.01;compared with L-OHP group,#P<0.05.
L-OHP与DHA单独和联合使用对HCT116人结肠癌细胞增殖均有抑制作用,联合用药抑制率比两药单独使用抑制率提高,应用金正均Q值法进行联合用药分析发现两药联合使用在一定浓度下发挥协同作用,而在L-OHP相对较高的浓度下只发生相加作用。DHA可诱导DNA氧化损伤,而L-OHP抗肿瘤的主要机制是与肿瘤细胞DNA形成链内、外交联,影响DNA的复制和转录[9,10]。DHA与L-OHP二者都能通过影响肿瘤细胞的DNA来发挥抗肿瘤作用,通过DNA损伤实验发现,在DHA与L-OHP联合应用后DNA损伤加重,影响肿瘤细胞的增殖,甚至可能进一步引起细胞凋亡。
观察DHA与L-OHP联合应用对HCT116细胞凋亡作用发现,与单药组比较两药联合应用凋亡率显著提高,有研究显示DHA能促进肿瘤细胞凋亡并对多种肿瘤有杀伤作用[11,12],研究表明DHA与顺铂联用可提高抗肿瘤细胞的作用[13],L-OHP也可引起多种肿瘤细胞凋亡,并且可通过Fas/FasL和caspase-8诱导细胞凋亡[14,15]。凋亡是多基因多因素相互之间影响和调控的结果。Bcl-2 基因是重要的凋亡抑制基因,Bcl-2 /Bax比值决定细胞是否进入凋亡状态,若Bax越高,Bcl-2就被抑制,细胞凋亡被诱导,反过来Bax受抑,细胞得以生存[16]。研究显示两药联用Bcl-2 /Bax显著降低,诱发凋亡,Bax 是Bcl-2家族成员,其可通过活化Caspases促进凋亡。Caspases 是凋亡信号转导的共同通路,其中Caspase-3是核心效应器,负责对凋亡途径最后执行阶段的全部或部分关键性蛋白的酶切,可引发瀑布式激活下游的Caspase 蛋白酶家族,最终诱导细胞凋亡[6],本研究结果显示两药联合应用可显著提高Caspase-3的活性,同时也提高Caspase-8的活性,从而诱导HCT116细胞的凋亡。
综上所述,本研究发现双氢青蒿素及奥沙利铂可抑制HCT116结肠癌细胞的增殖作用,二者联用在一定浓度下可对HCT116结肠癌细胞发挥协同作用,显著提高抑制率。同时可通过下调Bcl-2/Bax表达比值,激活Caspase-3、Caspase-8的活性,促进HCT116结肠癌细胞凋亡。两药联合可促进DNA损伤加重,抑制肿瘤细胞生长,其协同作用发生的具体靶点和机制,有待进一步研究。
