解淀粉芽孢杆菌HN固体菌剂发酵制备技术研究
2018-12-27张峰峰谢凤行赵玉洁
张峰峰,周 可,谢凤行,赵 琼,赵玉洁
(天津市农业生物技术研究中心,天津 300192)
解淀粉芽孢杆菌(Bacillus amyloliquefaciens)及其代谢产物具有丰富的生物学活性和广泛的抗致病菌功能,对金黄色葡萄球菌、大肠杆菌、鲍曼不动杆菌(Boottanun 等,2017)、黄曲霉(Wang等,2015)等均具有较强的抑制作用,在种植业中不仅可以促进植物生长,还可防治黄瓜枯萎病(Shao等,2015)、葡萄霜霉病(Guo 等,2017)等,在养殖业不仅可以作为饲料添加剂提高养殖生物生产性能(Ahmed等,2014),还可抑制消化道内有害微生物,改善动物肠道健康(Selim等,2015),改善免疫功能,提高抗病能力(Reda 等,2015),另外,该菌株还可净化养殖环境,防治水体富营养化,抑制蓝藻水华(Yu 等,2015;李超等,2011),具有广阔的应用前景。
本实验室从天津市西青区污染河沟污泥分离鉴定了一株解淀粉芽孢杆菌HN(Bacillus amyloliquefaciens HN),研究发现其在不同污染水体中对硝酸盐氮、亚硝酸盐氮以及化学需氧量(COD)等均有很好的去除效果 (Xie等,2013;谢凤行等,2012),环境耐受能力强,在较宽的温度、pH及盐浓度的范围内都能正常生长(谢凤行等,2013),且其产胞外淀粉酶和蛋白酶能力均较强(谢凤行等,2010、2009)。
为了中试生产需要对该菌株进行液体发酵培养基和培养条件的优化,液体发酵活菌浓度最高可达41.7×108cfu/mL(谢凤行等,2013)。然而液体发酵技术,对设备要求高,生产工艺复杂,成本高,菌数低,易污染;而固体发酵采用的原料一般是廉价的农副产品(如豆粕、麸皮等),产用的设备也较液体发酵简单,无需处理大量污水,发酵产品经烘干粉碎不需其他加工处理即可得到固体菌剂,生产成本大大低于液体发酵(杜英,2013),且固体发酵产品菌数、芽孢数(王卉等,2016;杨柳等,2013)和部分代谢产物含量(Prajapati等,2015;Zhu 等,2013)均高于液体发酵产品,使用效果更好,且固体发酵产品干燥后更易于长距离运输,有利于菌剂更大范围的推广和应用。为此,本研究对解淀粉芽孢杆菌HN固体发酵培养基配方和发酵条件进行试验,以提高固体发酵产物活菌数,为生产上进行规模固体发酵高浓度菌剂提供技术支撑。
1 材料和方法
1.1 材料 供试菌种解淀粉芽孢杆菌HN(B.amyloliquefaciens HN)分离自天津市西青区某污染河沟污泥,由中国农业微生物菌种保藏管理中心进行鉴定,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号CGMCC No.3261。
1.2 试验方法 种子液制备:种子液的制备将30℃恒温培养箱中培养24 h的斜面菌株接一环放入种子培养液中,置于30℃、150r/min下振荡培养24h,制成含菌量为1.0×109cfu/mL的种子液。液体培养基成分为可溶性淀粉10g,蛋白胨10g,NaCl 3g,K2HPO41g,MgSO4·7H2O0.5g,CaCO31g,水1000mL。
固体发酵方法:每1000 mL直筒塑料瓶中装100 g固体物料(以麸皮计)培养基,用封口膜封口,121℃灭菌20 min,冷却至室温,接入种子液,混匀后于25~30℃恒温培养箱中静置培养,间时拍打,使其均匀生长,培养48 h。称取10 g固体发酵物,90 mL无菌水稀释后,150 r/min下振荡30 min,涂板进行菌落计数,重复3次。各因素在前一因素的最佳水平下逐级优化。
1.3 试验设计
1.3.1 培养基物料对固体发酵的影响 选取价格低廉的工农业废弃物麸皮、玉米粉、豆粕、大豆粉等制备基质,对菌株进行固体发酵,121℃灭菌30 min,冷却后接入HN种子液,30℃ 培养48 h。涂板计数。
1.3.2 外加碳源、氮源、无机盐对固体发酵的影响 为研究外加碳源对固体发酵的影响分别向固态基质中添加0.2%的可溶性淀粉、乳糖、麦芽糖、葡萄糖和蔗糖;为研究外加氮源对固体发酵的影响分别向固态基质中添加0.2%的蛋白胨、胰蛋白胨和酵母浸粉;为研究外加无机盐对固体发酵的影响分别向固态基质中添加0.02%的NaH2PO4·2H2O,KH2PO4、MnSO4·H2O、MgSO4·7H2O 和 FeSO4·7H2O,发酵条件按照30℃培养48 h,菌落计数,重复3次。将不添加任何外加物质作为空白对照,根据外源物质的单因素筛选结果,选择对固体发酵水平影响较大的可溶性淀粉、 蛋白胨、KH2PO4、MgSO4·7H2O设计4因素3水平正交试验。
1.3.3 料水质量比对固体发酵的影响 料水优化试验调节培养基料水(水量包括接种的20 mL菌液) 质量比为 1∶2、1∶1.5、1∶1.2、1∶1、1∶0.8、1∶0.6、1∶0.4、1∶0.2。
1.3.4 接种量对固体发酵的影响 接种量优化试验按照5%、10%、15%、20%和25%的接种量接种HN菌悬液;搅拌均匀,30℃培养48 h,菌落计数,重复3次。
1.3.5 温度对固体发酵的影响 温度优化试验将发酵温度设置为 20、25、28、33、37 ℃, 培养 48 h,菌落计数,重复3次。
1.3.6 最佳培养条件下的生长曲线 时间优化试验分别将固体发酵物培养 0、6、12、18、24、30、36、42、48 h和 54 h,菌落计数,重复 3次。
1.3.7 干燥方法对菌剂菌数的影响 使用不同的干燥温度和干燥方法,测定固体菌剂含水量和活菌浓度变化。
1.3.8 固体菌剂的激活试验 加入无菌水对菌剂进行二次发酵,测定活菌浓度。
1.4 数据分析 试验结果用“平均数±标准差”表示,运用软件SPSS 19.0,经 One-way ANOVA分析,采用Duncan’s多重检验分析试验结果的差异显著性,P<0.05为差异显著。
2 结果与分析
2.1 不同培养基物料对HN固体发酵菌数的影响在固体发酵过程中,固体底物具有双重功能,一方面底物可为微生物生长繁殖提供营养物质,另一方面是提供微生物的黏附的功能。固体底物的资源存量、价格和保存时间等是影响其选择为固体发酵底物的关键因素,本试验对HN菌数影响结果见图1。随着发酵物料的不同,各个处理固体发酵的菌数不同,其中以麸皮为底物的处理菌数最高,为 2.94×1010cfu/g,显著高于其他处理(P < 0.05)。可能是麸皮物料比较膨松,在HN的生长过程中可提供适宜的好氧环境,同时可能该菌能够较容易地破碎麸皮,并利用麸皮中的营养物质进行繁殖,在以后的试验中选取麸皮作为固体发酵底物。
2.2 外源添加物质对HN固体发酵菌数的影响

图1 不同固体物料对HN固体发酵菌数的影响
2.2.1 碳氮源对HN固体发酵菌数的影响 碳源或氮源对菌数的影响见图2。结果表明淀粉、乳糖、蔗糖等碳源的添加处理和对照未添加碳氮源相比,固体发酵菌数有显著的提高(P<0.05),而添加葡萄糖处理的菌数和对照无显著差异(P>0.05),而添加麦芽糖处理的菌数显著低于对照(P<0.05)。考虑到添加碳源物质的成本、溶解性和保存的特点,试验最终选择淀粉作为发酵培养基的碳源。选择的三种氮源添加处理和对照相比,添加蛋白胨和胰蛋白胨的处理菌数显著高于对照(P<0.05),而酵母浸粉和对照相比,无显著差异(P>0.05),而蛋白胨具有购买方便、价格较低、容易保存等特点,因此选择其作为发酵培养基的基本氮源。

图2 不同碳氮源添加对HN固体发酵菌数的影响
2.2.2 无机盐对HN固体发酵菌数的影响 无机盐对菌数的影响见图3。与对照相比,添加KH2PO4、MgSO4·7H2O的处理菌数显著增加 (P<0.05),说明这两种无机盐对菌体生长具有较好的促进作用,而添加 FeSO4·7H2O、NaH2PO4·2H2O两种无机盐处理的菌数和对照相比无显著差异(P > 0.05),而添加 MnSO4·H2O 处理的菌数显著低于对照,说明MnSO4对菌体的生长有显著的抑制作用。因此,在HN固体发酵过程中选择KH2PO4、MgSO4·7H2O 作为缓冲物和金属盐用于固体发酵。

图3 不同无机盐对HN固体发酵菌数的影响
2.2.3 外源物质对HN固体发酵影响的正交试验 由极差分析(表1)可知,影响HN固体发酵的主次因素为可溶性淀粉>蛋白胨>KH2PO4>Mg-SO4·7H2O。最佳水平组合为A2B2C3D3。因此,固体发酵最优外源物质组成为可溶性淀粉、蛋白胨、KH2PO4和MgSO4·7H2O,添加量分别为固体物料的0.2%、0.2%、0.1%、0.03%。由表2可知,可溶性淀粉对菌数的影响达到显著水平 (P<0.05),在固体发酵过程中应严格控制可溶性淀粉的使用量,而其他因素影响未达到显著水平(P > 0.05)。
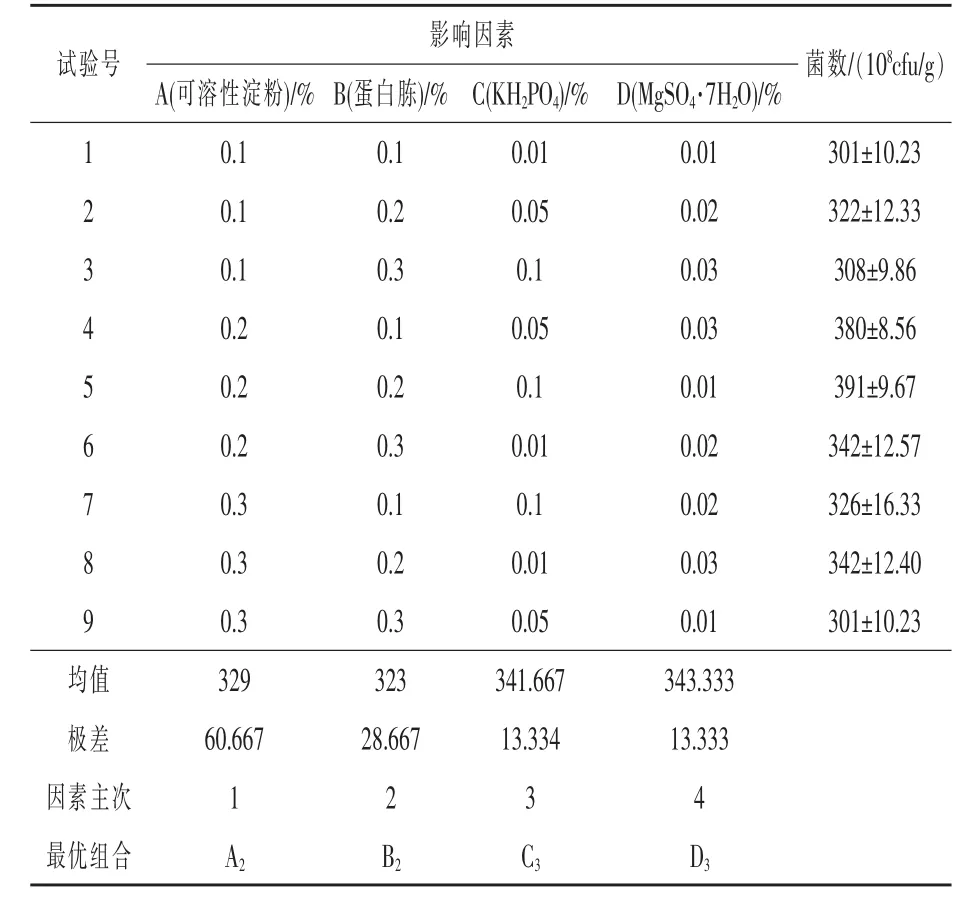
表1 固体发酵培养基外源物质组分正交试验结果
2.3 不同料水比对HN固体发酵菌数的影响本试验结果表明(图4),随着水分含量逐渐减小,菌数出现先升高后降低的趋势,在料水比为1∶0.8的条件下,菌数最高,为3×1010cfu/g,显著高于其他处理(P<0.05),说明培养基中的水分含量对固

表2 固体发酵培养基外源物质组分正交试验结果方差分析
体发酵菌数的影响特别明显,而料水比1∶0.8的处理下,菌株的通气和营养物质的转化达到最佳平衡,既可使固态基质保持疏松,充分利用氧气的流通和热量的传递;又可为微生物生长提供营养,繁殖产生大量菌体。因此,试验选择料水比1∶0.8的处理进行固体发酵。

图4 不同料水比对HN固体发酵菌数的影响
2.4 不同接种量对HN固体发酵菌数的影响由图5可知,本试验中HN菌落数随接种量的增加呈先升高后降低的趋势,接种量为20%时,HN菌落数达到最大值。

图5 不同接种量对HN固体发酵菌数的影响
2.5 不同培养温度对HN固体发酵菌数的影响由图6可知,该菌株在20~37℃均能生长。当温度为28℃时,固体发酵菌数最多,为3.69×1010cfu/g,显著高于其他温度发酵物含菌量 (P< 0.05),说明28℃为该菌最适宜的固体发酵温度。

图6 不同温度对HN固体发酵菌数的影响
2.6 HN在最优条件下的生长曲线 在最优培养基和最优条件下,菌株HN在18 h进入对数生长期,在 48 h 达到最大值 3.99×1010cfu/g(图 7)。菌株HN主要通过菌体细胞繁殖消耗水体中的有害物质从而达到净化水质的目的,因此,HN的固体发酵周期控制在48 h内较为合理。
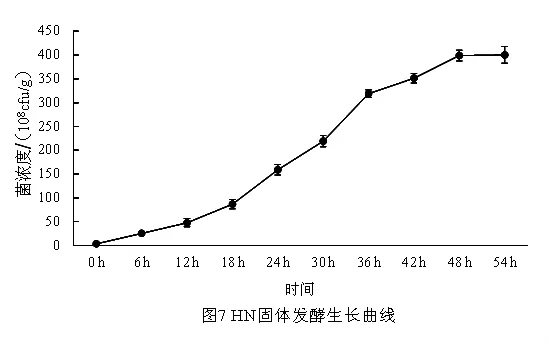
图7 HN固体发酵生长曲线
2.7 不同干燥方法对固体菌剂含水量及活菌数的影响 由于芽孢杆菌具有较好的耐热性能,所以,选择50℃和60℃烘干以及室温风干三种干燥方式,测定不同干燥方式下菌剂含水量和菌浓度的变化。从表3可以看出,采用不同干燥方式,固体菌剂的含水量变化不同,其中在50℃和60℃烘干的条件下,菌剂含水量在24 h内均降低至8%以下,而风干方式下固体菌剂含水量60 h后降低至9%以下。说明在烘干条件下干燥菌剂较自然风干条件下干燥菌剂的效率较高,可提高1倍以上。不同方式的干燥过程中菌数均有显著的降低趋势,到最终干燥结束(即含水量低于9%),测定在50℃和60℃烘干的条件下,活菌浓度分别为 24.35×108cfu/g 和 30.24×108cfu/g,而在自然风干条件下,活菌浓度为49.67×108cfu/g,均显著低于初始浓度3.8×1010cfu/g。说明干燥过程中由于水分的蒸发使活菌数减少较多,且烘干处理的活菌数显著低于自然风干处理的活菌数 (P<0.05)。对不同干燥方式测定的含水量和菌数进行相关性分析发现,各个处理的含水量和菌数的相关性均达到极显著相关(P<0.01),说明菌剂的活菌数受菌剂中含水量影响较大,在以后的菌剂生产和使用中要重点考虑水分对菌数的影响。对比三种干燥方法,如果考虑生产效率,则采用烘干的方法,要考虑菌数含量,则采取自然风干的方法。

表3 干燥方式对HN固体发酵物含水量和活菌数的影响
2.8 固体菌剂的激活试验 由于干燥后活菌数显著降低,后期使用过程中如何提高活菌数成为需要解决的问题。取干燥后的菌剂,按照1∶0.8的料水比例,加入无菌水,28℃培养,进行激活发酵,定时进行活菌数测定发现(图8),菌剂的活菌数逐渐增加,在发酵48 h后,菌剂的活菌数达到3.72×1010cfu/g,和固体发酵菌剂干燥前水平相当,在以后的实际应用中,可以指导用户加入干净水进行二次发酵激活菌剂,从而提高菌剂的菌数,增强使用效果。
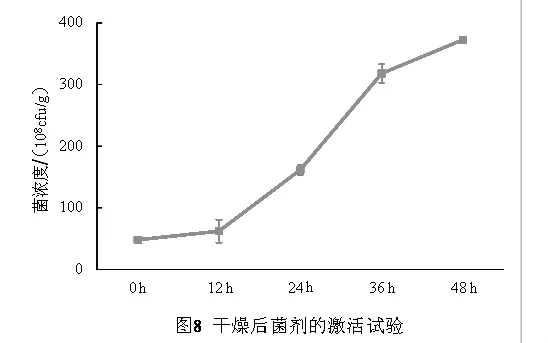
图8 干燥后菌剂的激活试验
3 讨论
在固体发酵过程中,固体发酵基质是主要的影响因素。王卉等(2016)则采用花生饼粉∶麸皮∶棉籽粕=53∶35∶12(m∶m∶m)作为基质进行解淀粉芽孢杆菌的固体发酵,最终活菌数最高为2.13×1010cfu/g;杨柳等(2013)研究结果也表明麸皮和豆粕为芽孢杆菌最适发酵基质,该发酵基质被分解后不易结块,孔隙率和通气性较好,有利于菌株的生长繁殖。秦宇轩等(2017)选择麸皮和豆粕的碳氮比为1∶2.8基础上添加20%的稻谷壳,稻谷壳坚硬的外壳能够对固态基质起到有效的支撑作用,以此来增加固态基质中空气的流动性,从而促进解淀粉芽孢杆菌的生长,菌数达1.68×1010cfu/g。本研究通过比较不同发酵基质发现麸皮为最佳的发酵基质,菌数可达 2.94×1010cfu/g。
固体发酵物中的碳源和氮源是影响微生物生长繁殖和产生次级代谢产物的另一个重要因素。一般常用的外加碳源有葡萄糖、淀粉、蔗糖、麦芽糖和甘油等。外加氮源主要有蛋白胨、豆粉、硫酸铵、硝酸铵和酵母浸粉等。碳氮源质量比也非常重要,若碳源过多,菌株可能生长缓慢,易被杂菌污染而失效;氮源过多,微生物就会大量繁殖,不利于次级代谢产物的累积。本试验最终采用可溶性淀粉作为外加碳源,蛋白胨作为外加氮源,最适浓度均为0.2%。无机离子在固体发酵过程中也起到重要作用,其能够调节固体发酵基质的酸碱平衡、维持渗透压、构成如蛋白质等活性物质的辅基或功能团等,本试验结果表明,KH2PO4、MgSO4·7H2O能够显著增加菌落总数,有研究证明MgSO4·7H2O可促进芽孢杆菌生长繁殖,增加酶类等物质的分泌活性(Vimala 等,2015)。
料水质量比主要通过影响固体发酵过程中的供氧量和孔隙度来决定固体发酵的水平,是决定固体发酵能否成功的重要因素(梁雪杰等,2013)。高料水质量比时固态培养基水分含量过少,会影响溶氧能力和传递氧能力,从而限制菌落的生长;低料水质量比可使固态培养基凝结成块,导致多孔性、溶氧量和散热性降低而影响发酵水平,增加杂菌污染的机率和干燥成本。本试验料水质量比最终采用1∶0.8,一方面可使固态基质保持疏松,充分利用氧气的流通和热量的传递;另一方面可为微生物生长提供营养。
固体发酵通常采用菌悬液作为种子培养基,以液固2相的发酵方式进行,需要合适的接种量。本试验经过优化选取20%的接种量,因为接种量较小会延长发酵周期,成本增大,且会增加杂菌污染机率,影响发酵产品质量(梁雪杰等,2013);接种量过大会加速固体发酵培养基的消耗,使基质中溶氧不足或营养物质过度消耗,不利于菌落数的增加,且菌株产生的次级代谢物会抑制菌落的繁殖,降低菌株固体发酵的数量(孙镇平等,2014)。
固体发酵的培养温度是影响菌体生长的重要环境条件,在液体发酵培养条件优化过程中发现HN的最适生长温度为37℃(谢凤行等,2013)。本试验结果表明,HN的最适发酵温度为28℃,究其原因,可能是固体发酵过程中散热较液体发酵慢,菌体自身发酵产生热量可促进菌体的生长,如果固体发酵环境温度过高,则会影响菌体的生长。
固体发酵的时间一般是3~7 d,发酵时间对微生物繁殖有着重要的影响。发酵周期短,基质营养利用不充分,造成浪费;周期过长,菌体自溶,影响活力,本试验发现HN固体发酵48 h菌数达到最高值,而后再继续发酵导致固体培养基中氨化严重,物料变黑,气味刺鼻,严重影响了菌剂的品质。
本研究通过优化解淀粉芽孢杆菌HN的固体培养基和培养条件,确定了最佳固体培养基质为麸皮;外源物最优添加量(百分比按固态基质质量为基准)为可溶性淀粉0.2%,蛋白胨0.2%,KH2PO40.1%,MgSO4·7H2O 0.03%,温度 28 ℃,料水比为1∶0.8,进行 48 h的发酵,解淀粉芽孢杆菌的菌数可达3.99×1010cfu/g以上。
固体发酵后菌剂的干燥过程也是菌剂生产中最重要的环节,发酵产品菌数较高,干燥效果直接关系最后菌剂的使用效果。其中菌剂的水分含量是首要的测定指标,过高则达不到产品要求,菌剂易发生霉变,过低则导致菌剂活菌数过低,影响使用效果。参考NYT 2131-2012《饲料添加剂 枯草芽孢杆菌》菌剂标准,水分含量达到9%以下方为合格菌剂,因此,本研究采用三种干燥方法对菌剂的水分进行去除,在测定含水量使其达到标准的同时测定菌剂中的活菌数,结果表明,随着含水量的减少,菌剂活菌数也相应减少。最终在含水量达到9%以下时活菌数减少80%以上。其中,自然风干处理的活菌数显著高于烘干两个处理的活菌数,但烘干处理对水分的蒸发效率显著高于自然风干处理。在以后的规模生产中,要考虑生产效率和活菌含量平衡的同时,降低成本,寻找出一个更可靠的干燥方法。
二次发酵激活是很多固体菌剂使用过程中遇到的问题,由于芽孢杆菌芽孢的休眠特性,在菌剂使用前,进行适当的激活发酵,可以提高活菌数,降低芽孢休眠对使用效果的影响,从本研究中二次发酵效果表明,激活对菌剂活菌数的提升具有显著的效果,在以后的实际应用中应适当的推广应用。
本研究均为实验室内控制条件下进行的小规模发酵试验,和生产中的规模发酵效果可能会有所差异(Zhu等,2014),因此本研究仅为大规模生产的固体发酵条件提供了基础参考,还需进一步的进行规模验证。
