星点设计-效应面法优化鹿角多肽酶解工艺
2018-12-20王平张会敏李刚孙铁锋秦文刘凡杰
王平,张会敏,李刚,孙铁锋,秦文,刘凡杰
(1.天津大学精密测试技术及仪器国家重点实验室,天津 300072;2.山东省中医药研究院,山东 济南 250014;3.山东大学校医院,山东 济南 250012;4.山东省医药生物技术研究中心,山东 济南 250062)
鹿角胶是一种名贵中药材,始载于《神农本草经》,列为上品,称之为白胶[1],具有补血、益精等功效。鹿角胶作为鹿角的主要提取物,药用已近两千年,《本草图经》记载“鹿,年岁久者,其角坚好,煮以为胶,入药弥佳”[2]。鹿角胶中含有丰富的蛋白质,高达82.49%[3],临床疗效十分显著。但由于其蛋白质分子量较大,严重降低了鹿角胶的利用率[4-5]。因此,急需提高鹿角胶的生物利用度,以便充分开发利用名贵中药资源,更好地为人类健康服务。
由于多肽结构比蛋白质简单,易被吸收且具低过敏性,被广泛应用在临床上,并为机体提供营养。近年来,多肽的生理功能愈来愈受到重视[6-7]。鹿角多肽是从鹿角中分离得到的一类分子量在0.2~10 kDa之间的具有生物活性的多肽[8]。鹿茸、鹿角分别是梅花鹿或马鹿鹿角的未骨化的幼角、已骨化的角或角基,是不同生长期的鹿角。与大量文献报道的鹿茸多肽相关研究[8-10]相比,对鹿角多肽的文献报道尚不多见,且已有文献多以水解度、多肽得率评价鹿茸多肽的制备工艺。本文在前期研究的基础上[11],以酶用量、底物浓度、温度为自变量,多肽含量及峰面积总和为因变量进行星点设计试验,建立了一个可行、科学的制备方法,为鹿角多肽的深度研发提供技术支撑。
1 材料
ZX-002紫外分光光度计(日本岛津公司);Waters 2965高效液相色谱仪(美国Waters 公司);KDM型控温电热套(鄄城华鲁电热仪器有限公司);BP211D赛多利斯电子分析天平(德国SARTORIUS公司);HHS6数显恒温水浴锅(金坛市医疗仪器厂);LGJ-10冷冻干燥机(盛超科创(北京)生物科技有限公司);-80 ℃冰箱(美国FOMAS公司)。
鹿角胶是由鹿角片经水煎煮、浓缩制成的固体胶,鹿角片(批号:150470,河北亚宝药业有限公司)经山东省中医药研究院中药资源研究室鉴定为马鹿正品,制法和鉴别按照2015年版中国药典“鹿角胶”[1]项下进行。胃蛋白酶(批号:O1202A,美仑生物);细胞色素C(Mr12500)、抑酞酶(Mr6500)、杆菌酶(Mr1450)、乙氨酸-乙氨酸-酪氨酸-精氨酸(Mr451)、乙氨酸-乙氨酸-乙氨酸(Mr189);结晶牛血清清蛋白(BSA,纯度为98%)、硫酸铜(CuSO4·5H2O)、酒石酸钾钠(KNaC4H4O6·4H2O)、10% NaOH溶液、无水醋酸钠、冰乙酸、乙腈、甲醇等。
2 方法与结果
2.1 鹿角多肽的制备
称取适量的鹿角胶粉末、胃蛋白酶,置于50 mL三角瓶中,加乙酸和乙酸钠缓冲溶液调节至要求的pH,超声震荡溶解后,置于恒温水浴锅中,调至酶解温度进行酶解;酶解结束后,直接加热至95 ℃灭活,保持5 min,8 000 r/min离心10 min,分离上清液即得鹿角多肽酶解液。
2.2 HPLC法检测鹿角多肽含量
2.2.1 对照品配制
精密称取细胞色素C、抑酞酶、杆菌酶、乙氨酸-乙氨酸-酪氨酸-精氨酸、乙氨酸-乙氨酸-乙氨酸适量,用流动相配置成质量分数0.1%的不同相对分子量的肽标准品溶液,备用。
2.2.2 样品制备
取200 μL鹿角多肽酶解液,加纯净水稀释至2 mL,混合均匀,用微孔滤膜过滤(0.2 ~0.5 μm聚四氟乙烯或尼龙过滤膜),即得鹿角多肽待测样品。
2.2.3 色谱条件

2.2.4 方法学考察
对混合对照品分别进行了精密度(进样6针)、重复性(混合对照品6份)、稳定性试验(0、2、4、6、12、24 h),测定峰面积,相对标准偏差均小于3%,说明系统适应性良好。
2.2.5 样品的检测与分析
将样品的色谱图与标准曲线中5种标准物质(细胞色素C、抑酞酶、杆菌酶、乙氨酸-乙氨酸-酪氨酸-精氨酸、乙氨酸-乙氨酸-乙氨酸)进行出峰时间对比分析,见图1。然后用GPC数据处理软件,将样品的色谱数据代入校正曲线方程中进行计算,即可得到样品中肽的相对分子质量及其分布范围。用峰面积归一化法计算鹿角多肽相对峰面积百分比之和。

1 细胞色素C;2 抑酞酶;3 杆菌酶;4 乙氨酸-乙氨酸-酪氨酸-精氨酸;5 乙氨酸-乙氨酸-乙氨酸图1 鹿角多肽HPLC图谱Fig.1 HPLC chromatogram of Antlers polypeptide
2.3 双缩脲法测定鹿角多肽含量
2.3.1 标准品制备
取标准的结晶牛血清白蛋白(BSA,纯度为98%),用H2O 配制成10.8 mg/mL的标准蛋白溶液。
2.3.2 双缩脲试剂配制
称取1.50 g硫酸铜(CuSO4·5H2O)和6.0 g酒石酸钾钠(KNaC4H4O6·4H2O),用500 mL水溶解,在搅拌下加入300 mL 10% NaOH溶液,用水稀释到1 000 mL,配制成双缩脲试剂。
2.3.3 标准曲线的绘制
取12支试管分两组,分别加入0、0.2、0.4、0.6、0.8、1.0 mL的标准蛋白质溶液,用水补足到1 mL,然后加入4 mL双缩脲试剂,充分摇匀后,在室温(20~25 ℃)下放置30 min,于540 nm处进行比色测定,以浓度为横坐标,以吸光度为纵坐标,制得标准曲线为:y=0.247 2x+0.016 5,R2=0.995 8。
2.3.4 样品含量测定
取鹿角多肽酶解液适量,用同样的方法测定,每个样品平行3次。根据标准曲线,计算得出鹿角多肽含量。
2.4 单因素考察
2.4.1 底物浓度的影响
配置底物浓度分别为0.01、0.03、0.05、0.07、0.09 mg/mL(鹿角胶粉末/溶液体积),酶用量为2.5%,设置酶解时间为6 h,pH 3.5,酶解温度为40 ℃,酶解。随着底物浓度的提高,鹿角多肽峰面积在0.08 mg/mL左右达到最高,鹿角多肽含量在0.07 mg/mL左右达到最高,当底物浓度继续升高时鹿角多肽峰面积、鹿角多肽含量反而下降(图2)。

图2 底物浓度与多肽峰面积、多肽含量关系Fig.2 Relationship between substrate concentration and polypeptide peak area and content
2.4.2 酶用量的影响
配置酶用量分别为0.5%、1.5%、2.5%、3.5%、4.5%(酶质量/鹿角胶粉末质量),设置底物浓度为0.05 mg/mL。酶解时间为6 h,pH 3.5,酶解温度为40 ℃,酶解。随着酶用量的增加,鹿角多肽峰面积、鹿角多肽含量均出现了先增加再降低,再小幅度增加降低的过程,在1.5%左右达到最高(图3)。

图3 酶用量与多肽峰面积、多肽含量关系Fig.3 Relationship between enzyme dosage and polypeptide peak area and content
2.4.3 酶解温度的影响
配置底物浓度为0.05 mg/mL,酶用量为2.5%,酶解时间6 h,pH 3.5,酶解温度分别为30、35、40、45、50 ℃,酶解。随着温度的升高,鹿角多肽峰面积先增加,并在40 ℃左右达到最高,然后降低后继续增加(见图4);鹿角多肽含量在45 ℃左右达到最高,然后略微降低。

图4 温度与多肽峰面积、多肽含量关系Fig.4 Relationship between temperature and polypeptide peak area and content
2.4.4 pH 的影响
由于胃蛋白酶在pH 5.0时失活,因此,本文选择pH 4.5为考察的最大值。配置底物浓度为0.05 mg/mL,酶用量为2.5%,酶解时间为6 h,酶解温度为40 ℃,pH分别为2.5、3、3.5、4、4.5,酶解。在pH 2.5~3时,鹿角多肽峰面积没有数据;pH 4.5时,多肽面积最大;鹿角多肽含量在pH 2.5~4.5区间逐渐增大。因此选用pH 4.5为最佳pH(图5)。

图5 pH与多肽峰面积、多肽含量关系Fig.5 Relationship between pH and polypeptide peak area and content
2.4.5 酶解时间的影响
配置底物浓度为0.05 mg/mL,酶用量为2.5%,酶解温度为40 ℃,pH 3.5,酶解时间分别为4、5、6、7、8 h,酶解。随着时间的增加,多肽峰面积、鹿角多肽含量逐渐增加,7 h后增加缓慢。因此选用7 h作为酶解时间(图6)。
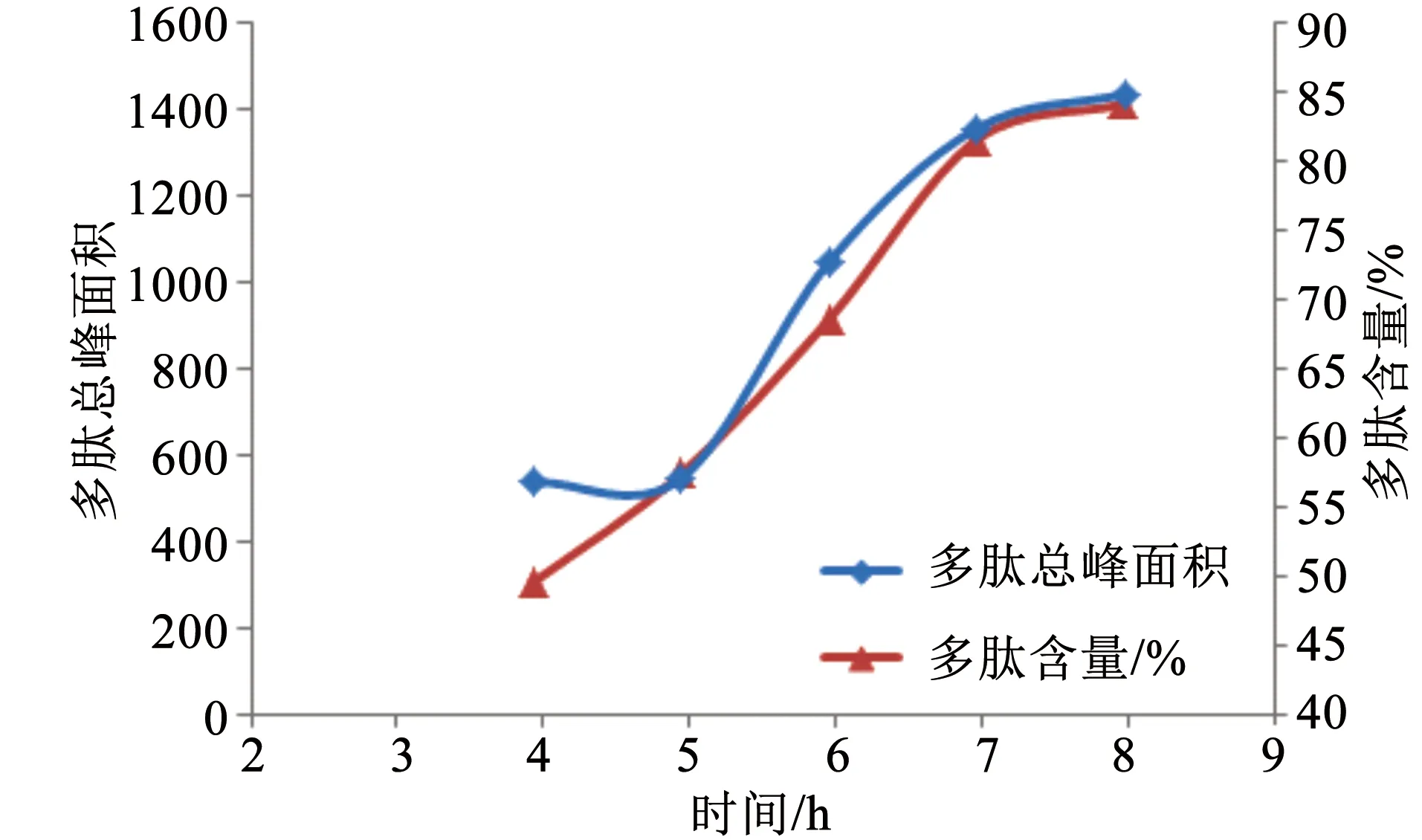
图6 时间与多肽峰面积、多肽含量关系Fig.6 Relationship between time and polypeptide peak area and content
2.5 星点设计-效应面法优化制备鹿角多肽
2.5.1 因素与水平的确定
采用单因素考察法对鹿角多肽峰面积影响因素进行初步考察,发现酶用量、底物浓度及温度是最主要的影响因素。因此确定酶用量、底物浓度、温度为考察因素,3个自变量的取值范围为酶用量A:1.20%~4.00%,底物浓度B:0.04~0.08 mg/mL、温度C:30~50 ℃。每个因素设5个水平,试验安排及结果见表1~2。

表1 因素水平
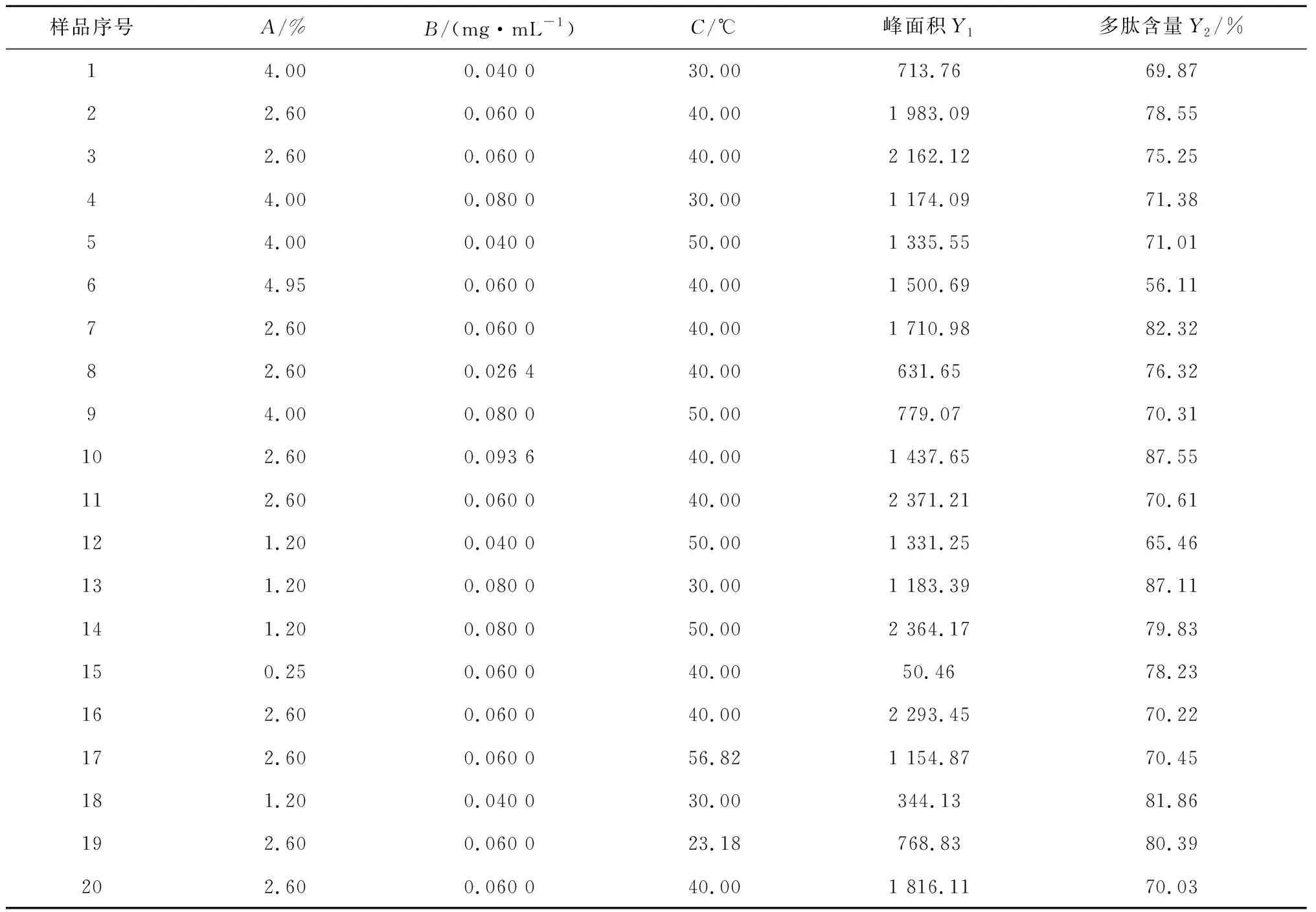
表2 星点试验设计及结果Table 2 Arrangement and results of central composite design test
2.5.2 模型拟合
采用Design expert 8.0.5软件对模型数据进行响应面试验分析,以鹿角多肽峰面积Y1和多肽含量Y2为响应值,分别对酶用量A、底物浓度B、温度C,进行多元回归拟合后,得到二项式拟合方程:
Y1= -1.33×104+2.32×103A+1.44×105B+3.57×102C-8.79×103AB-1.73×101AC-5.14×102BC-1.99×102A2-
Y2=1.25×102-2.96×10-2A-5.83×102B-1.32C-8.40×101AB+2.12×10-1AC+4.32BC-1.35A2+6.44×103B2+
2.5.3 方差分析
针对Y1来讲,模型F值为3.63,P=0.0285<0.05,表明该模型有显著性差异。失拟项值为4.9(P=0.0530>0.05),表明模型比较稳定,拟合度良好。其中A、B、C对含量面积无显著性差异(P>0.05),AB,AC,BC交互相对含量面积均无显著性差异(P>0.05),A2对含量面积有非常显著性差异(P<0.01),B2对含量面积有显著性差异(P<0.05),C2对含量面积有显著性差异(P<0.05)。
针对Y2来讲,模型F值为5.92,P=0.0051<0.05,表明该模型具有非常显著性差异。失拟项值为0.31(P=0.886 9>0.05),表明模型比较稳定,拟合度良好。其中A、B对多肽含量具有显著性差异(P<0.01或P<0.05),C对多肽含量无显著性差异(P>0.05),AB,AC,BC交互相对多肽含量均无显著性差异(P>0.05),A2、B2对多肽含量有显著性差异(P<0.05),C2对多肽含量无显著性差异(P>0.05)。详见表3

表3 星点设计方差分析
注:*P<0.05,**P<0.01,***P<0.001。
2.5.4 模型拟合
根据已确定的方程为模型,以多肽峰面积值和多肽含量为因变量,绘制效应面的三维图,见图7、8。等高线的形状可反映交互效应的强弱,椭圆形表示二因素交互作用显著,而圆形则与之相反。结果得到最佳工艺条件:酶用量A为1.78%,底物浓度B为0.08mg/mL,温度C为39.96 ℃。为了便于实际操作,最终确定的参数为酶用量1.8%,底物浓度0.08mg/mL,温度40 ℃。
2.5.5 优选工艺验证
按照酶用量为1.8%,底物浓度为0.08mg/mL,温度为40 ℃,制备3份鹿角多肽酶解液。鹿角多肽含量实际平均值为82.21%,预测值为83.69%;鹿角多肽峰面积实际平均值为1 880.87,预测值为1 916.68;计算偏差分别为1.77%、1.87%,小于2%,证明所得到的拟合方程可以较好地描述工艺中各因素与评价指标的关系,可见采用星点设计-效应面法预测得到的工艺参数准确、可靠,预测性良好。

图7 各因素对峰面积影响的响应面Fig.7 Response surface of various factors affecting peak area

图8 各因素对多肽含量影响的响应面Fig.8 Response surface of various factors affecting polypeptide content
3 讨论
本文采用前期研究已建立的HPLC法,对鹿角胶酶解液进行检测,同时以双缩脲法对鹿角胶酶解液进行多肽含量测定。由于HPLC色谱峰峰面积的大小直接反映了酶解液中鹿角多肽的相对含量,故本文选取多肽含量及峰面积总和为考察指标(因变量),以酶用量、底物浓度、温度为自变量进行评判。预测值与实测值的偏差分别为1.77%、1.87%(小于2%),表明本实验方法简便合理、稳定,可预测性良好。因此,采用星点设计-效应面法提取鹿角多肽更加科学、稳定,为进一步开展鹿角多肽分离、纯化及新药研发等工作提供了保障。
