卵泡膜细胞瘤的超声声像图表现及诊断分析
2018-12-20王冠杰曹云云龚晓萍王海飞孔晓晓王亚梅牛建梅
王冠杰 曹云云 龚晓萍 王海飞 杨 田 孔晓晓 王亚梅 牛建梅
上海交通大学医学院附属国际和平妇幼保健院超声科,上海 200230
卵巢卵泡膜细胞瘤起源于卵巢的特殊间胚叶组织,由卵泡膜细胞构成,是卵泡性索间质肿瘤中的一种,为实性肿瘤。卵泡膜细胞瘤及卵巢纤维瘤占卵巢所有肿瘤的4.1%,约占性索间质肿瘤的76.3%[1]。卵泡膜细胞瘤绝大部分是良性肿瘤,其具有雌激素分泌功能,可以产生异常的阴道出血等症状。卵泡膜细胞瘤缺乏特征性临床表现,超声诊断中卵泡膜细胞瘤易被诊为其他卵巢性索间质肿瘤,如卵巢纤维瘤等及外突性子宫肌瘤和卵巢恶性肿瘤等。对超声图像准确的判读有助于临床医生快速判断患者病情,亦有助于减轻患者的精神压力。本研究收集在上海交通大学医院附属国际和平妇幼保健院(以下简称“我院”)经手术病理证实为卵巢卵泡膜细胞瘤患者的相关资料,对其声像图表现及临床特点进行总结,以提高对该疾病的术前诊断正确率,降低误诊及漏诊率。
1 资料与方法
1.1 一般资料
选择2015年1月~2016年10月在我院经手术病理证实为卵巢卵泡膜细胞瘤的患者47例。年龄30~77岁,中位年龄55岁,30例发生在绝经后,中位绝经年龄51岁,绝经2~27年。因月经紊乱、不规则出血、绝经后出血及下腹部坠胀或疼痛就诊13例,34例因体检时超声检查发现病灶就诊。排除标准:①超声提示为卵巢来源实质性占位但手术病理证实为非卵泡膜细胞瘤的患者;②超声提示卵泡膜细胞瘤而未经手术病理证实的患者。本研究所有资料按医院伦理委员会要求进行脱敏处理。
1.2 方法
1.2.1 超声检查 采用Philips公司生产的11XE、GE公司生产的730等彩色多普勒超声仪对患者进行检查,所有患者术前均接受腹部及阴道超声常规检查,所用探头频率分别为 3.5~5.0 MHz、7.0~9.0 MHz。
1.2.2 肿瘤指标检测 采用罗氏公司Eppendorf Centrifuge 5804离心机以3000 r/min离心,获得血清;采用罗氏公司COBAS6000生化免疫分析仪检测相关肿瘤标志物。
1.3 观察指标
记录患者的年龄、是否绝经及绝经年龄、相关实验室检查资料、超声声像图特点以及手术标本病理结果。实验室检查主要记录术前肿瘤标志物指标。所有患者均在术前进行血清肿瘤标志物癌胚抗原(carcinoembryonic antigen,CEA)、血清糖类抗原 125(carbohydrate antigen 125,CA125)、血清糖类抗原 199(carbohydrate antigen 199,CA199)、血清糖类抗原 153(carbohydrate antigen 153,CA153)及甲胎蛋白(α-fetoprotein,AFP)的检测。超声检查中行多方位、多切面及多角度扫查子宫及双附件区,并记录子宫与卵巢的大小、内膜的厚度及回声情况,发现病灶记录其发生部位、大小、形态、内部及后方回声、边界、周边及内部血流信号情况,检查并记录有无盆腔及腹腔积液。
2 结果
2.1 一般临床资料
卵巢卵泡膜细胞瘤患者发生年龄30~77岁,中位年龄55岁,63.8%(30/47)发生在绝经后,中位绝经年龄 51岁,其中 30~39岁占 17.0%(8/47)、>39~49岁19.1%(9/47)、>49~59 岁 27.7.0%(13/47)、>59~69 岁31.9%(15/47)、>69~79 岁 4.3%(2/47)。其中>59~69 岁比例最高,为 95.7%(45/47)。 病灶 95.7%(45/47)发生单侧卵巢(左侧26例,右侧19例),2例发生在双侧。
术前超声诊断病灶大小 (11 mm×9 mm×8 mm)~(98 mm×93 mm×82 mm),19例伴有盆腔积液,最大深度约39 mm;无伴腹腔积液病例。患者因月经紊乱、不规则出血,绝经后出血及下腹部坠胀或疼痛就诊为13例,34例患者无明显临床症状。
患者术前血清肿瘤标志物检测中仅1例CA125测值升高(81.64 U/mL),其余患者CA125的结果均正常。
2.2 超声声像图表现
形态:88.9%(40/45)病灶形态尚规则,余形态欠规则。边界:51.1%(23/45)病灶边界欠清或不清(主要为侧方及后方边界),余病灶边界尚清晰。内部回声及后方回声衰减情况:86.7%(39/45)病灶呈低回声,其中20例后方回声出现衰减,3例内见点状强回声;4例呈混合回声,其中1例后方回声伴衰减;2例呈无回声,其中一例为多房无回声。见图1。彩色多普勒血流图(color Doppler flow imaging,CDFI)情况:37.8%(17/45)病灶周边和/或内部测及点状或条状血流信号,余病灶周边及内部均未测及明显血流信号。超声诊断结果提示,卵巢纤维瘤、子宫浆膜下肌瘤及卵巢恶性肿瘤可能共8例,2例提示囊性占位,2例提示性索间质来源肿瘤可能,3例提示卵泡膜细胞瘤可能,余30例提示实质性占位。合并子宫肌瘤24例,子宫肌腺症2例。
2.3 超声诊断的准确性
因绝经后病灶较小合并多发性肌瘤而漏诊2例,在多发肌瘤手术时发现,病灶发生在单侧卵巢(术中测值最大直径分别约3 cm,4 cm)。超声对病灶的检出率为 95.7%(45/47),定位正确率为 100.0%(45/45),误诊率为 17.8%(8/45),漏诊率为 4.3%(2/47)
2.4 病理结果
36例为单纯性卵巢卵泡膜细胞瘤,4例为卵巢卵泡膜细胞瘤伴钙化,3例为卵巢卵泡膜细胞瘤伴出血坏死,1例卵巢卵泡膜纤维瘤伴局部水样变性,2例卵巢卵泡膜细胞瘤伴黄素化,1例卵巢卵泡膜细胞瘤伴扭转。病灶中合并子宫肌瘤24例,子宫肌腺症2例,内膜息肉1例。
3 讨论
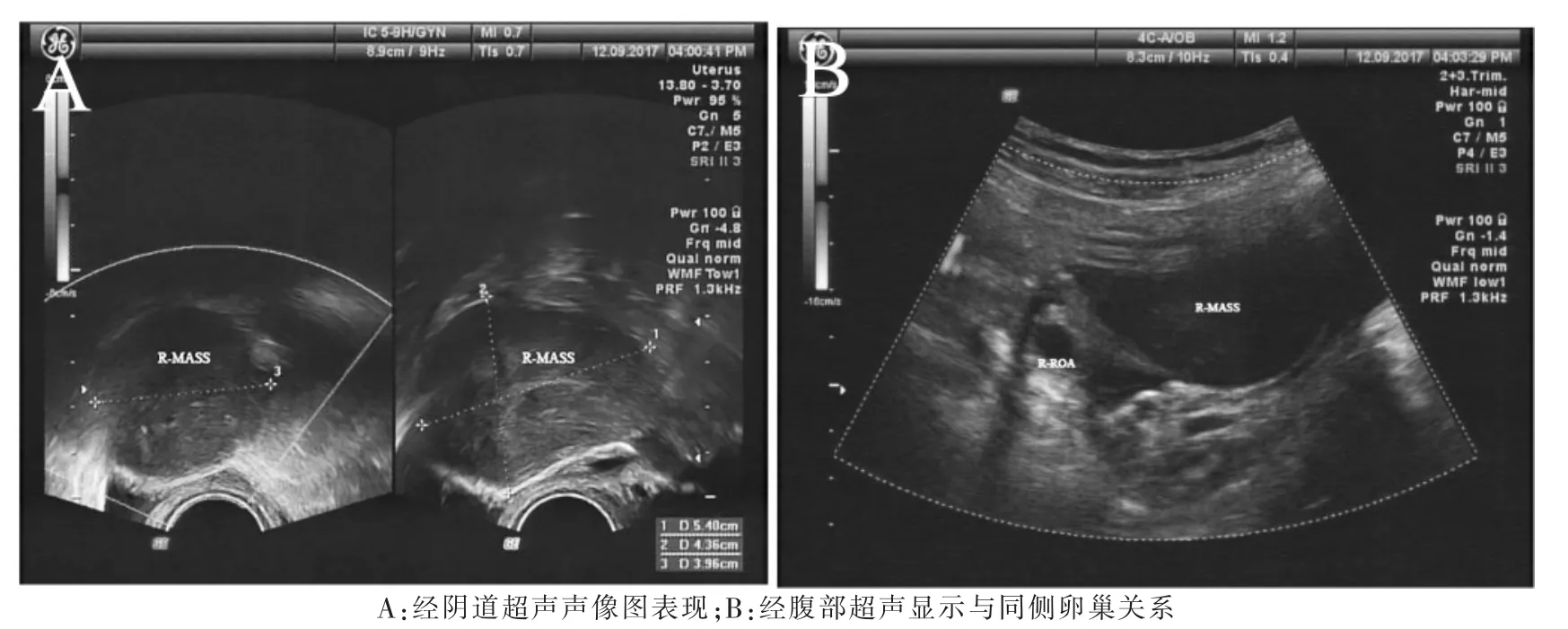
图1 单纯性卵巢卵泡膜细胞瘤超声图像
卵泡膜细胞瘤属于卵巢性索间质肿瘤,为来源于储脂的间质细胞的卵巢肿瘤,可分为典型卵泡膜细胞瘤和黄素化卵泡膜细胞瘤,主要见于40岁以上的女性,平均发病年龄为55岁,2/3以上发生在绝经后,可分泌雌激素,常伴有月经不调、乳腺增大、绝经后不规则阴道出血等症状,少数可出现男性化,以单侧受累多见,累及双侧极少[2-3]。本组患者的病灶95.7%(45/47)发生于单侧,63.8%(30/47)发生在绝经后,中位年龄55岁,其中60~69岁占比为31.9%(15/47)。有报道称大约60%的卵泡膜细胞瘤伴有阴道流血,超过20%的卵泡膜细胞瘤伴有子宫内膜癌[4],少数患者可并发胸腹水,系由瘤蒂静脉回流受阻所致,并且在手术切除肿瘤后治愈,被称为Meigs综合征[5]。本研究患者因月经紊乱、不规则出血,绝经后出血及下腹部坠胀或疼痛等症状而至医院就诊的占比为27.7%(13/47),余34例无明显临床症状,为常规健康体检时超声检查发现病灶而就诊。卵泡膜细胞瘤病理学检查主要表现为实性肿瘤,包膜完整,质地坚硬,可合并钙化等各种变性。影像学检查中主要以超声、CT以及MR为主。CT卵泡膜细胞瘤的影像学主要表现为一侧附件区均质实性肿块,界清,类圆形或椭圆形,可有浅分叶。卵巢泡膜细胞富含脂质成分,肿瘤CT值多略低于子宫。实质区多为轻度渐进性强化,少数无强化。CT对卵巢显示欠佳,特别是对绝经女性。这限制了CT在本病诊断中的应用。MRI具有较高的软组织分辨力,能清晰显示肿瘤的内部结构及周围组织的关系,并能反映组织的生物学特性。卵泡膜细胞瘤的信号改变较具特征性,与子宫肌层相比,T1WI肿瘤呈等或稍低信号。T2WI肿瘤实性部分以低信号为主,少部分成等、稍高信号,肿瘤较大时肿块内部常可见散在小片状、结节状或条状高信号。MRI检查花费大、费时等缺点限制了其广泛应用。超声检查具有耗时少、费用低、无辐射等优点,这使得其成为妇产科首选的影像学检查。因此,分析和总结卵泡膜细胞瘤的超声图像特点,以提高疾病的准确率,具有较大临床应用及经济价值。卵泡膜细胞瘤超声像图特点主要为:常为类圆形或分叶状,表面光整,可呈低回声,后方常伴有不同程度的声衰减,边界尚清或欠清,内回声可均匀或不均匀,CDFI示内部血流信号多不明显[6]。
病灶误诊分析如下:
外突性子宫肌瘤:外突性子宫肌瘤一般包括浆膜下肌瘤、阔韧带肌瘤及部分肌壁间肌瘤,主要向外生长形成宫外肿块,当肿瘤较小时表现为局限性向外突出[7]。病灶内部回声及解剖结构:卵巢卵泡膜细胞瘤的声像图回声在一定程度上与子宫肌瘤回声相似,当病灶内发生各种变性如玻璃样变、囊性变及钙化等,可使病灶内部回声各异;另外病灶大多发生在绝经后,卵巢不易探查,致解剖位置不易定位,此时应仔细探查双侧卵巢,注意病灶与卵巢的关系以便进行诊断[8]。卵巢卵泡膜细胞瘤起源于卵巢,当肿瘤体积较小或虽体积较大却活动度较大时,与子宫没有直接接触,与子宫外壁之间可见脂肪间隙。超声彩色多普勒检测:盆腔原发性肿瘤的血供一般来自于起源组织的供血动脉,寻找供血来源是判断肿瘤组织来源的直接征象。外突性肌瘤的血供主要来由子宫动脉或其分支,常可测及血流信号进入肿块内。卵巢卵泡膜细胞瘤的血供主要来自卵巢动脉和/或子宫动脉卵巢支,超声测及血流信号多不明显或测及少许点状血流信号。结合妇科检查:从阴道推动宫颈、宫体或从腹部推动肿块,观察肿块与子宫相对移动情况来判断肿块来源。若肿物与子宫关系密切且同步运动,则多为子宫肌瘤;反之触碰及肿物有浮球感并可活动,则多为卵巢来源肿块,但当卵巢肿块发生蒂扭转出现出血或坏死时,与周围组织(子宫、肠管或腹壁)发生粘连,触之不易活动。超声造影(contrast-enhanced ultrasound,CEUS)技术:卵泡膜细胞瘤造影剂灌注强度以稀疏,弱灌注为主,多呈周边向中央灌注[9]。常规二维超声很难将两者进行鉴别,通过CEUS技术有望鉴别卵巢卵泡膜细胞瘤和浆膜下子宫肌瘤,能够为临床的诊断及治疗提供更多信息。考虑思路:由于外突性子宫肌瘤比卵巢卵泡膜发病率高,容易首先考虑为外突性子宫肌瘤,诊断时思路应更广一些,应在尽量排除卵巢病变的情况再下结论。
卵巢纤维瘤:卵巢纤维瘤属于卵巢性索间质肿瘤,是来源于梭形胶原纤维细胞的卵巢肿瘤,90%患者发病在30岁以上,以50~60岁多见,累及单侧为主,仅4%~8%发生于双侧,而痣样基底细胞综合征患者出现卵巢纤维瘤的概率较大,患者一般较年轻,常为双侧性或多灶性;卵巢纤维瘤为无分泌功能的良性肿瘤,其中约10%患者伴有腹水形成,仅1%伴有Meigs综合征,且腹水的形成与肿瘤的大小存在一定的关系,直径在100 mm以上的纤维瘤40%可出现腹水并伴有Meigs综合征[10]。超声造影:卵巢纤维瘤为乏血供肿瘤,在增强早期大多表现为絮状低增强,增强晚期则表现为低增强[12],与卵泡膜细胞膜相似。仅从超声上很难将两者进行诊断,这时应结合相关临床症状进行鉴别。卵巢纤维瘤与卵泡膜细胞瘤声像图上两者表现极相似,不易区别,但纤维瘤发生率低于卵泡膜细胞瘤,故临床工作中遇到此类肿瘤应先考虑后者[11-12]。
卵巢恶性肿瘤:当卵巢卵泡膜发生变性坏死或伴有胸、腹积液,且CA125指标升高时,易被误认为恶性肿瘤;而卵巢恶性肿瘤的声像图表现常为外形不规则,边界不清,内回声不均匀,CDFI示内部血流信号较丰富,常呈低速低阻型,应结合患者其他相关临床症状及实验室检查以助诊断。尚建红等[13]认为不同年龄阶段发生的卵巢恶性肿瘤,其病理类型及声像学特征存在差异。青少年期以生殖细胞肿瘤为主,一般单侧发病,肿瘤最大径较大,多为实性或实性为主的混合性肿块。生育年龄和绝经期以上皮性肿瘤为主,多为混合性肿块。但生育年龄期卵巢肿瘤种类复杂,交界性肿瘤多,良恶性鉴别较困难;而绝经期恶性肿瘤声像表现较典型,实性肿块比例高,低速血流的特征更明显[13-15]。
超声造影:国内外一些研究[16-19]表明卵巢恶性肿瘤超声造影表现为灌注开始早于良性肿瘤,消退晚于良性肿瘤,为实性部分快速整体不均匀高增强。增强模式恶性组多呈快进缓退表现,良性组多表现为相对缓进相对快退型。
病灶漏诊分析如下:因绝经后病灶较小合并多发性肌瘤而漏诊2例。检查病灶操作时要善于选择合适的探头,仔细检查卵巢内部结构可在一定程度上提高敏感性、减少漏诊率,应该在时间和其他条件允许的情况下尽可能使用阴道超声,发挥其在妇科肿瘤检查方面的作用。
综上所述,典型的卵巢卵泡膜声像图特点为低回声,部分可伴后方回声衰减,形态尚规则,边界欠清或不清,CDFI示内部及周边血流信号多不明显,多发生于单侧;易被误诊为外突性子宫肌瘤、卵巢纤维瘤及卵巢恶性肿瘤,临床症状无明显特异性。术前综合超声检查及临床相关资料可在一定程度上提高卵巢卵泡膜细胞瘤的诊断率,降低漏诊及误诊率。
