基于多指标综合评分和正交设计优化雷公藤悬浮细胞总萜类物质的提取工艺
2018-12-20吴晓毅张可一王昌海
吴晓毅 张可一 张 睿 王昌海
首都医科大学中医药学院,北京 100069
中药雷公藤为雷公藤Tripterygium Wilfordii Hook.f.3~4年生根的去皮木质部,临床上可用于治疗类风湿性关节炎、慢性肾病等自身免疫性疾病[1],其所含的萜类成分是其发挥生物活性的物质基础[2]。随着药理研究深入,雷公藤甲素和雷公藤红素等萜类成分还被发现具有显著的抗肿瘤活性[3-5]。然而,受限于植物雷公藤生长周期长、萜类成分含量低及药材资源单一等因素[6-7],雷公藤萜类活性成分的供需关系严重失衡。因此,结合植物组织培养技术,提取雷公藤萜类成分具有较高的现实意义,但目前少见雷公藤悬浮细胞萜类成分提取工艺的研究。本研究以二萜类成分雷公藤甲素和雷酚内酯,以及三萜类成分雷公藤红素含量的综合评分为指标,采用正交试验优化雷公藤悬浮细胞总萜类物质的提取工艺,以期得到简单、经济、科学的提取工艺,为雷公藤萜类活性成分的获取及后续研发提供实验依据和数据支持。
1 仪器与试剂
雷公藤悬浮细胞经首都医科大学中药资源与分子生药学实验室建立培养体系及继代培养;雷公藤甲素(成都PUSH生物科技公司,批号:T0120025);雷酚内酯(上海源叶生物科技有限公司,批号:P07S8F43375);雷公藤红素(成都曼斯特生物科技有限公司,批号:MUST-14092610);甲硝唑(中国食品药品检定研究院,批号:J7ZH-1VA9)作为内标物质。甲醇(Thermo Fisher Chemical,批号:C-18419,色谱纯);乙腈(Thermo Fisher Chemical,批号:L-17369,色谱纯);甲酸(天津市福晨化学试剂厂,批号:20150807,分析纯);娃哈哈纯净水(娃哈哈集团有限公司)。
Agilent 1290/6490液相-串联质谱联用仪;1-14型台式离心机(Sigma 公司);BSA32025 型(d=0.01 g)、BT25S 型(d=0.01 mg)电子天平(Sartorius公司);KQ5200DV型数控超声波清洗器(昆山市超声仪器有限公司)。
2 方法与结果
2.1 萜类成分含量测定
2.1.1 超高液相-串联质谱(UPLC-MS)条件 超高液相色谱条件:Waters HSS T3色谱柱 (2.1 mm×100 mm,1.8 μm);流动相为 0.1%甲酸-水(A)-乙腈(B)梯度洗脱:0~2 min 60%A,2~10 min 60%→10%A,10~14 min 10%A,14~14.01 min 10%→60%A,14~16 min 60%A;柱温30℃;流速0.3 mL/min;进样量5 μL。质谱条件:电喷雾离子源(ESI);正负离子交替模式检测;DMRM定量模式;雷公藤甲素 361.1→128.0(50 eV,定量),105.0(50 eV);雷酚内酯 313.0→225.0(23 eV,定量),183.0 (33 eV);雷公藤红素 451.1→215.0 (20 eV),201.0(26 eV,定量);内标物甲硝唑 172.0→127.9(15 eV,定量),82.0(15 eV)。
2.1.2 对照品溶液制备 分别精密称取 0.62、4.05、0.72、0.80 mg的雷公藤甲素、雷酚内酯、雷公藤红素和甲硝唑标准品,用色谱级甲醇定容至5 mL容量瓶中,依次得到浓度为 124.00、810.00、144.00、160.00 μg/mL的单一对照品储备液,置于4℃冰箱中保存备用。
2.1.3 供试品溶液制备 取干燥雷公藤悬浮细胞0.1 g,精密称定,按照正交设计试验方案进行提取。对提取后的样品进行补重,离心(12 000 r/min,2 min),取上清液过0.22 μm微孔滤膜,取续滤液作为供试品溶液,置于4℃冰箱中保存备用。
2.1.4 标准曲线的绘制 精密量取雷公藤甲素、雷酚内酯和雷公藤红素单一对照品溶液适量,加甲醇稀释,制成质量浓度分别为 4.96、32.40、5.76 μg/mL 的混合对照品储备液,倍比稀释,制成系列混合对照品溶液,并在每一混合对照品溶液中添加一定量的甲硝唑对照品溶液,使甲硝唑内标物浓度均为1.60 μg/mL。按“2.1.1”项下方法进样,以每个化合物的峰面积(Yi)与内标峰面积(Ys)的比值(Yi/Ys)和对应化合物的浓度(X,μg/mL)作线性回归,相关系数及线性范围分别为:雷公藤甲素 y=0.0252x+2.02×10-4(r=0.9990,0.1984~4.9600 μg/mL)、雷酚内酯 y=0.360x+0.840(r=0.9990,1.2960~32.4000 μg/mL)、雷公藤红素 y=1.33x-0.0314(r=0.9966,0.2304~5.7600 μg/mL),结果表明该方法线性关系良好。
2.1.5 重复性试验 精密称取同一批雷公藤悬浮细胞5份(每份0.1 g),每份加入30倍量80%甲醇,称重,室温浸渍12 h后,超声提取0.5 h,补重,离心,取上清液过滤,过 0.22 μm 微孔滤膜,取续滤液,按“2.1.1”项测定3个萜类成分及内标物峰面积,根据标准曲线计算浓度,雷公藤甲素、雷酚内酯和雷公藤红素的RSD依次为1.93%、3.01%和3.40%(n=5),表明方法重复性良好。
2.1.6 精密性试验 取“2.1.5”项下的5号样品作为供试品溶液,按“2.1.1”项连续进样5次,记录3个萜类成分及内标物峰面积,根据标准曲线计算浓度,雷公藤甲素、雷酚内酯和雷公藤红素的RSD值依次为2.04%、1.63%和2.36%(n=5),表明该仪器精密度良好。
2.1.7 稳定性试验 取“2.1.5”项下的5号样品作为供试品溶液,分别于 0、2、4、6、8、12 h 按“2.1.1”项进样测定,记录3个萜类成分及内标物峰面积,根据标准曲线计算浓度,雷公藤甲素、雷酚内酯和雷公藤红素的 RSD 值依次为 1.66%、1.49%和 3.37%(n=6),表明样品在12 h内稳定。
2.1.8 加样回收率试验 分别取0.05 g雷公藤悬浮细胞,共5份,每份精密加入0.5 mL混合对照品储备液,样品制备过程同前,分别按照“2.1.5”项和“2.1.1”项进行样品制备和进样测定。雷公藤甲素、雷酚内酯和雷公藤红素的平均回收率依次为97.07%、104.53%和 99.29%,RSD 值为 5.24%、2.14%和 4.96%(n=5),具体结果见表1,符合含量测定的要求。
2.2 提取方法的选择
称取雷公藤悬浮细胞3份,每份0.1 g。第1份样品中加入20倍量80%甲醇室温浸渍12 h;第2份样品加入20倍量80%甲醇超声提取1 h;第3份样品加入20倍量80%甲醇室温浸渍12 h后,超声提取1 h。各样品经提取后补重,离心,取上清液过0.22 μm微孔滤膜,取续滤液,按“2.1.1”项进样测定。采用外标法计算雷公藤甲素、雷公藤红素及雷酚内酯从雷公藤悬浮细胞中转移出来的提取得率,结果见表2。结果表明,与单独使用室温浸渍法和超声处理法相比,室温浸渍+超声处理法可以获得较多的雷公藤甲素、雷公藤红素及雷酚内酯。

表1 8个萜类成分的加样回收率结果(n=5)

表2 不同提取方法对3种萜类成分的提取率(μg/g)
2.3 多指标综合评分
2.3.1 AHP法计算权重 考虑到雷公藤甲素为雷公藤药材和制剂中的常用质控性成分[8-11],雷公藤红素为雷公藤中生物活性较强的代表性三萜类成分[12],故从主观上将3个指标划分为:雷公藤甲素>雷公藤红素>雷酚内酯,运用一致性矩阵法构造判断矩阵[13-15],见表3。根据评判结果完成数据的归一化处理,计算得到雷公藤甲素、雷公藤红素和雷酚内酯的权重系数分别为0.637、0.258和0.105。一致性比例因子CR=0.03<0.10,表明此判断矩阵具有满意的一致性,权重系数有效[16]。

表3 指标成对比较的判断优先矩阵
2.3.2 计算多指标综合评分 综合评分=(雷公藤甲素含量/雷公藤甲素最大含量×0.637+雷公藤红素含量/雷公藤红素最大含量×0.258+雷酚内酯含量/雷酚内酯最大含量×0.105)×100。
2.4 单因素考察
2.4.1 甲醇浓度考察 称取0.1 g雷公藤悬浮细胞,共4份,分别加入30倍量30%、50%、80%和100%的甲醇溶液,称重,室温浸渍12 h后,超声提取1 h,各样品经提取后补重,离心,取上清液过0.22 μm微孔滤膜,取续滤液,按“2.1.1”项进样测定,计算综合评分,结果见图1A。表明随着甲醇浓度的增加,综合评分升高,80%以后趋于平缓,考虑到提取成本,选择甲醇浓度在30%~80%为宜。
2.4.2 提取时间考察 称取0.1 g雷公藤悬浮细胞,共4份,分别加入30倍量80%甲醇溶液,称重,室温浸渍 12 h 后,分别超声提取 0.5、1、1.5、2 h 时样品,各样品经提取后补重,离心,取上清液过0.22 μm微孔滤膜,取续滤液,按“2.1.1”项进样测定,计算综合评分,结果见图1B。表明随着时间的延长,综合评分略有提高,但变化不明显,故为缩短提取时间并保证提取效率,控制提取时间在0.5~1.5 h为宜。

图1 甲醇浓度、提取时间及溶剂用量对综合评分结果的影响
2.4.3 溶剂用量考察 称取0.1 g雷公藤悬浮细胞,共4 份,分别加入 15、20、30、50 倍量 80%甲醇,称重,室温浸渍12 h,超声提取1 h,各样品经提取后补重,离心,取上清液过0.22 μm微孔滤膜,取续滤液,按“2.1.1”项进样测定,计算综合评分,结果见图1C。表明当溶剂用量在30~50倍时,综合评分趋于平缓,考虑到提取效率及经济成本,选择溶剂用量为30~50倍为宜。
2.5 正交试验设计
根据单因素考察试验结果,考察可能影响提取效果的 3个因素:甲醇浓度(A)、提取时间(B)、溶剂用量(C),按照 L9(34)表设计正交试验,以 3 种指标的综合评分为指标,试验设计及结果见表4,方差分析见表5。由直观分析可知,各因素对综合评分的影响顺序为C>B>A,最佳提取工艺为A2B1C3。方差分析表明因素C对提取效果有显著性影响,因素A和B则无显著性影响。综合提取效率和工艺可行性,最佳提取工艺为:加入50倍量80%甲醇,浸渍12 h后,超声提取0.5 h。
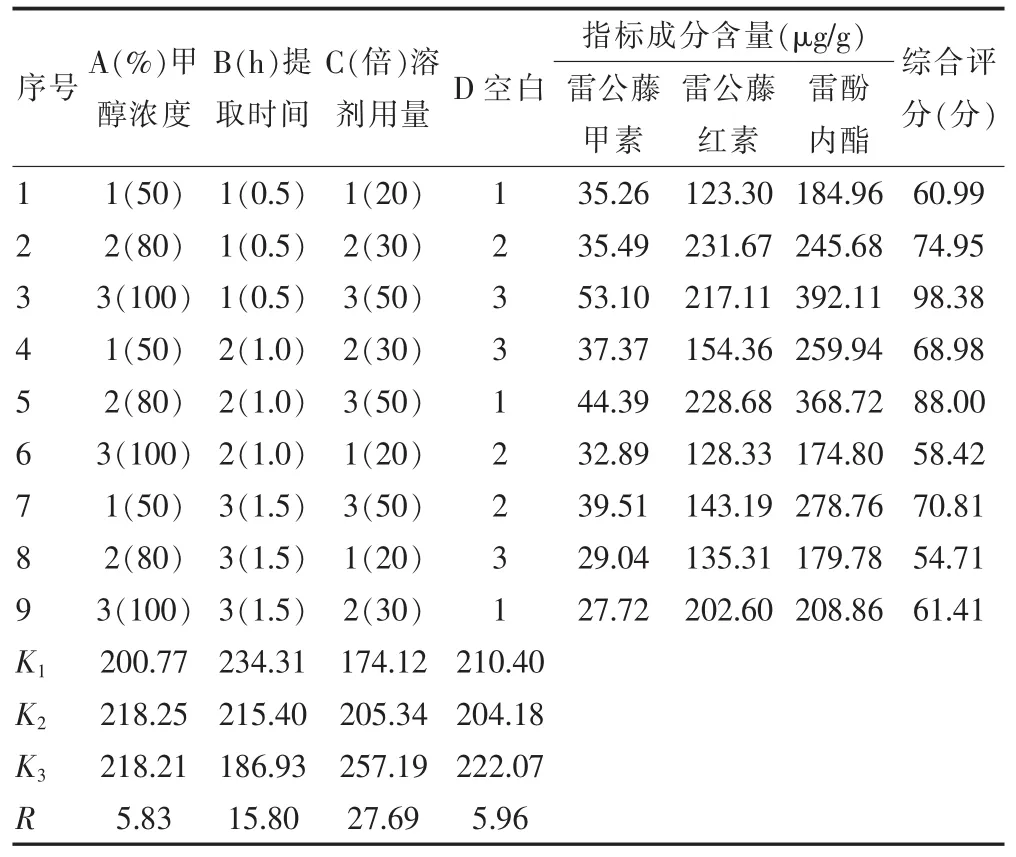
表4 提取工艺L9(34)正交设计试验及结果

表5 方差分析结果
2.6 验证试验
精密称量0.1 g雷公藤悬浮细胞,共3份,按照最佳工艺条件A2B1C3进行5次验证试验,结果雷公藤甲素、雷公藤红素和雷酚内酯的平均含量依次为(52.36±0.60)、(170.73±1.57)、(388.14±5.89) μg/g,且 RSD 值在2%以内,综合评分稳定,见表6。表明该工艺的稳定性好,具有一定的可行性,可供大规模提取应用。

表6 提取工艺验证结果(μg/g)
3 讨论
由于植物雷公藤生长周期较长,且所含的雷公藤甲素等萜类活性次生代谢产物含量较低,故为缩短实验周期,提高实验效率,扩大雷公藤中活性次生代谢产物的药用来源,发展与雷公藤悬浮细胞相关的提取、鉴定和定量技术势在必行。因此,优化雷公藤悬浮细胞萜类成分提取工艺具有一定的现实意义和应用前景。本研究通过多指标综合评分法和正交设计优化得到雷公藤悬浮细胞总萜类物质的最佳提取工艺为:加入50倍量80%甲醇,浸渍12 h后,超声提取0.5 h。
在对雷公藤悬浮细胞中雷公藤甲素、雷公藤红素和雷酚内酯等多种萜类成分进行UPLC-MS测定后,发现雷公藤甲素的出峰时间相对较快(RT=2.7 min),雷公藤红素的出峰时间相对较慢(RT=11.5 min),而雷酚内酯的相对含量最高,故以雷公藤甲素、雷公藤红素和雷酚内酯的得率来判断雷公藤悬浮细胞中总萜类成分的提取率切实可行。同时,考虑到本研究选用多指标进行提取方法的优化,故选用应用较为广泛的主观权重系数AHP法计算权重系数[17-21],综合考虑各指标间的相关性和数据的变异性,既能反映提取物有效成分的综合信息,又能为工艺的优化增加合理性,保证试验结果稳定可靠。
