2型糖尿病视网膜病变与骨生化标志物的相关性分析
2018-12-19娄阳徐进于智超
娄阳 徐进 于智超
山东大学附属省立医院内分泌科,山东 济南 250000
糖尿病高发病率及年轻化趋势日益明显[1],糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病常见的微血管并发症,是成年人视力受损及致盲的主要原因,本研究分析了T2DM患者视网膜病变程度与骨代谢生化标志物的相关性及可能机制,进一步证明T2DM患者骨质疏松可能为微血管病变的另一种表现。
1 材料和方法
1.1 研究对象
1.1.1纳入标准:①符合1999年WHO糖尿病诊断标准;②年龄>40岁的自然绝经的女性。
1.1.2排除标准:①患有糖尿病足及其他严重感染、糖尿病急性并发症如糖尿病酮症酸中毒、高血糖高渗状态、糖尿病乳酸性酸中毒等;②长期应用影响骨代谢及治疗骨质疏松的药物,如钙剂、骨化三醇、双膦酸盐、糖皮质激素、抗癫痫药物、锂铝中毒、细胞毒或免疫抑制剂等;③除外骨软化症、成骨不全、Paget骨病等其他代谢性或遗传性骨病;④伴有影响视网膜病变或者继发性骨质疏松的疾病,如性腺及肾上腺疾病、库欣综合征、甲状腺及甲状旁腺疾病、类风湿性关节炎、多发性骨髓瘤、黄斑病变及视神经炎等。
根据纳入和排除标准,选取178例自2016年3月至2018年2月在山东省立医院住院治疗的2型糖尿病患者列入本次研究,搜集患者的基本资料(年龄、病程、绝经时间、计算BMI=体重/身高2(kg/m2))、视网膜病变程度、C肽、HbA1C、Ca、P、Ca×P、N-MIDoc、β-CTX、T-PINP、VitD-T、PTH、右前臂BMD及T值等。
1.2 检测方法
入院患者给予常规眼底照相检查,根据1984年中华医学会眼科学分会糖尿病视网膜病变分期标准:1期:微血管瘤、小出血点;2期:硬性渗出;3期:棉絮状软性渗出;4期:视网膜有新生血管,玻璃体积血;5期:纤维血管增殖,玻璃体机化;6期:牵拉性视网膜脱离,失明。其中1~3期为背景性糖尿病视网膜病变(BDR),4~6期为增殖性糖尿病视网膜病变组(PDR)。根据视网膜病变程度分为A组:无视网膜病变期(NDR)72例;B组:背景性视网膜病变期(BDR)57例;C组:增殖性视网膜病变期(PDR)49例。
分类标准和实验室检测:眼底检查和糖尿病视网膜病变的诊断:采用Canon公司生产的CR-2数字眼底照相机由专业工作人员对所有患者进行眼底检查和眼底照相,经眼科医生评估,按照以上提及的1984年中华医学会糖尿病视网膜病变分期标准及分组标准,将入选患者分为无视网膜病变组(NDR)、背景性视网膜病变组(BDR)、增殖性视网膜病变组(PDR)。
PTH采用放射免疫法测定;N-MIDoc、ViTD-T、β-CTX和T-PINP采用罗氏公司电化学发光法测定;C肽、HbA1C、Ca、P采用罗氏全自动生化分析仪测定。主要骨生化标志物PTH、N-MIDoc、BCTX和T-PINP的批内和批间变异系数分别为(3.6%~5.1%和5.6%~7.8%)。右前臂BMD及T值由EXA3 000双能X射线骨密度仪测定。
1.3 统计学处理
首先对各项资料进行K-S检验正态性,对于非正态资料进行转换;连续性资料以均数±标准差表示,各组间比较采用单因素方差分析(ANOVA),P<0.05进一步两两比较采用LSD-t检验,计数资料采用卡方检验。相关性估计采用Spearman相关分析,P<0.05为差异有统计学意义。
2 结果
2型糖尿病视网膜病变各组血生化指标及一般情况比较:各组间例数、年龄、BMI、Ca、P、Ca×P、HbA1C差异无统计学意义(P>0.05);病程呈上升趋势且A组与B组、C组之间差异有统计学意义(P<0.05);C肽有下降趋势且C组与A组间差异有统计学意义(P<0.05)(表1)。
2型糖尿病视网膜病变各组骨代谢指标比较:各组间PTH、N-MIDoc差异无统计学意义(P>0.05);β-CTX有上升趋势且C组与A组、B组之间差异有统计学意义(P<0.05);T-PINP有上升趋势且A组与B组、C组之间差异有统计学意义(P<0.05);VitD-T、右前臂BMD及T值有下降趋势且各A组与B组、C组之间差异有统计学意义(P<0.05)(表2)。
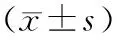
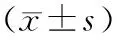
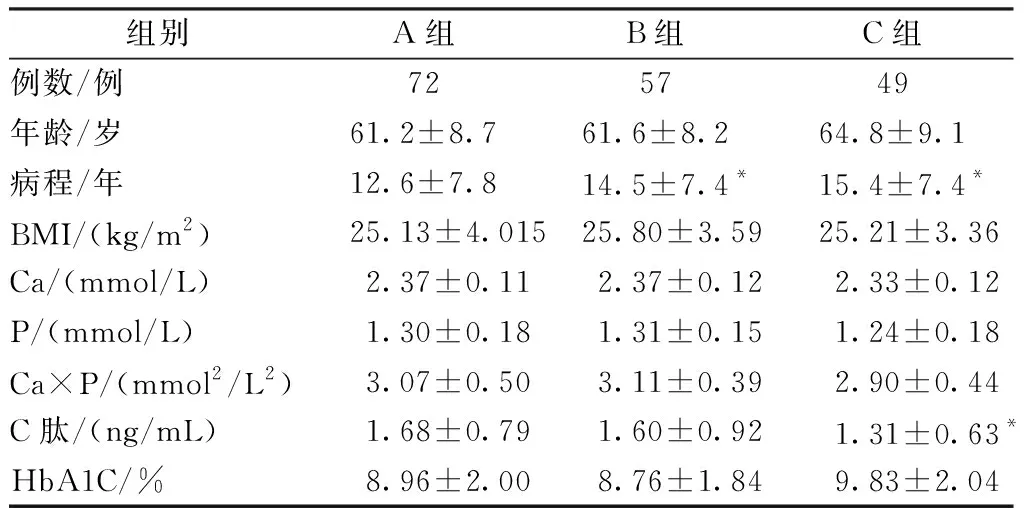
组别A组B组C组例数/例725749年龄/岁61.2±8.761.6±8.264.8±9.1病程/年12.6±7.814.5±7.4*15.4±7.4*BMI/(kg/m2)25.13±4.01525.80±3.5925.21±3.36Ca/(mmol/L)2.37±0.112.37±0.122.33±0.12P/(mmol/L)1.30±0.181.31±0.151.24±0.18Ca×P/(mmol2/L2)3.07±0.50 3.11±0.392.90±0.44C肽/(ng/mL)1.68±0.791.60±0.921.31±0.63*HbA1C/%8.96±2.008.76±1.849.83±2.04
注:与A组比较,*P<0.05。
Spearman相关分析示分别以病程、C肽及HbA1C为因变量,各骨代谢指标为自变量(表3),病程与右前臂BMD及T值呈负相关,相关系数为-0.167、-0.273;C肽与ViTD-T呈正相关,相关系数为0.239;HbA1C与PTH、N-MIDoc、T-PINP呈负相关,相关系数为-0.202、-0.22及-0.146。
表2 2型糖尿病视网膜病变各组骨代谢指标比较Table 2 Comparison of bone metabolic markers among the groups of patients with type 2 diabetic retinopathy
注:与A组相比,*P<0.05,与B组相比,#P<0.05。
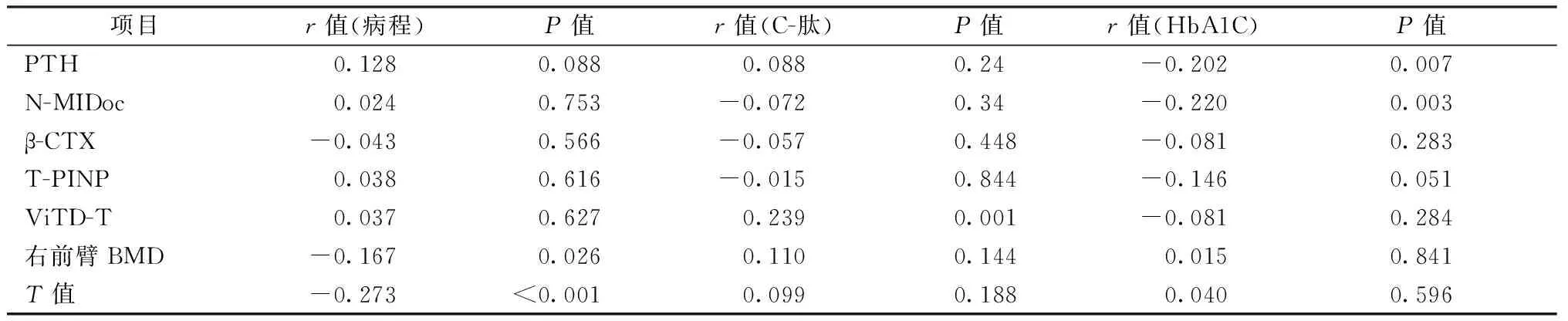
表3 病程、C-肽及HbA1C与各骨代谢指标的相关性分析Table 3 Correlation analysis of course of disease, C- peptide, and HbA1C with bone metabolism indexes
3 讨论
本研究以绝经后2型糖尿病女性患者为研究对象,排除了DM分型、性别等影响因素,且各组间年龄、BMI差异均无统计学意义。
β-CTX有上升趋势且C组与A组、B组之间差异有统计学意义(P<0.05);T-PINP有上升趋势且A组与B组、C组之间差异有统计学意义(P<0.05)。在骨质疏松的疾病进展中,骨密度改变可直观地反映骨质情况,但骨密度变化落后于骨代谢生化指标,因此可通过骨代谢指标来反映骨代谢现状、预测骨折风险、决定是否预防性抗骨质疏松治疗及评估抗骨质疏松药物疗效[2]。T- PINP和β-CTX是国际骨质疏松基金会推荐使用的骨代谢标志物。血清PINP水平反映成骨细胞合成骨胶原的能力及骨转换的速率。且PINP不受激素等外源性因素影响,是反映骨形成的稳定性较好的特异和敏感指标[3]。β-CTX可间接反映破骨细胞活性,且β-CTX在肾脏中不被降解,是反映骨吸收的稳定性较好的理想标志物[4]。有研究表明,糖尿病视网膜病变程度与骨形成及骨吸收的速率具有一致性,微血管病变时骨呈现高转换状态,反映了微血管病变可能对骨质疏松有促进作用[3]。微循环病变的大致程序为:微循环功能性改变→内皮受损→基膜增厚→血粘度增高→红细胞聚集→血小板粘附和聚集→形成微血栓或微血管闭塞→骨组织血供不足→破坏骨髓基质干细胞的增殖及分化功能→骨代谢异常,骨矿化异常[5]。糖尿病微血管病变不仅涉及视网膜、肾脏及神经组织等,会影响到全身多处微循环系统,可影响骨血管分布,导致为骨小梁供能的微血管出现变形、狭窄、萎缩甚至断裂,血管周围基底膜增厚,骨小梁供血不足,长期缺血使小梁骨表面出现微骨裂及微骨折[6-7],进而影响骨重建,减低骨量。而微血管病变常伴有神经病变,扰乱局部骨组织的神经营养,加快骨转换从而加重骨量流失[8],因此有研究提出骨质疏松发生的主要原因是微血管病变[5]。
随着糖尿病视网膜病变程度的加重,25-羟基维生素D(VitD-T)水平呈明显下降趋势,且C组与A组、B组之间差异存在统计学意义(P<0.05)。25-羟基维生素D(VitD-T)是维生素D在体内的主要存在形式,维生素D是一组脂溶性类固醇衍生物,近来发现其与糖尿病尤其是糖尿病微血管病变的进展密切相关,在调节机体钙磷代谢、血管保护、抑制胰岛β细胞凋亡、炎症防御、减轻胰岛素抵抗、免疫调节等多个方面发挥重要作用[9-10],已有研究[11]表明糖尿病视网膜病变(尤其视网膜增殖病变)患者的活性维生素D的血液浓度低于正常,糖尿病微血管病变导致血清维生素D含量降低的可能原因:①糖尿病会引起多系统代谢紊乱,表现为食欲亢进和易饥,伴胃肠神经病变,微血管病变还会导致消化道平滑肌变性,高血糖本身和胃肠道分泌的某些生物活性物质,如胃动素水平的改变也明显影响胃肠道运动功能,导致肠钙对活性维生素D吸收减少及作用减弱;②糖尿病微血管病变影响肝肾功能,维生素D活化及1,25二羟基维生素D3(1,25 dihydroxy vitamin D3,1,25(OH)2D3)合成进一步减少[12];③糖尿病患者常因全身乏力而缺乏适当的户外活动及日光照射,导致人体维生素D生成不足;④糖尿病患者可能存在下丘脑-垂体-肾上腺轴(HAP)功能紊乱导致糖皮质激素相对不足,抑制了肾脏1α羟化酶活性,降低了1,25(OH)2D3的合成[13];⑤糖尿病患者由于严格饮食控制,尤其是富含维生素D的高脂肪性的动物性食品摄入减少,导致维生素D不足[5]。维生素D血管保护效应可能机制:①保护毛细血管内皮:视网膜组织血管内皮生长因子和转化生长因子-β1表达受抑制而减少血管内皮细胞和周细胞的凋亡,从而减少毛细血管的通透性;②保护胰岛功能而减少血管并发症:给糖尿病模型大鼠补充VitD可保护胰岛素细胞,改善胰岛素分泌[13]。其机制可能是与胰岛β细胞维生素D受体结合可促进第一时相胰岛素分泌,主要降低餐后高血糖。减低由长期餐后高血糖导致的代偿性高胰岛素血症,延缓胰岛功能衰竭,从而减低糖尿病并发症(包括视网膜、肾脏病变及大血管病变等)的发生[14];③抑制新生微血管系统:通过抑制血管生成素-2的生成从而下调胰岛素样生长因子1基因途径和肾素-血管紧张素系统的表达,与转化生长因子-β1的作用相拮抗,减少视网膜新生血管的形成[15-16]。维生素D缺乏促进骨质疏松的原因:①维生素D缺乏可抑制骨细胞分泌骨钙素,骨钙素是骨形成的标志物,其减少会导致骨矿化速率减慢[15];②维生素D调节钙磷代谢,维持血清钙磷浓度的稳定,以及促进肠内钙磷吸收和骨质钙化,具有活性的维生素D可作用于小肠粘膜细胞的细胞核,从而促进运钙蛋白的生物合成。运钙蛋白和钙结合成可溶性复合物,从而加速了钙的吸收[17],长期缺乏维生素D会导致钙磷代谢紊乱,而钙磷缺乏使骨合成原料不足,影响骨质;③维生素D参与维持骨骼发育,可与甲状旁腺素(PTH)相互作用,长期维生素D的缺乏可上调PTH水平,甚至引起代偿性甲状旁腺功能亢进,PTH可动员骨钙入血,加快破骨细胞活动,使骨质脱钙,导致骨质疏松[18]。
右前臂BMD及T值有下降趋势且各A组与B组、C组之间差异有统计学意义(P<0.05),1型糖尿病尤其是绝经后女性患者的骨密度会显著降低[19],而2型糖尿病患者初期以胰岛素抵抗为主,胰岛功能尚可,体内胰岛素质量欠佳但水平常高于正常,过剩的胰岛素与成骨细胞表面的胰岛素受体结合,使骨胶原合成功能亢进,骨密度值增高[20]。但胰岛功能会随病程的进展而下降,从胰岛素抵抗伴胰岛素分泌不足转为胰岛素分泌不足伴胰岛素抵抗,因胰岛素缺乏及高血糖对成骨细胞的毒性作用使骨胶原合成减少,同时绝经后女性由于雌激素缺乏,对破骨细胞的抑制作用减弱[21],促进骨质疏松的发生。
综上所述,2型糖尿病患者微血管病变与骨质疏松具有一致性,糖尿病骨病可能是糖尿病微血管病变的另一种表现方式,所以对于2型糖尿病患者的治疗,不仅要关注慢性血管并发症,同时要尽早预防骨质疏松的发生,延缓糖尿病并发症进程,从而减轻糖尿病患者家庭及整个社会的经济和心理负担。由于本研究样本量偏小,数据代表性偏弱,希望在今后的研究中能进一步深入。
