大鼠下腔静脉型巴德-吉亚利综合征动物模型的制备
2018-12-19方伟伟成德雷吕维富陈晓明刘开才
方伟伟,成德雷,吕维富*,朱 楠,陈晓明,刘开才
(1.安徽医科大学附属省立医院影像科,安徽 合肥 230001;2.安徽省五河县人民医院影像科,安徽 蚌埠 233300;3.安徽医科大学第二附属医院消化科,安徽 合肥 230601)
巴德-吉亚利综合征(Budd-Chiari syndrome, BCS)是肝静脉(hepatic vein, HV)和/或其开口以上的下腔静脉(inferior vena cava, IVC)阻塞,导致门静脉(portal vein, PV)和/或IVC高压的临床症候群[1],根据阻塞部位可分为HV阻塞型、IVC阻塞型和混合型[2],西方国家以HV阻塞型BCS较常见,而亚洲国家则以IVC阻塞型为主[3-4]。目前有关BCS的相关基础研究及动物模型造模研究相对较少[5-7]。本研究通过部分结扎大鼠肝后段IVC建立IVC阻塞型BCS模型,旨在为BCS研究提供实验基础。
1 材料与方法
1.1实验对象 健康成年雄性SD大鼠36只[购于安徽省立医院实验动物中心,许可证号:SCXK(苏)2005-0001],体质量185~235 g。普通饲料喂养。饲养环境:室温15℃~25℃,湿度50%~60%,保持饲养室良好通风及洁净。采用随机数字法将其均分为模型组和对照组,每组18只。本研究经安徽医科大学动物伦理委员会批准。
1.2模型制备 术前实验鼠停饲1日(不停水)。以10%水合氯醛(0.3 ml/100 g体质量)腹腔注射麻醉动物,腹部备皮后保定于实验台,常规消毒、铺巾。取剑突下腹部正中切口,逐层进腹后分离镰状韧带,下压肝脏暴露肝后段IVC,游离IVC,将3F微导管(泰尔茂)平行紧贴IVC,并以0号线环绕扎紧后抽出微导管,关腹前给予青霉素每只20 U腹腔灌洗,再逐层缝合,术后连续5天肌肉注射青霉素每只20 U。对照组暴露而不结扎IVC,其余步骤同模型组。术前和术后处死前每日称取大鼠体质量。
1.3肝功能指标检测 于术后第28天以眼眶后静脉丛采血法取1~2 ml静脉血,检测肝功能指标,包括谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、谷氨酰转移酶(glutamyltransferase, GGT)、白蛋白(albumin, ALB)、总胆红素(total bilirubin, TBIL)、直接胆红素(direct bilirubin, DBIL)及碱性磷酸酶(alkaline phosphatase, ALP)。
1.4影像学检查
1.4.1超声检查 术后第84天,停饲8 h后对大鼠进行腹部超声检查,记录肝脏和脾脏大小、形态、内部回声,观察HV、PV和IVC是否通畅、有无狭窄、有无肝内和/或肝外侧支形成。
1.4.2DSA检查 术后第85天,暴露大鼠任意一侧下肢股静脉,置入21G留置针,行DSA,观察IVC阻塞段及侧支静脉形成情况。
1.5病理检查 DSA后第2天,采用上述同样方法麻醉大鼠,开腹取大鼠肝脏、脾脏样本,采用游标卡尺测量脾脏长径、宽度及厚度,并用电子分析天平(Mettler Toledo PL403)称重。取肝左叶约1 mm×1 mm×1 mm组织块固定于2.5%戊二酸磷酸盐缓冲液,以透射电镜(JEM-1230型)观察肝细胞的细胞膜、细胞核、粗面内质网、光面内质网及线粒体等结构。取适量肝脏及脾脏固定于4%甲醛溶液,经石蜡包埋、切片,行常规HE染色,光学显微镜(Nikon 80i)观察肝脏、脾脏形态学改变。
1.6统计学分析 采用SPSS 19.0统计分析软件。计量资料以±s表示。采用独立样本t检验或t'检验比较2组大鼠体质量、脾脏质量,以及脾脏长径、宽度、厚度和肝功能指标;对2组组内术前和术后第7天、第21天大鼠体质量进行方差齐性检验,采用重复测量设计资料的方差分析进行比较。以P<0.05为差异有统计学意义。
2 结果
2.1建模情况 模型组大鼠术中死亡1只,术后分别于第7天及第11天因感染死亡2只,余15只成功建模,建模成功率83.33%(15/18)。模型组大鼠生长缓慢,毛色灰暗无光泽;术后第3天9只出现对疼痛反应减低;术后第4天均出现活动减少、食欲减退、对外界刺激反应迟缓;术后第12~21天均出现体质量增加,
表1 模型组与对照组大鼠不同时间点的体质量比较(g,±s,n=15)
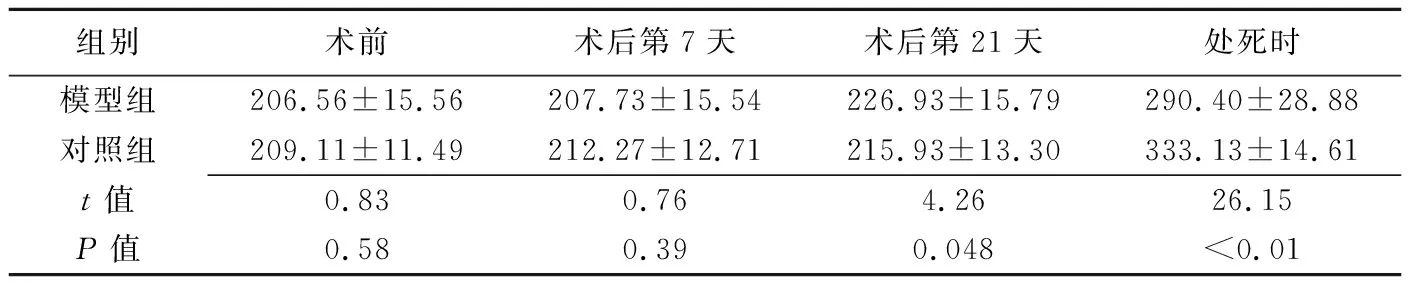
表1 模型组与对照组大鼠不同时间点的体质量比较(g,±s,n=15)
组别术前术后第7天术后第21天处死时模型组206.56±15.56207.73±15.54226.93±15.79290.40±28.88对照组209.11±11.49212.27±12.71215.93±13.30333.13±14.61t值0.830.764.2626.15P值0.580.390.048<0.01
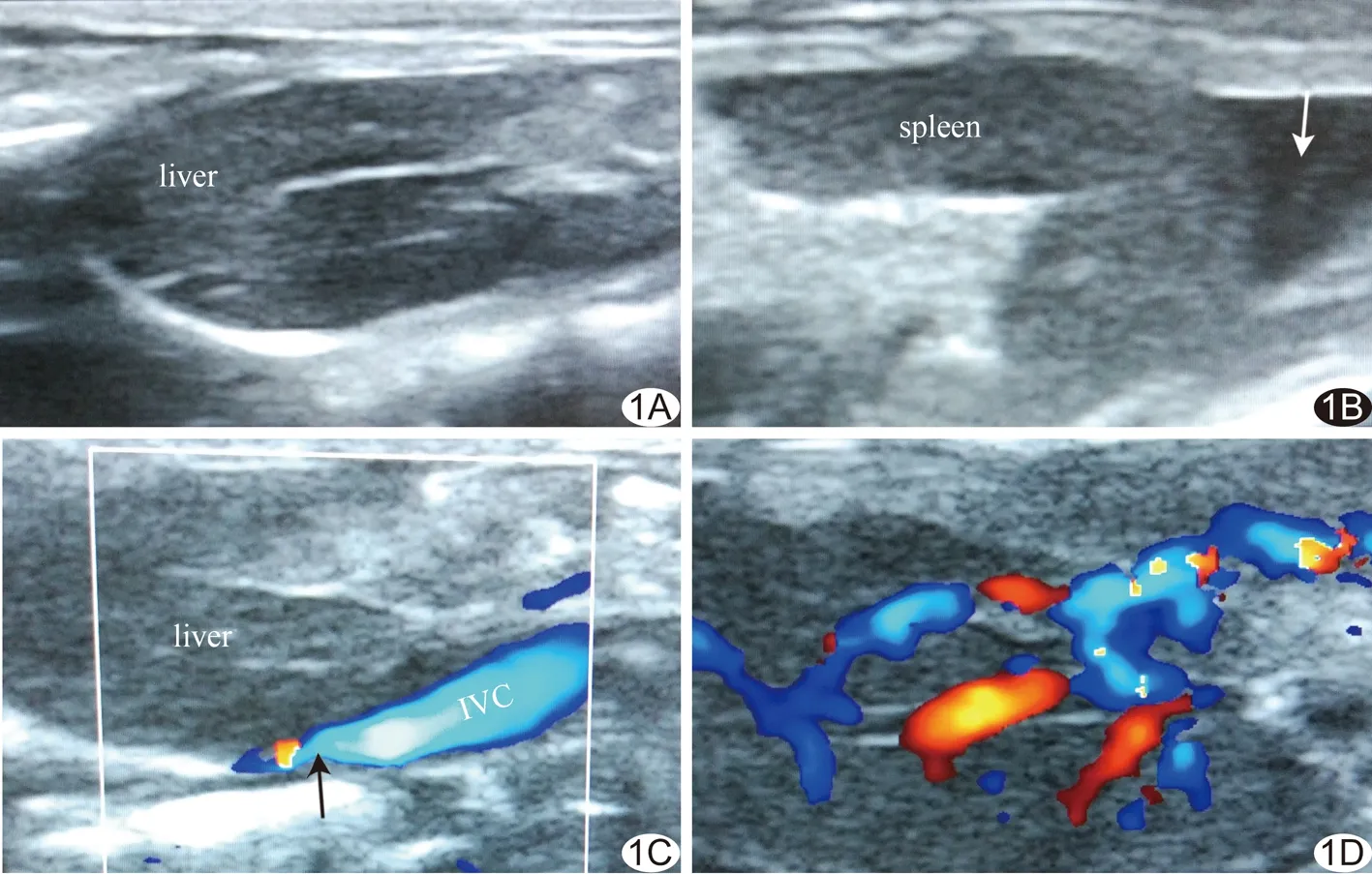
图1 大鼠腹部超声 A.对照组大鼠肝脏体积不大,肝内回声均匀,肝周未见液性暗区,IVC未见明显狭窄; B.模型组大鼠脾脏周围可见液性暗区(箭),脾脏肿大; C.箭示狭窄端IVC; D.肝内静脉形成交通支,血流丰富 (liver:肝脏;spleen:脾脏;IVC:下腔静脉)
腹部膨隆、腹壁紧张,于术后第15天随机抽取其中6只行腹腔穿刺,可抽出淡黄色液体;术后第28天开始大鼠腹部膨隆、腹壁紧张缓解,体质量降低。术后第86天处死时,大鼠腹腔内均可见淡黄色积液,3只可见明显胃肠道淤血、胀气扩张,7只可见腹壁浅静脉及腹腔侧壁静脉纡曲增粗。
对照组大鼠术中死亡1只,术后第6天死于感染1只,术后第10天不明原因死亡1只,余15只存活,死亡率16.67%(3/18)。15只大鼠术后前3天均对疼痛反应减低,后活动如常、饮食正常,反应机警,体质量呈逐渐增加趋势,未出现BCS相关症状。
2.2体质量变化 2组组内不同时间点大鼠体质量差异均无统计学意义(P均>0.05);2组术前、术后第7天大鼠体质量差异无统计学意义,术后第21天模型组大鼠体质量高于对照组,处死时对照组大鼠体质量高于模型组,见表1。
2.3肝功能情况 术后第28天,模型组大鼠ALT、AST、ALP、GGT、TBIL较对照组升高(P均<0.05);而DBIL和ALB差异无统计学意义(P均>0.05),见表2。
2.4超声表现 模型组:肝、脾肿大,肝脏实质回声增粗,肝、脾周围和肠间隙可见明显液性暗区;肝内静脉淤血扩张并可见丰富肝内交通支;IVC阻塞,远端管腔不同程度扩张;12只结扎处IVC变窄,余3只结扎处IVC完全闭塞;IVC内有高回声血栓形成,血流充盈缺损,严重者腔内未见血流充盈;IVC周围可见新的侧支血管。对照组:肝、脾不大,内部回声均匀,腹腔未见液性暗区;肝内静脉无明显扩张、无交通支,IVC未见狭窄或扩张,血流通畅。见图1。
2.5DSA表现 模型组:IVC结扎处管腔明显变窄,狭窄段管径均<0.8 mm(狭窄率>80%),对比剂线性通过,其远端管腔扩张,并可见腰升静脉开放,IVC血流通过侧支循环汇入上腔静脉,同时胸腹腔内侧壁曲张静脉可显影。对照组:IVC未见明显狭窄,回心血流通畅。见图2。
2.6病理学表现 大体病理:模型组大鼠肝脏呈暗紫色,以肝脏边缘较为明显,肝脏淤血肿大,被膜紧张,表面呈粟粒样改变,触之质韧,其中6只大鼠肝脏与膈肌粘连;对照组肝脏呈暗红色,表面光滑,质地柔软,其中3只大鼠肝脏与膈肌粘连。模型组和对照组脾脏长径分别为(36.80±2.90)mm和(30.60±1.96)mm(t=5.61,P<0.01),宽度分别为(7.00±0.76)mm和(6.47±0.91)mm(t=1.74,P=0.93),厚度分别为(3.93±0.70)mm和(3.73±0.80)mm(t=0.73,P=0.47),脾脏质量分别为(0.68±0.10)g和 (0.37±0.27)g(t=9.15,P<0.01)。
表2 模型组与对照组大鼠术后第28天时肝功能情况(±s,n=15)
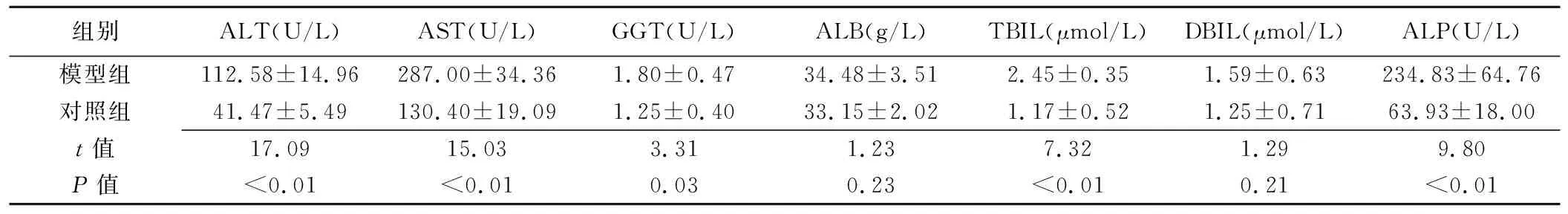
表2 模型组与对照组大鼠术后第28天时肝功能情况(±s,n=15)
组别ALT(U/L)AST(U/L)GGT(U/L)ALB(g/L)TBIL(μmol/L)DBIL(μmol/L)ALP(U/L)模型组112.58±14.96287.00±34.361.80±0.4734.48±3.512.45±0.351.59±0.63234.83±64.76对照组41.47±5.49130.40±19.091.25±0.4033.15±2.021.17±0.521.25±0.7163.93±18.00t值17.0915.033.311.237.321.299.80P值<0.01<0.010.030.23<0.010.21<0.01
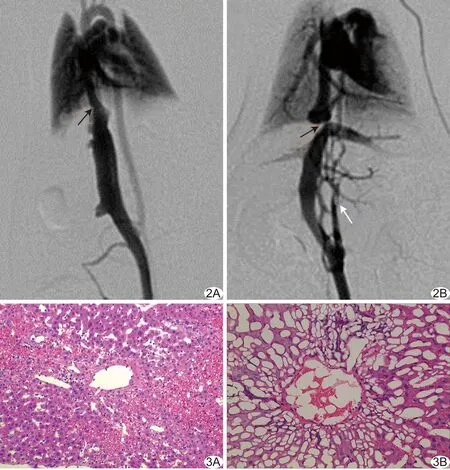
图2 DSA表现 A.对照组,箭示大鼠膈下IVC,管腔未见明显狭窄及扩张; B.模型组,黑箭示膈下IVC明显狭窄,狭窄段管腔直径约0.8 mm,白箭示腰升静脉开放并汇入上腔静脉 图3 模型组病理图 A.肝细胞排列紊乱,正常肝细胞索消失,肝小叶中央静脉及其周围肝血窦扩张,其内可见大量红细胞淤积(HE,×200); B.肝小叶中央静脉周围肝细胞广泛脂肪样变性(HE,×400)
光镜下见模型组肝细胞索紊乱,肝细胞肿胀、脂肪样变性;较严重区域肝小叶结构消失,肝细胞坏死,炎性细胞浸润,中央静脉及肝血窦扩张、淤血,汇管区纤维增生和轻度纤维化,尚无纤维间隔包绕形成假小叶(图3);脾脏见脾窦轻度扩张,窦内皮细胞增生,脾小体萎缩;对照组肝细胞呈多面形,细胞核大而圆,核仁清晰;胞质丰富、呈粉红色;肝细胞相互连接成肝细胞索;脾脏未见异常。
透射电镜见模型组肝细胞局限性水肿,肝细胞内细胞器减少,线粒体嵴断裂或空泡变性,肝细胞胞质内大量脂滴堆积,粗面及光面内质网扩张,周围线粒体减少,肝细胞核膜裂隙增宽;对照组大鼠肝细胞形态正常,内有丰富的线粒体、高尔基体,核膜清晰。
3 讨论
IVC阻塞型是亚洲国家最常见的BCS分型。既往汪海军等[6]采用外科手术缩窄家兔HV主干制备BCS动物模型;王春喜等[8]利用介入技术制备HV阻塞型BCS动物模型,对设备、技术要求高,成本亦高,不能高度模拟IVC阻塞型,且选择性阻塞HV可导致相应肝叶缺血坏死、萎缩,其余肝叶代偿性增大,不能很好地模拟BCS的自然病程发展过程。
本研究借鉴Akiyoshi等[9]的方法制备IVC阻塞型BCS,建模成功率83.33%。术中选用3F微导管代替玻璃棒,可避免完全结扎IVC造成的急性肝功能衰竭,且微导管柔顺性较好,还可避免术中造成气胸或肝脏损伤。此法制备IVC阻塞型BCS模型成本低,所需器械、试剂及药品易于获得;大鼠为常用实验动物,易获得、造价低,且易饲养,管理方便;其肝脏解剖结构与人类相似度较高,动物模型模拟性强;术中操作简单,便于推广及大批量造模,所获模型可高度模拟我国多发型BCS疾病类型。
建模后第12天始,模型组大鼠体质量逐渐增加,腹部穿刺抽出淡黄色液体,提示腹腔积液形成:PV压力升高时,腹腔内脏血管床静水压升高,组织液回收减少而漏入腹腔,从而形成腹腔积液。建模后第28天始模型组大鼠腹腔积液逐渐减少,与肝内交通支及周围侧支静脉形成有关:腹部超声证实肝内静脉出现广泛交通支,下腔静脉DSA发现腰升静脉开放,病理见腹壁及腹腔内侧壁浅静脉纵行纡曲、扩张,与BCS患者腹部静脉曲张形成原因类似,均为IVC阻塞后导致IVC高压症候群。建模后模型组大鼠食欲减低,与胃肠道血流回心受阻、胃肠道淤血有关。出现大量腹腔积液时,上述症状加重,导致模型组大鼠生长缓慢。
术后第28天,模型组大鼠ALT、AST、ALP、GGT及TBIL较对照组升高,提示长期肝脏淤血造成肝细胞损伤,肝、脾大体标本及电镜观察均可见相关表现。部分结扎IVC后,HV回心血流受阻,淤血从肝小叶中心静脉开始一直扩展到肝血窦,长期肝脏血流回流不畅可致肝内PV、HV和肝动脉血液循环失衡,造成肝细胞缺氧和养料供给障碍,进而发生非炎性坏死,炎性细胞浸润,汇管区纤维增生并形成纤维分隔。
我国多数BCS患者主要以腹腔积液、胸腹壁静脉曲张和肝脾肿大等症状就诊[10]。本研究所制动物模型均存在腹腔积液、胸腹壁静脉曲张和肝脾肿大等PV及IVC高压症候群,与BCS临床表现相似;影像学检查显示大鼠IVC及HV血液回流受阻,IVC管径狭窄甚至闭塞,同时见侧支循环开放,与临床IVC阻塞型BCS相类[11]。
综上所述,部分结扎大鼠肝后段IVC所建立的IVC阻塞型BCS动物模型可较好地模拟IVC阻塞型BCS患者的临床表现及病理生理改变。